吸烟者胸部手术后自控静脉镇痛效果观察
蔡兴志,于爱兰,张宗旺,刘冬华,张 平
(聊城市人民医院,山东聊城252000)
烟草危害是当今世界最严重的公共卫生问题之一,长期吸烟者可产生尼古丁依赖。据报道[1,2],约30%的手术患者在术前长期吸烟,而尼古丁依赖/戒断与术后疼痛的关系已引起麻醉医师关注。目前,大多数研究集中在尼古丁鼻腔吸入或透皮贴剂的镇痛作用方面,吸烟对术后疼痛影响的临床研究少见[3]。2013年1~12月,我们回顾性分析了吸烟对胸部手术患者术后自控静脉镇痛(PCIA)效果的影响。现报告如下。
1 资料与方法
1.1 临床资料 同期于聊城市人民医院实施胸部手术及术后PCIA的患者152例,均为男性,年龄18~74(58±10)岁,体质量44~90(65±9)kg,ASA 分级Ⅰ~Ⅱ级;行食管癌根治术92例,肺叶切除术52例,纵隔肿瘤切除术8例。其中术前吸烟者(吸烟史>1 a、每日吸烟量≥10支、戒烟时间≤7 d,术后实施PCIA期间未吸烟)82例(S组),非吸烟者(无吸烟史或术前戒烟时间>3个月)70例(NS组)。排除标准:有吸烟史但每日吸烟量<10支或术前戒烟时间在8 d~3个月;术前有疼痛病史并服用镇痛药物;术中复合应用硬膜外麻醉或神经阻滞;术后24 h内实施二次手术及术后需入住重症监护病房;伴严重器官功能障碍。两组年龄、ASA分级及原发病等一般资料具有可比性。
1.2 麻醉及PCIA方法 两组麻醉方式均为气管插管或支气管插管静吸复合全身麻醉,应用丙泊酚、芬太尼、顺式阿曲库铵静脉麻醉诱导,术中吸入七氟醚维持麻醉,间断静脉注射芬太尼和顺式阿曲库铵,维持 PETCO2在35~40 mmHg。两组术后均实施PCIA,术毕转入麻醉后恢复室,待患者意识清醒后启动PCIA泵。镇痛药物为质量浓度0.8 μg/mL的舒芬太尼,单次给药2~3 mL,锁定时间5 min,4 h限量30~40 mL,无背景剂量。PCIA的目标为静息时疼痛数字评价量表(NRS,每2 h评估1次)疼痛评分≤4分,NRS>4分时追加负荷量2~5 mL或加大单次给药剂量至3~4 mL,超过原设定4 h限量时将其增至40~45 mL。NRS>7分或舒芬太尼相关毒副作用明显时,静脉注射对乙酰氨基酚1 g,2 h内疼痛无明显缓解者静脉注射曲马多100 mg。
1.3 观察指标 记录术中的芬太尼用量、手术时间及术后24、48 h的舒芬太尼用量,对应用其他镇痛药物进行补救者按等效舒芬太尼量进行换算统计[4,5];术后0~48 h,每 4 h 采用 NRS 评估一次静息与咳嗽时的疼痛评分;观察有无镇痛相关不良反应。
1.4 统计学方法 采用SPSS13.0统计软件进行分析。计量资料以±s表示,组间比较采用单因素方差分析或重复测量的方差分析。计数资料以例表示,采用 χ2检验或 Fisher精确概率法比较。P≤0.05为差异有统计学意义。
2 结果
2.1 两组术中芬太尼用量、手术时间 NS组和S组术中芬太尼用量分别为(5.4 ±1.8)、(5.3 ±1.3)μg/kg,手术时间分别为(140±26)、(135 ±28)min,组间比较,P 均 >0.05。
2.2 术后24、48 h舒芬太尼用量 S组术后24、48 h舒芬太尼累积用量及每千克体质量用量均明显大于NS组。详见表1。
2.3 术后0~48 h的 NRS评分 术后0~48 h,S组静息与咳嗽时NRS评分均高于NS组,组间比较,P 均 <0.05。详见图1、2。
表1 两组术后24、48 h舒芬太尼用量比较(μg,±s)

表1 两组术后24、48 h舒芬太尼用量比较(μg,±s)
注:与 NS组比较,*P <0.05
组别 舒芬太尼累积用量 每千克体质量舒芬太尼用量24 h 48 h 24 h 48 h NS组71 ±44 129 ±67 1.1 ±0.6 2.0 ±1.1 S 组 98 ±39* 180 ±82* 1.5 ±0.6* 2.7 ±1.3*

图1 术后两组0~48 h静息时NRS评分
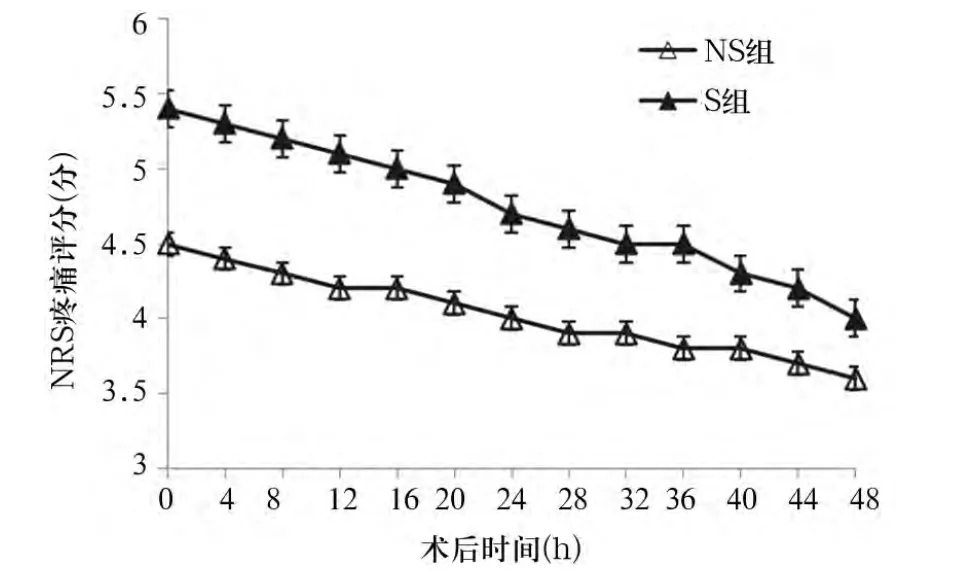
图2 术后两组0~48 h咳嗽时NRS评分
2.4 镇痛相关不良反应 术后实施PCIA期间两组均未发生过度镇静和呼吸抑制;NS组出现恶心5例(7.1%)、呕吐 2例(2.9%),S组分别为 6 例(6.1%)、1 例(1.2%),组间比较,P >0.05。
3 讨论
尼古丁是作用于中枢神经系统的主要活性物质,也是导致机体对烟草产生依赖的重要物质。动物和人体实验表明,尼古丁可通过烟碱型乙酰胆碱受体(nAChRs)发挥调制疼痛的作用。长期吸烟者可造成nAChRs脱敏及受体数量增加,产生尼古丁耐受,使机体对尼古丁的需求量增加[6]。在分别以冠状动脉旁路移植术和妇科手术患者为研究对象的两项回顾性研究[4]中,结果均显示吸烟者术后所需阿片类镇痛药比非吸烟者多。Steinmiller等[7]通过对实施膝、髋关节置换术的13例吸烟者和13例非吸烟者的对比研究发现,在控制了身高、体质量、BMI、手术开始时间、PCIA开始时间和间隔时间后,吸烟者术后对吗啡的需求量高于非吸烟者。但上述项研究均未报告术后镇痛效果。Marco等[8]发现,剖宫产后实施PCIA过程中,吸烟者的术后疼痛程度更强、麻醉药物用量较大,但该研究样本仅有7例。
本研究以创伤较大的胸部男性手术患者为研究对象,发现吸烟者术后疼痛评分和舒芬太尼需求量均增大。与上述研究结果一致。吸烟引起术后疼痛增强的可能机制如下:①改变机体对疼痛的感受和处理过程,增加疼痛的敏感性。对改良尼古丁依赖戒断大鼠切口痛模型进行的行为学测试发现,大鼠术后痛觉敏感性增高[9]。②长期吸烟者戒烟后出现的焦虑、抑郁戒断症状可增强术后疼痛的敏感性[10],患者常通过增加阿片类药物用量缓解疼痛和焦虑、抑郁等负性情感反应。③μ阿片受体参与了尼古丁耐受。Galeote等[11]对于形成尼古丁耐受小鼠的研究发现,小鼠对热刺激的甩尾潜伏期明显缩短、尾状壳核和伏核的μ阿片受体密度减少、脊髓背角的Ⅰ和Ⅱ层μ阿片受体的功能活性增强。长期尼古丁刺激可能引起nAChR和阿片受体同时在脊髓背角表达,并促使尼古丁耐受形成;这种机械刺激痛觉敏感性增高也与脊髓强啡肽水平增高有关。④通过引起内分泌系统改变调制痛觉。生理应激可激活下丘脑—垂体—肾上腺素(HPA)轴降低疼痛阈值,尼古丁也可激活 HPA轴使其镇痛作用减弱[12]。⑤影响阿片类药物的代谢。研究[13]表明,与不吸烟的慢性疼痛患者相比,吸烟者疼痛评分高,需要的镇痛药氢可酮增多、但氢可酮的血浆浓度降低。香烟中的多环芳烃可显著增强肝细胞色素P450酶活性[主要是CYP1A2、CYP2E1,其次为尿苷二磷酸葡萄糖醛酸转移酶(UGT)的亚型UGT2B7],而阿片类药物主要由这些酶代谢。但是关于吸烟状态影响吗啡和其他阿片类镇痛药代谢的机制目前尚不知。但一项对355例规律使用尼古丁的日间手术患者进行的前瞻性、多中心研究[14]发现,吸烟对患者术后麻醉恢复期和术后第一天的疼痛并无影响。原因可能为该研究中患者所实施的隆胸、腹股沟疝和关节镜手术创伤较小,且术毕均联合了局麻镇痛。
恶心、呕吐是全麻患者术后常见的不良反应,既往术后恶心及呕吐(PONV)病史、女性、低龄、大剂量阿片类药物应用、手术类型、麻醉时间等为其危险因素,多项临床研究[15]证实吸烟可降低PONV的发生。本研究中,吸烟者PONV发生率低于非吸烟者,但组间比较差异无统计学意义。原因可能为研究对象为男性患者;胸部手术PONV发生率较低;未对影响PONV的其他多因素进行相关分析。本研究的局限性包括仅对男性胸科手术患者进行了回顾性分析,对女性患者是否有同样结果尚需不明确。
总之,与不吸烟者比较,吸烟者胸部手术后疼痛程度增强、PCIA所用药物剂量增大,但PCIA相关不良反应无明显变化。
[1]Levy D,Rodríguez-Bu~nno RL,Hu TW,et al.The potential effects of tobacco control in China:projections from the China SimSmoke simulation model[J].BMJ,2014,(348):g1134.
[2]牛占丛,平芬,郝志华,等.河北省部分在职公务员吸烟状况调查及戒烟干预结果分析[J].山东医药,2013,53(25):46-47.
[3] Turan A,White PF,Koyuncu O,et al.Transdermal nicotine patch failed to improve postoperative pain management[J].Anesth Analg,2008,107(3):1011-1017.
[4]Creekmore FM,Lugo RA,Weiland KJ.Postoperative opiate analgesia requirements of smokers and nonsmokers[J].Ann Pharmacother,2004,38(6):949-953.
[5]Pereira J,Lawlor P,Vigano A,et al.Equianalgesic dose ratios for opioids:a critical review and proposals for long-term dosing[J].J Pain Symptom Manage,2001,22(2):672-687.
[6] Balfour DJ.The neurobiology of tobacco dependence:a preclinical perspective on the role of the dopamine projections to the nucleus accumbens[corrected][J].Nicotine Tob Res,2004,6(6):899-912.
[7]Steinmiller CL,Diederichs C,Roehrs TA,et al.Postsurgical patient-controlled opioid self-administration is greater in hospitalized abstinent smokers than nonsmokers[J].J Opioid Manag,2012,8(4):227-235.
[8]Marco AP,Greenwald MK,Higgins MS.A preliminary study of 24-hour post-cesarean patient controlled analgesia:postoperative pain reports and morphine requests/utilization are greater in abstaining smokers than non-smokers[J].Med Sci Monit,2005,11(6):CR255-261.
[9]刘献文,逯素芬,于爱兰,等.改良尼古丁依赖——戒断大鼠模型的建立与疼痛敏感性观察[J].国际麻醉学与复苏杂志,2013,34(7):591-594,604.
[10]Chapman CR,Turner JA.Psychological control of acute pain in medical settings[J].J Pain Symptom Manage,1986,1(1):9-20.
[11]Galeote L,Kieffer BL,Maldonado R,et al.Mu-opioid receptors are involved in the tolerance to nicotine antinociception[J].J Neurochem,2006,97(2):416-423.
[12]Parkerson HA,Zvolensky MJ,Asmundson GJ.Understanding the relationship between smoking and pain[J].Expert Rev Neurother,2013,13(12):1407-1414.
[13] Armstrong SC,Cozza KL.Pharmacokinetic drug interactions of morphine,codeine,and their derivatives:theory and clinical reality,PartⅡ[J].Psychosomatics,2003,44(6):515-520.
[14]Brattwall M,Warren SM,Rawal N,et al.Postoperative impact of regular tobacco use,smoking or snuffing,a prospective multi-center study[J].Acta Anaesthesiol Scand,2010,54(3):321-327.
[15]王瑞丽,张淑梅.地塞米松内关穴注射对口腔颌面外科女性手术患者PONV的预防效果观察[J].山东医药,2011,51(30):90-91.

