过表达Tribbles同源蛋白3促进成纤维细胞分泌I型胶原的研究
刘虹,谢琼,李勇枝,薛春美,王静,王佳平
Tribbles 同源基因 3(tribbles homolog 3,TRB3)是果蝇 tribbles 基因的哺乳动物同源基因,在啮齿类动物中亦被称为神经细胞死亡诱导假激酶(neuronal cell death-inducible putative kinase,NIPK)基因[1]。TRB3 蛋白具有广泛的生物学功能,在多条信号通路中充当了限制性的角色,并且在胚胎发育和癌症、自身免疫性疾病、糖尿病等人类疾病的发生发展中发挥作用[2]。最新的研究表明,TRB3 与纤维化疾病密切相关:纤维化的主要病理改变是组织间胶原的过度沉积,Tang 等[3]发现在心肌细胞中,TRB3 可以差异性调节多种胶原的表达,可以增加 I 型胶原的含量,同时抑制 III 型胶原的表达。在纤维化发生的过程中,成纤维细胞是I 型胶原的主要生产者[4],而目前并没有关于TRB3 调节成纤维细胞中胶原含量的报道。
腺病毒载体的外源基因装载量大、表达外源基因效率高,可以感染多种组织或细胞,且容易制得高滴度病毒载体。腺病毒载体进入宿主细胞内并不整合到宿主细胞基因组,安全性高。因而,腺病毒载体是继反转录病毒载体之后,应用范围最广泛且最具前景的病毒载体。因此,本文中使用pAdEasy-1 腺病毒载体,构建了过量表达小鼠TRB3 的腺病毒系统。
在本研究中,我们使用腺病毒系统在小鼠成纤维细胞中过量表达 TRB3,检测成纤维细胞中 I 型胶原及 III 型胶原的含量,发现 TRB3 的表达可以差异性地调节 I 型胶原与 III 型胶原的含量。这一结果为阐明纤维化疾病的发生发展提供了一定的指导意义,为治疗纤维化疾病提供了新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验细胞 3T3-NIH 细胞及 HEK293 细胞购于中国医学科学基础医学研究所细胞培养中心。3T3-NIH 细胞使用 DMEM 培养基,10% FBS培养。HEK293 细胞使用 IMDM 培养基,10% FBS培养。每隔 2 天传代一次,细胞培养条件为 37 ℃,5% CO2。
1.1.2 主要试剂 DMEM、IMDM 细胞培养基、进口血清 FBS 和胰酶购于美国 Gibco 公司;pEASY- T1 simple 载体、TransScript 反转录酶和高保真 DNA 合成酶购于北京全式金生物技术有限公司;T4 DNA 连接酶、Pme I、Pac I 限制性内切酶购于美国 NEB 公司;Trizol、Lipofectine 2000 转染试剂购于美国 Invitrogen 公司;pADEasy-1 腺病毒表达系统购于德国 Merck 公司;小量腺病毒纯化提取试剂盒购于德国 Biomega 公司;天狼猩红染色试剂盒购于英国 Biocolor 公司;抗小鼠TRB3 购于美国 Sigma-Aldrich 公司,抗小鼠β-actin 抗体购自美国 Cell-Signaling Technology公司;I、III 型胶原抗体购于英国 Abcam 公司;RIPA 裂解液、BCA 蛋白浓度定量试剂盒购于碧云天生物科技研究所。
1.2 方法
1.2.1 TRB3 目的基因的克隆 针对小鼠 TRB3基因序列(NM_175093.2)设计引物,第一轮引物为 5' AGGACAAGATGCGAGCTAC 3',5' CTGTTC ACAGCACCTAGAGC 3'。提取小鼠肝脏的 RNA,反转录得到 cDNA 作为模板,进行 PCR,退火温度为 57 ℃,延长时间为 1 min,40 个循环。以第一轮测序正确的 PCR 产物为模板,进行第二轮PCR,添加酶切位点。选择 Sal I、Hind III 为酶切位点,进行第二轮 PCR,5' ACGCGTCGACGACAA GATGCGAGCTACAC 3',5' CCCAAGCTTCTAGCC GTACAGCCCC 3',退火温度为 58 ℃,延长时间为1 min,40 个循环。将 PCR 产物进行胶回收后,连接至 pEASY- T1 simple 载体,进行测序。
1.2.2 TRB3 腺病毒的构建 参考文献[5]的方法,将测序正确的 TRB3 序列连接至 pTrack-CMV质粒中,然后使用 Pme I 限制性内切酶对其进行线性化,转化进大肠杆菌 BJ5183 中进行同源重组。在 37 ℃ 培养 24 h 后,选择较小的克隆摇菌提取质粒,使用 Pme I 内切酶进行酶切鉴定,选择鉴定正确的阳性重组子进行后续实验。
1.2.3 TRB3 腺病毒的包装 参考文献[5]的方法,将重组质粒使用 Pac I 限制性内切酶进行线性化后,转染进 HEK293 细胞中进行腺病毒的包装。培养 24 h 后换液,培养皿中可见到约 10% 的荧光,继续培养,48 h 后可见到“彗星”样荧光,第7 天补加 3 ml 培养基,到第 12 天细胞有 80%脱落时,去除培养上清,加入 3 ml 新鲜的完全培养基收集细胞。
1.2.4 TRB3 腺病毒的扩增 参考文献[5]的方法,将细胞置于 37 ℃ 5 min 后,置于 –80 ℃ 5 min,反复冻融 3 次,1140×g、4 ℃ 离心 5 min,弃去细胞碎片,将上清使用 0.22 μm 的滤器过滤,将1 ml 冻融液加入到细胞中,继续培养,进行新一轮的病毒扩增。72 h 后,待细胞有 80% 脱落时,收集细胞,将其置于 37 ℃ 5 min 后,置于 –80 ℃5 min 条件下,反复冻融 3 次。继续下一轮的扩增。反复 5 轮扩增之后,收集所有的病毒冻融液进行纯化。
1.2.5 TRB3 腺病毒纯化 按照说明书的操作步骤,使用小量腺病毒纯化提取试剂盒进行纯化,将冻融的混合物 1140×g、4 ℃ 离心 10 min,取上清,用 0.45 μm 滤膜过滤。将过滤的病毒上清液加入到平衡好的硅胶纯化柱中,柱子垂直插入冰盒,依靠重力使上清液通过纯化柱。再加入 5 ml 漂洗缓冲液洗涤纯化柱两次,向柱子中加入 5 ml 平衡缓冲液。洗脱后将洗脱液装入处理好的透析袋中,放入灭菌预冷的 PBS(pH 7.4)中,4 ℃ 低温室透析 8~10 h,中间更换 PBS 一次;使用 0.22 μm 的滤器过滤透析后的病毒液,取 50 μl 用于测定滴度,其余病毒放入 –80 ℃ 保存。
1.2.6 TRB3 腺病毒滴度测定 以 TCID50法在96 孔板中测定腺病毒的滴度。将 HEK293 细胞消化计数,每孔种 5×103个细胞以及 150 μl 的10% FBS 培养基,待细胞长满 90% 以上,更换新的 10% FBS 培养基,每孔加入使用培养基梯度稀释的病毒液,梯度设置如下:10-5、10-6、10-7、10-8、10-9,每个梯度设置 5 个孔,另设一排细胞不加病毒作为对照,培养 5 d 后观察荧光。以观察该孔是否有荧光为主,是否出现细胞病变效应为辅,有荧光反应及有细胞病变的孔确定为阳性孔,最后按照Reed-Muench method 公式计算病毒滴度。
1.2.7 Western blot 取适量培养细胞,加入 RIPA裂解液后振荡混匀,冰上放置 30 min,间或振荡;4 ℃、4560×g,离心 15 min。取上清,使用蛋白定量试剂盒测定蛋白浓度,其具体步骤参照说明书进行。调节蛋白至相同浓度,分装,加入 5 倍上样缓冲液,96 ℃ 变性 10 min,一部分用于 SDS 电泳,一部分 –80 ℃ 保存[6];使用 Amersham 显色系统显色,经 Western blot 印迹分析软件测出各条带的光密度值并分析[7]。
1.2.8 天狼猩红染色检测 I 型胶原 根据参考文献[7]的方法,收集细胞后,4 ℃、600×g 离心20 min 后取上清,按照胶原检测试剂盒说明书检测胶原含量。
1.3 统计学处理
2 结果
2.1 TRB3 目的基因克隆及载体构建
以小鼠肝脏为模板,进行 PCR 克隆 TRB3 基因序列,将 PCR 产物进行 DNA 琼脂糖凝胶电泳,得到 1200 bp 左右的条带,符合 TRB3 目的基因的大小(图 1A),经测序鉴定得到序列正确的质粒。使用双酶切,将得到的 TRB3 目的片段插入到 pTrack-CMV 的多克隆位点中,得到含有 TRB3目的片段的载体 TRB3-CMV,将其与空载体pTrack-CMV 共同进行 DNA 琼脂糖凝胶电泳,TRB3-CMV 的分子量大于空载体(图 1B),说明TRB3-CMV 构建成功。

图1 TRB3 电泳结果(A:TRB3 基因 PCR 结果;B:TRB3-CMV 电泳结果)Figure1 The electrophoresis results of TRB3 (A: PCR results of TRB3; B: Electrophoresis results of TRB3-CMV)
2.2 TRB3 腺病毒的包装
将重组后的、带有 TRB3 目的基因的腺病毒载体(Ad-TRB3)使用 Pac I 限制性内切酶进行线性化,将线性化产物转染进 HEK293 细胞中,于 37 ℃细胞孵箱中培养,进行病毒颗粒的包装,当病毒包装完毕后可以见到少量的绿色荧光(图 2A)。
2.3 TRB3 腺病毒的滴度测定

图2 转染过表达 TRB3 腺病毒质粒的倒置荧光图片(A:转染后 24 h;B:转染后 72 h)Figure2 The inverted fluorescence photo of overexpressed TRB3 adenovirus (A: Infecting for 24 h; B: Infecting for 72 h)
使用小量腺病毒纯化提取试剂盒对扩增后的病毒进行纯化并测定腺病毒的滴度,按照 Reed-Muench method 公式计算病毒滴度,计算结果为107.625TCID50/ml(表 1)。将纯化完毕的病毒再次感染 HEK293 细胞后,观察绿色荧光的表达,此时绿色荧光明显增多,表明腺病毒滴度增加(图 2B)。
2.4 鉴定 TRB3 腺病毒的表达效果
将带有 TRB3 目的基因的腺病毒感染 HEK293细胞后,使用 PCR 的方法检测 TRB3 的表达,结果显示,TRB3 的 mRNA 水平要明显高于正常HEK293 细胞以及感染对照载体 Ad-Track 腺病毒的 HEK293 细胞(图 3A)。将带有 TRB3 目的基因的腺病毒感染 HEK293 细胞后,使用 Western blot 的方法检测 TRB3 的表达,结果显示感染Ad-TRB3 腺病毒的 HEK293 细胞中,TRB3 的蛋白表达水平要明显高于正常 HEK293 细胞及感染对照载体 Ad-Track 腺病毒的 HEK293 细胞(图3B),以上的实验结果说明使用 Ad-TRB3 可以过量地表达 TRB3。
2.5 过量表达 TRB3 促进 3T3-NIH 细胞中胶原的分泌和表达
将带有 TRB3 目的基因的腺病毒 Ad-TRB3感染小鼠成纤维细胞 3T3-NIH 细胞后,使用天狼猩红染色的方法检测 3T3-NIH 细胞培养上清中胶原的含量,结果显示细胞培养上清中胶原的含量显著增加,说明过量表达 TRB3 可以显著地促进成纤维细胞分泌胶原(图 4A)。Western blot 法检测TRB3 以及 I 型胶原的表达,结果显示在感染过量表达 TRB3 的腺病毒后,TRB3 的表达显著增加,同时 I 型胶原的表达显著增加,III 型胶原的表达显著下降(图 4B)。以上的实验结果说明,过量表达 TRB3 可以增加成纤维细胞中 I 型胶原的分泌和表达,同时降低 III 型胶原的表达。

表1 按照 Reed-Muench method 公式计算病毒滴度Table1 Calculating the virus drops according to the formula of Reed - Muench method
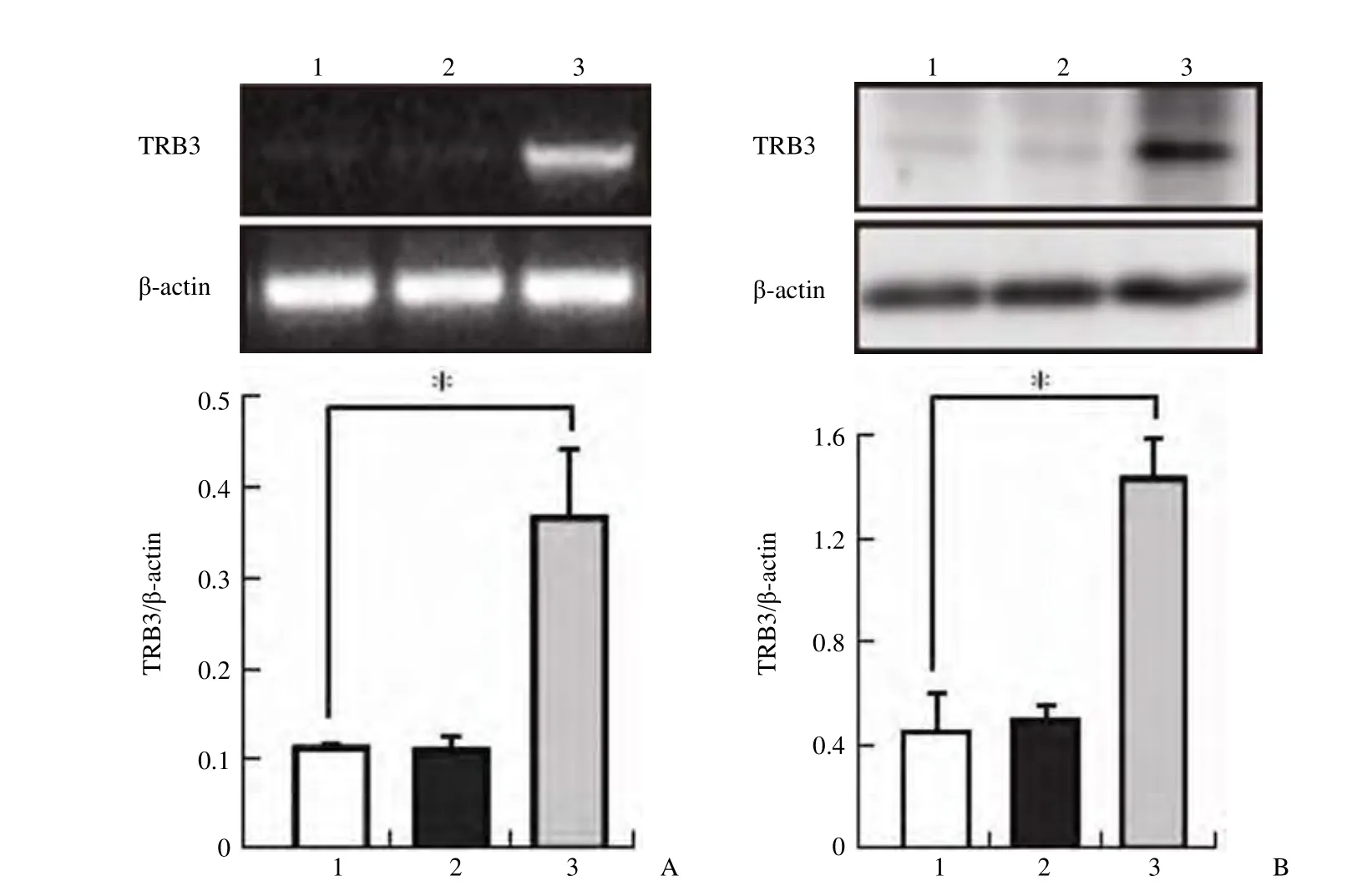
图3 使用腺病毒载体过量表达 TRB3(A:PCR 检测 TRB3 mRNA 水平;B:Western blot 检测 TRB3 蛋白水平)Figure3 The expression of TRB3 is increased in the HEK293 cells infected the adenovirus (A: Detecting the mRNA of TRB3 by PCR; B: Detecting the expression of TRB3 by Western blot)
3 讨论
TRB3 是哺乳动物 Tribbles 家族三个成员(TRB1、TRB2、TRB3)中研究得最为清楚的一个,TRB3 在 PI3/Akt、BMP、MAPK 和 ATF4/CHOP通路的信号转导以及调控中起到了重要的作用[2]。在糖尿病性心肌病中,AGEs 可以诱导 I 型胶原的产生,抑制 III 型胶原的产生,同时诱导 TRB3 的表达增加;此外,当抑制 ERK 和 p38-MAPK 后,再给予 AGEs 的刺激,I 型胶原表达下降,而 III型胶原表达升高;当使用 siRNA 抑制 TRB3 的表达后,给予 AGEs 的刺激可以使 I 型胶原表达下降,而 III 型胶原表达升高[3]。因此,在糖尿病性心肌病中,TRB3/MAPK 信号通路调节了 I 型和III 型胶原的产生。以上的研究说明,TRB3 可以通过调节胶原的含量,参与组织纤维化的发生发展。而我们的实验结果显示,增加 TRB3 的表达可以促进成纤维细胞中 I 型胶原的表达和分泌,降低 III 型胶原的含量,进一步支持了以上的研究结果。
腺病毒载体理化性质比较稳定,能很容易获得高滴度病毒系,可达 1011~1012pfu/ml,比反转录病毒高 104倍[8]。同时,腺病毒感染率高,既能感染复制状态的细胞,又能感染非复制状态的细胞[9],复制缺陷型腺病毒是目前感染率最高的病毒,质粒和反转录病毒的转染率都远低于 0.1%,腺病毒体外血管内皮细胞感染效率达 100%,体内感染率可达 15%~80%,以相同外源基因为基准,腺病毒的感染效率是质粒的 140000 倍[10]。且腺病毒载体可以容纳较大的外源性 DNA 片段(8 kb 左右)[11],腺病毒载体的细胞毒性较低,应用比较安全[12]。因此,在本研究中构建了过量表达 TRB3 的腺病毒载体,并且在小鼠成纤维细胞系 3T3-NIH 中,探讨过量表达 TRB3 后对于成纤维细胞分泌胶原的影响。

图4 过量表达 TRB3促进 3T3-NIH细胞 I 型胶原的分泌(A:天狼猩红染色法检测胶原含量;B:Western blot 法检测TRB3、I 型胶原及 III 型胶原的表达)Figure4 Overexpression of TRB3 could promote the secretion of type I collagen in mouse fibroblasts cell (A: Detecting the collagen by Sirius red staining; B: Detecting the expression of TRB3, collagen I and collagen III by Western blot)
我们在研究中将小鼠 TRB3 基因插入腺病毒载体穿梭质粒的 E1 区中,构建了携带小鼠 TRB3基因的重组腺病毒 Ad-TRB3,采用两个相同效率的启动子分别启动 TRB3 和 GFP 两个基因,从而使得 TRB3 和 GFP 两个外源蛋白同比例地高效表达,从而合成具有高效生物活性的 TRB3。而且该重组腺病毒不仅 E1 基因缺失,而且 E3 基因也缺失,使得其毒性更加降低,因而使用时更加安全可靠。本实验通过 PCR、Western blot 等分子生物学技术检测,均证明构建的 Ad-TRB3 是能够高效表达 TRB3 的,并具有很高的病毒滴度。
综上所述,使用腺病毒系统在小鼠成纤维细胞中过量表达 TRB3 可以促进 I 型胶原的表达与分泌,降低 III 型胶原的表达,说明 TRB3 可以差异性调节胶原的含量。这一研究结果为探讨 TRB3促进纤维化发生提供了新的研究方向,进一步明确了 TRB3 可以作为治疗纤维化疾病发生的潜在靶点。
[1] Mayumi-Matsuda K, Kojima S, Suzuki H, et al.Identification of a novel kinase-like gene induced during neuronal cell death.Biochem Biophys Res Commun, 1999, 258(2):260-264.
[2] Zhou Y, Zhang LQ, He FC.TRB3——A new scaffold protein signaling pathways.Chem Life, 2007, 27(4):294-296.(in Chinese)周颖, 张令强, 贺福初.TRB3——信号通路中一个新的脚手架蛋白.生命的化学, 2007, 27(4):294-296.
[3] Tang M, Zhong M, Shang Y, et al.Differential regulation of collagen types I and III expression in cardiac fibroblasts by AGEs through TRB3/MAPK signaling pathway.Cell Mol Life Sci, 2008, 65(18):2924-2932.
[4] Grinnell F.Fibroblast biology in three-dimensional collagen matrices.Trends Cell Biol, 2003, 13(5):264-269.
[5] Luo J, Deng ZL, Luo X, et al.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system.Nat Protoc, 2007,2(5):1236-1247.
[6] Hua F, Mu R, Liu J, et al.TRB3 interacts with SMAD3 promoting tumor cell migration and invasion.J Cell Sci, 2011, 124(Pt 19):3235-3246.
[7] Mi S, Li Z, Yang HZ, et al.Blocking IL-17A promotes the resolution of pulmonary inflammation and fibrosis via TGF-beta1-dependent and-independent mechanisms.J Immunol, 2011, 187(6):3003-3014.
[8] Puntel M, Kroeger KM, Sanderson NS, et al.Gene transfer into rat brain using adenoviral vectors.Curr Protoc Neurosci, 2010, Chapter 4:Unit 4.24.
[9] Zhang J, Wilson GF, Soerens AG, et al.Functional cardiomyocytes derived from human induced pluripotent stem cells.Circ Res, 2009,104(4):e30-e41.
[10] Duigou GJ, Young CS.Replication-competent adenovirus formation in 293 cells: the recombination-based rate is influenced by structure and location of the transgene cassette and not increased by overproduction of HsRad51, Rad51-interacting, or E2F family proteins.J Virol, 2005, 79(9):5437-5444.
[11] Gonçalves MA, Holkers M, van Nierop GP, et al.Targeted chromosomal insertion of large DNA into the human genome by a fiber-modified high-capacity adenovirus-based vector system.PLoS One, 2008, 3(8):e3084.
[12] Hillgenberg M, Hofmann C, Stadler H, et al.High-efficiency system for the construction of adenovirus vectors and its application to the generation of representative adenovirus-based cDNA expression libraries.J Virol, 2006, 80(11):5435-5450.

