膀胱尿路上皮癌中巨噬细胞移动抑制因子表达的临床意义
冯留伟,李铁强,侯俊清
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种广泛表达的细胞因子,其生物学功能多样,包括先天性与获得性免疫反应中的促炎作用、抑制糖皮质激素、调节 NK 细胞免疫功能、参与细胞增殖与生存、细胞迁移、DNA损伤和细胞周期调控等[1];MIF 在急性和慢性炎症病理过程中也发挥着重要作用,如感染性休克、风湿性关节炎和动脉粥样硬化等。此外,大量研究证实 MIF 在多种肿瘤中高表达,而与其紧邻的非癌细胞中 MIF 表达无明显增加[2]。但 MIF 与膀胱尿路上皮癌之间关系的报道甚少。本研究采用免疫组织化学法和 Western bolt 方法,分析 MIF 在膀胱尿路上皮癌中的表达特征及临床意义。
1 材料与方法
1.1 材料
1.1.1 膀胱癌标本 来源于河南大学淮河医院2006年泌尿外科手术病例 75 例(随访至术后5年),均经组织病理学检查,确诊为膀胱尿路上皮癌,切缘组织中未见癌组织浸润,术前均未经任何治疗。其中包括 50 名男性,25 名女性,年龄范围 39~84 岁,平均年龄(66.8 ± 5.3)岁。组织离体后立即放置 –86 ℃ 冰箱中低温保存。
1.1.2 主要试剂 免疫组化 ABC 试剂盒为美国Vector Laboratories 公司产品;兔抗 MIF多克隆抗体为美国 Santa Cruz Biotechnology 公司产品;生物素标记山羊抗兔二抗、二氨基联苯胺(DAB)显色剂购自中衫金桥公司;PVDF 为美国 Millipore公司产品;ECL购自康为世纪生物科技有限公司。
1.1.3 主要仪器 Power PACTMHC 型电泳仪及Trans-Blot SD®cell 电转系统为美国伯乐公司产品;显微镜及 TS100 成像系统为日本 Nikon 公司产品。
1.2 方法
1.2.1 免疫组织化学 膀胱尿路上皮癌及癌旁组织经 10% 多聚甲醛固定、石蜡包埋、连续切片,切片厚度 4~5 μm。石蜡切片于 70 ℃ 烤箱烘烤30 min、二甲苯脱蜡 10 min、过梯度酒精(100%、90%、80%、70%),EDTA 法修复,2% 羊血清封闭 20 min。2% BSA 作为稀释一抗(鼠源性单克隆抗 MIF 抗体,1∶100),4 ℃ 孵育过夜。生物素化二抗(羊抗鼠,1∶200)孵育 1 h。DAB 显色 5 min、苏木素复染、梯度酒精脱水、二甲苯透明后中性树胶封片。同时对照组的一抗用 PBS 代替。
结果判定:MIF 蛋白以细胞浆中出现棕黄色颗粒为阳性细胞。首先根据全部组织中肿瘤细胞染色的阳性细胞所占总细胞的比例进行评分。在低倍视野下,阳性细胞所占比例小于 10% 为 0 分,10%~ 25% 为 1 分,25%~50% 为 2 分,50%~75%为 3 分,大于 75% 为 4 分。再根据免疫染色强度进行第二次评分,阴性为 0 分,弱阳性为 1 分,中度阳性为 2 分,强阳性为 3 分。最后将 2 次得到的评分相乘即为最终所得到的免疫组化评分,满分为 12 分。
1.2.2 Western blot 选取 TNM I~IV 期膀胱尿路上皮癌及手术切缘组织各 10 对,共 40 例。取200 mg 组织,按比例加入组织蛋白裂解液,冰上匀浆 10 min,于 4 ℃、12000×g 离心 5 min,吸取上清,置于 –80 ℃ 保存。用 BCA 法测定总蛋白浓度,在 15% SDS-PAGE 上电泳,蛋白上样量为 50 μg。电泳完毕后使用电转仪将样品转印至PVDF 膜。5% 脱脂牛奶室温封闭 1 h;以鼠源性单克隆抗 MIF 抗体(1∶5000)为一抗,室温孵育2 h 或 4 ℃ 过夜。1×PBS 洗 3 次,每次 10 min,以山羊抗鼠 HRP-IgG(1∶2500)为二抗,室温孵育1 h,ECL 显色后暗室曝光,胶片扫描,图像处理分析。
1.3 统计学处理
将得到的免疫组化评分进行统计学分析。使用SPSS17.0 分析软件,各组间的分析采用 t 检验,患者预后分析采用 Kaplan-Meier 曲线和 Log-rank检验分析,患者生存时间统计标准为手术时间开始到死亡时间或者统计终止时间,以 P ≤ 0.05 为有统计学差异。
2 结果
2.1 Western b1ot 结果
40例膀胱鳞癌中,MIF 阳性表达的百分率为72.5%(29/40),部分 Western blot 结果如图 1A 所示。在 TNM I、II、III、IV 期膀胱尿路上皮癌中,MIF 高(过)表达的百分率分别为 50%(5/10)、70%(7/10)、80%(8/10)、90%(9/10),即随着临床分期的增加,其在膀胱尿路上皮癌组织中高表达比例逐渐增加(图 1B)。与此相应,手术切缘组织中 MIF 的表达量亦逐渐降低。此外,经统计学分析,TNM I 期 和 IV 期 MIF 阳性表达的差异具有显著的统计学意义(P < 0.05)。
2.2 免疫组织化学法检测结果
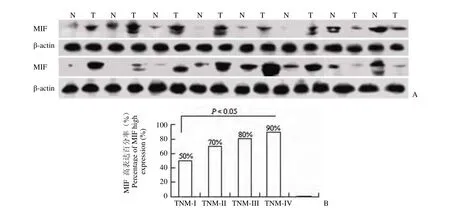
图1 Western blot 结果Figure1 Western blot result
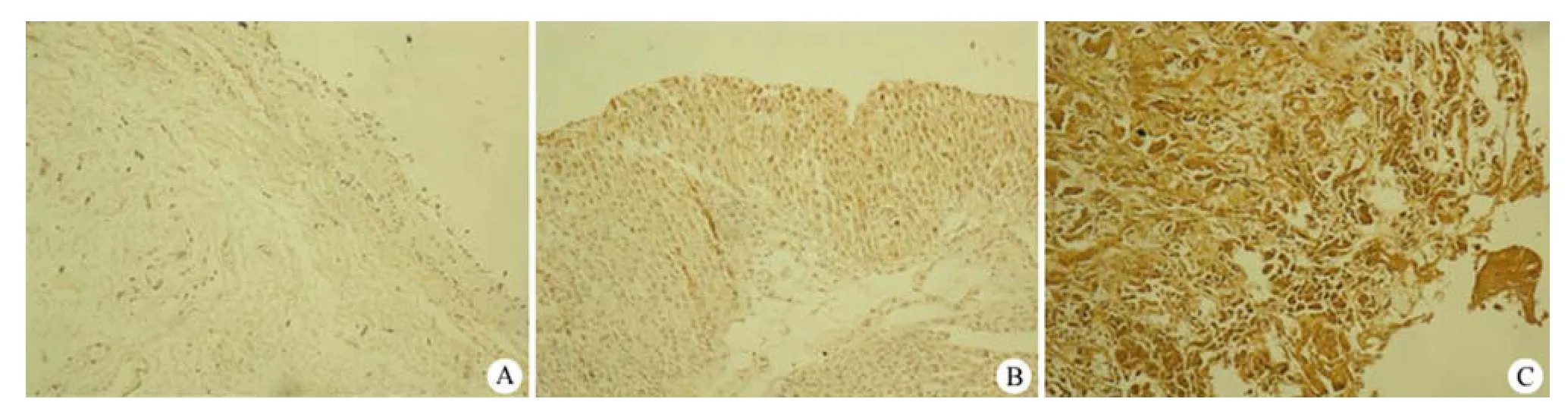
图2 MIF 在膀胱正常上皮(A)、高分化癌(B)和低分化癌(C)中的表达情况Figure2 MIF expression in normal uroepithelial (A), well-differentiated uroepithelial cancer (B), poorly-differentiated uroepithelial cancer (C)
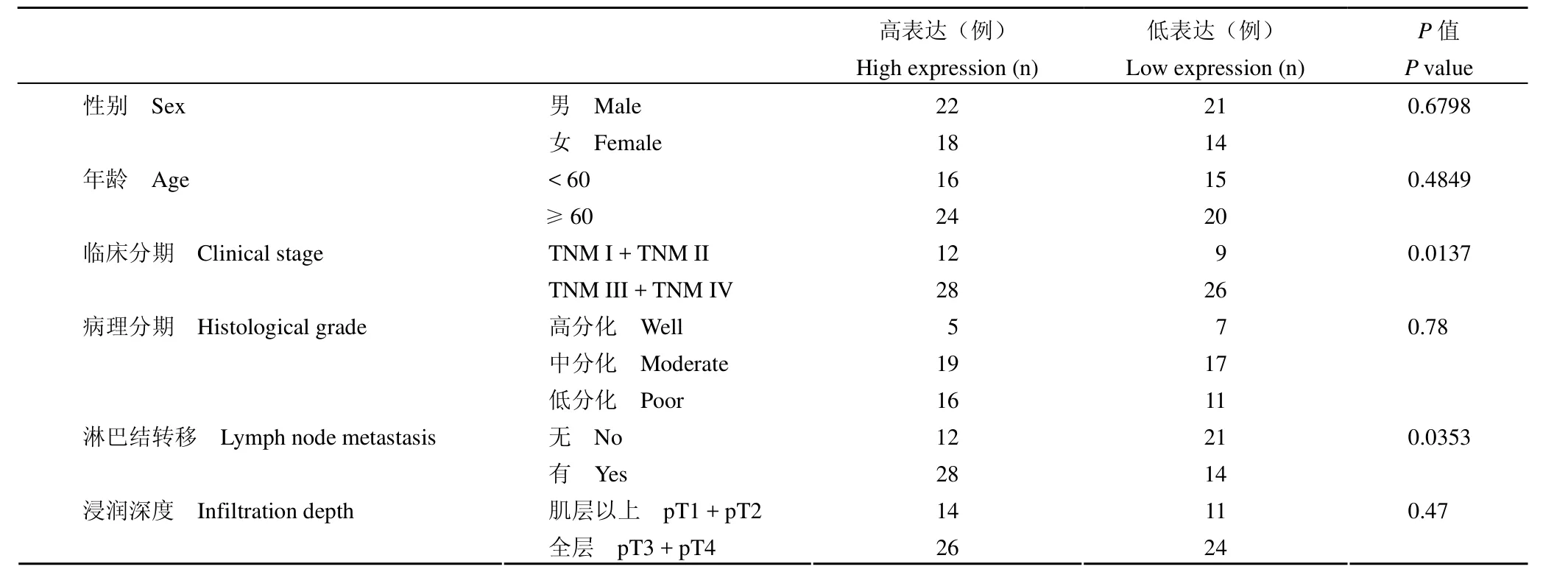
表1 MIF 表达与膀胱尿路上皮癌临床病理资料的相关性Table1 Relationship between MIF expression and clinicopathological features of uroepithelial cancer in bladder
MIF 在膀胱尿路上皮癌中的阳性表达率是78.6%(59/75),着色主要位于细胞膜,如图 2 所示。结果表明,MIF在高、中、低分化的膀胱尿路上皮癌中高(过)表达的百分率分别为 42%、52.8%、59.3%。分析 MIF 表达与膀胱尿路上皮癌 TNM分期的相关性,发现 MIF 在 TNM I、II、III、IV 期膀胱尿路上皮癌中高(过)表达的百分率分别为60%、68%、73%、100%,且 MIF 表达与膀胱尿路上皮癌的临床分期有统计学意义(I 期 + II 期与III 期 + IV 期相比,P < 0.05)。MIF 在淋巴结转移阳性和阴性的膀胱尿路上皮癌中高(过)表达的百分率分别为 66.7%、36.4%,差异有统计学意义(P < 0.05)。然而,MIF 的表达与膀胱尿路上皮癌浸润深度、性别、年龄、肿瘤位置、肿瘤大体类型无差异(表 1)。
2.3 Kap1an-Meier 生存分析
应用 Kaplan-Meier 生存分析法分析 MIF 表达与膀胱尿路上皮癌患者生存时间的相关性。图 3显示 MIF 高表达的膀胱尿路上皮癌患者生存期显著缩短(P = 0.0341),表明 MIF 的表达越高预示着患者生存时间越短,预后相对较差;相反,MIF表达较低的患者,其生存时间则较长。此外,Kaplan-Meier 生存分析法分析其他临床资料与膀胱尿路上皮癌患者的生存关系,表明淋巴结转移、TNM 分期与膀胱尿路上皮癌患者生存期显著缩短呈正相关,而年龄、性别、肿瘤位置、肿瘤类型、浸润深度与膀胱尿路上皮癌患者生存期无关。
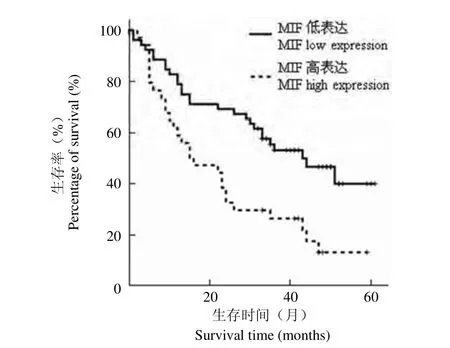
图3 MIF 的表达情况与膀胱尿路上皮癌患者生存期的关系(P = 0.0341)Figure3 Correlation between MIF expression and patients with uroepithelial cancer of bladder (P = 0.0341)
3 讨论
恶性肿瘤的形成和发生发展是一个多因素、多步骤的极其复杂的缓慢过程,多数恶性肿瘤患者确诊时已发展至中晚期,治疗措施及效果有限,是导致恶性肿瘤患者高死亡率的根本原因之一。早期诊断和治疗能够明显提高恶性肿瘤患者的治愈率,降低死亡率,延长患者生存时间。因此,近年来的研究热点之一是寻找恶性肿瘤早期诊断的生物标志物,以便早期发现肿瘤、彻底治愈[3]。
MIF 是一个分子量为 12.5 kD 的炎症因子,在急性和慢性炎症的发病机制中发挥着重要作用,如感染性休克、风湿性关节炎和动脉粥样硬化等[4]。除此之外,MIF 在多种癌症中表达水平明显升高,包括前列腺癌、乳腺癌、黑色素瘤、结肠癌和胶质瘤等[5]。不仅如此,MIF 的表达水平还与多种肿瘤患者的生存期密切相关,提示 MIF 可能与肿瘤的侵袭和转移有关[6]。因此,MIF 可能是炎症反应与肿瘤发生的纽带,在肿瘤发生发展的过程中发挥着重要作用。利用 MIF 拮抗性抗体或基因沉默技术敲低 MIF 表达可导致细胞增殖减慢,抑制肿瘤生长和血管生成,间接影响肿瘤的生长和发展进程。Piette 等[7]报道,MIF 参与人肺腺癌细胞的侵袭与转移。Rendon 等[4]和 Ren 等[8]研究报道,MIF 在胶质母细胞瘤和前列腺癌的生长和侵袭中也发挥着重要作用。
本研究通过免疫组织化学法和 Western blot方法验证了 MIF 在膀胱尿路上皮癌及边缘组织中的表达规律,结果发现:MIF 在膀胱尿路上皮癌中的阳性表达百分率为 78.6%(59/75),而在正常尿路上皮中均无表达,且与患者临床分期、淋巴结转移正相关,与患者生存时间负相关。这表明,MIF可能是膀胱尿路上皮癌变多阶段演进过程中的重要变化分子。
膀胱尿路上皮癌恶性程度越高,肿瘤浸润和转移能力越强。本研究也表明,随着膀胱尿路上皮癌恶性程度增加,MIF 在其中的表达量也显著增加(P< 0.05)。因此,我们推测 MIF 可能是膀胱尿路上皮癌早期诊断和预后判断的重要生物标志之一。
[1] Morand EF, Leech M, Bernhagen J.MIF: a new cytokine link between rheumatoid arthritis and atherosclerosis.Nat Rev Drug Discov, 2006,5(5):399-410.
[2] Honda A, Abe R, Makino T, et al.Interleukin-1beta and macrophage migration inhibitory factor (MIF) in dermal fibroblasts mediate UVA-induced matrix metalloproteinase-1 expression.J Dermatol Sci,2008, 49(1):63-72.
[3] Hill OT, Mason TJ, Schwartz SW, et al.Improving prostate cancer detection in veterans through the development of a clinical decision rule for prostate biopsy.BMC Urol, 2013, 13:6.
[4] Rendon BE, Roger T, Teneng I, et al.Regulation of human lung adenocarcinoma cell migration and invasion by macrophage migration inhibitory factor.J Biol Chem, 2007, 282(41):29910-29918.
[5] Bucala R.MIF, MIF alleles, and prospects for therapeutic intervention in autoimmunity.J Clin Immunol, 2013, 33 Suppl 1:S72-S78.
[6] Guo Y, Hou J, Luo Y, et al.Functional disruption of macrophage migration inhibitory factor (MIF) suppresses proliferation of human H460 lung cancer cells by caspase-dependent apoptosis.Cancer Cell Int, 2013, 13(1):28.
[7] Piette C, Deprez M, Roger T, et al.The dexamethasone-induced inhibition of proliferation, migration, and invasion in glioma cell lines is antagonized by macrophage migration inhibitory factor (MIF) and can be enhanced by specific MIF inhibitors.J Biol Chem, 2009,284(47):32483-32492.
[8] Ren Y, Chan HM, Fan J, et al.Inhibition of tumor growth and metastasis in vitro and in vivo by targeting macrophage migration inhibitory factor in human neuroblastoma.Oncogene, 2006, 25(25):3501-3508.

