甲羟戊酸途径代谢酶HMGL研究概述
王志标,王伟,程克棣,孔建强
3-羟基-3-甲基戊二酰辅酶 A 裂解酶(HMGL)是一种参与生物体内 3-羟基-3-甲基戊二酰辅酶 A(HMG-CoA)代谢的重要酶类,在自然界中广泛存在,具有多种功能。作为 HMGL 作用的前体物质,HMG-CoA 在生物体内主要有两方面作用。首先,HMG-CoA 可在 HMGL 作用下形成酮体,酮体能够提供能量;其次,作为甲羟戊酸途径中一个重要中间体,可用于合成甾体、辅酶 Q、萜类等生命活性物质[1-3]。
甲羟戊酸途径是存在于所有高等有核生物及一些细菌中的萜类代谢途径(图 1),基本过程为两分子的乙酰辅酶A 在乙酰乙酰辅酶 A 转移酶作用下形成乙酰乙酰辅酶 A,而后在 3-羟基-3-甲基戊二酰辅酶 A 合成酶(HMGS)作用下形成 HMG-CoA[4],3-羟基-3-甲基戊二酰辅酶 A 还原酶(HMGR)可作用于 HMG-CoA 形成甲羟戊酸(MVA)[5],MVA 依次经过激酶、脱羧酶作用后形成五碳单元异戊烯焦磷酸(IPP),从而形成相关的萜类及甾体类物质。可见HMGS 参与了 HMG-CoA 的合成,HMGR 参与了HMG-CoA 的还原,由于两者直接影响了下游途径脂类等物质的积累,一直以来广受关注,如作为限速酶 HMGR,其抑制剂在临床上被作为血脂调节剂广泛应用。而目前对该途径中分解 HMG-CoA 的 HMGL 研究甚少,本文将对HMGL 在自然界的分布、结构特点、功能及同疾病的关系等作一介绍。
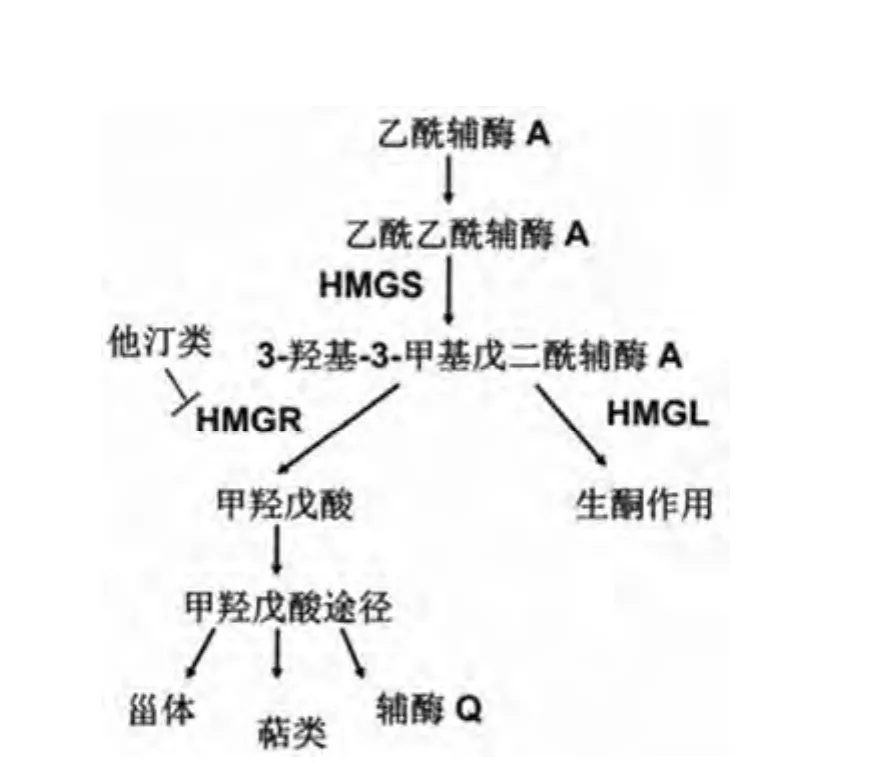
图1 甲羟戊酸途径及参与 HMG-CoA 代谢的酶
1 HMGL 的分布
高通量测序技术的发展,使来自不同物种的 HMGL 基因被发现。但迄今为止,只有为数不多的几个被部分或完全鉴定了功能(表 1)。目前已经发现的 HMGL 分布于动物、植物及微生物中。

表1 已鉴定的 HMGL 及催化特性
最早被分离鉴定的能裂解 HMG-CoA 的蛋白是直接从猪脏器蛋白中分离得到的,进一步研究发现,该蛋白活性的发挥需要二价阳离子及一些巯基化合物(如半胱氨酸)的存在[16]。在人体中发现并鉴定了 3 种类型的 HMGL[17-18],其中线粒体型 HMGL 主要参与酮体合成,过氧化体型和细胞质型的生理功能还未被完全解析。从蛋白一级结构比较,人体 3 种类型的 HMGL 也有区别,线粒体型 HMGL,其 N端含有疏水序列;定位于过氧化体的 HMGL,其 C 端含有 Cys-Lys/Arg-Leu 三肽序列;定位于细胞质中的 HMGL,其 N 端具有肉蔻酰化 Motif,可发生肉蔻酰化而后锚定于内质网[18]。Casals 等[19]指出,人 HMGL 的三级结构可能有 TIM 的桶状结构域,这一推论被 HMGL 的晶体结构证实[20]。
目前为止,在植物中还未有 HMGL 被完全鉴定,即既得到完整的蛋白又得到相应的基因信息。Hepper 和Audley[21]在研究巴西橡胶树(Hevea brasiliensis)橡胶合成前体 HMG-CoA 的代谢过程中发现了该植物中 HMGL 的存在,但并没有分离得到较纯的蛋白。Skrukrud 等[22]对续随子(Euphorbia lathyris)乳管细胞中分离得到的乳汁成分于 5000×g 离心 15 min,在上清中发现了具有能降解HMG-CoA 的成分,间接证明了该植物中 HMGL 的存在。Bach 等[23]从萝卜(Raphanus sativus L)中分离得到了可溶性的 HMGL,但得到的蛋白并不完整。此外,van der Heijden等[24]从长春花(Catharanthus roseus)细胞培养物中检测到了 HMGL 活性。
在微生物中,来源于深红螺菌(Rhodospirillum rubrum)[6]、Pseudomonas mevalonii[7]、铜绿假单胞菌(Pseudomonas aeruginose)[9]三者的 HMGL 得到了功能鉴定,同时还克隆得到了相应的核苷酸序列。在铜绿假单胞菌中编码HMGL 的基因 liuE 翻译的蛋白不仅能裂解 HMG-CoA,还能裂解 3-羟基-3-乙烯戊二酰基辅酶 A,行使 3-羟基-3-乙烯戊二酰基辅酶 A 裂解酶(HIHGL)的相关功能[25],使其不仅可以在亮氨酸代谢中起作用,还参与无环萜烯的代谢。
2 HMGL结构特点
HMGL 广泛分布,但在结构上具有较大的相似性。从序列上分析,所发现的 HMGL 均含有 G/LAGGCPY/F 的超保守区域。典型的 HMGL 三维结构上具有一保守的丙糖磷酸异构酶桶状结构域,结构域内存在能与二价阳离子结合的位点,结构域内含有三个保守的位点,分别为天冬氨酸(D)、精氨酸(R)和谷氨酸(E),这一结构域又被称为 DRE-TIM。重组的人 HMGL、羊布鲁杆菌(Brucella melitensis)HMGL 以及枯草芽孢杆菌(Bacillis subtilis)HMGL 的晶体结构证实了这一桶状结构域的存在[26]。三种氨基酸的作用分别为:天冬氨酸同二价阳离子结合;精氨酸可能参与稳定反应中间体烯醇化合物电荷稳定;谷氨酸保证结构中天冬氨酸、精氨酸处于精确的相对位置上[26]。此外,HMGL 基因编码的蛋白中含有较多的半胱氨酸,如来源于鼠的 HMGL 蛋白(NP_032280.2)325 个氨基酸中具有 6 个半胱氨酸(C),而人线粒体型 HMGL 蛋白(NP_000182)325 个氨基酸中更多达 8 个半胱氨酸。HMGL 体外酶促反应在还原剂如 DTT、β-巯基乙醇存在下可能会有提高,Hruz 等[27]利用亲和标记的方法初步探究了HMGL 中半胱氨酸的作用,发现铜绿假单胞菌的 HMGL中 C237 为活性位点,并分析了该半胱氨酸对酶活性影响大的原因可能在于在最适 pH 下,半胱氨酸可去离子,从而可以作为亲电基团进攻 HMG-CoA 的 γ 羟基,使其脱去氢离子,进而发生逆 Claisen 缩合反应,裂解为乙酰乙酸和乙酰辅酶 A(图 2)。同时,半胱氨酸过多容易形成二硫键,对活性也会有影响。例如,人线粒体型 HMGL 中,C266 若形成二硫键 HMGL 活性将丧失,原因在于 C266 处于DRE-TIM 桶状结构域入口处,形成二硫键阻挡了结构域内部活性区域同底物的结合,从而丧失活性[10]。
3 HMGL 功能及特点
正常情况下人体主要由葡萄糖氧化提供能量,当处于饥饿情况下时,血糖降低,此时大脑由于不能利用脂肪酸提供能量,酮体成为其能量的主要来源[28]。酮体的生成有赖于 HMGL 的作用,HMG-CoA 能在 HMGL 作用下裂解为乙酰乙酸和乙酰辅酶 A,乙酰乙酸可进一步转化为酮体:丙酮和 β-羟丁酸,后者可以直接进入三羧酸循环产生能量。酮体作为饥饿状态下脑部的能源物质,却不能自主生成。1955年,Bachhawat 等[16]首次从猪的脏器中分离得到了能裂解 HMG-CoA 的酶 HMGL,并对其组织分布进行了研究,发现肝脏、心脏和肾都有 HMGL 分布,而脑组织中未检测到 HMGL。

图2 HMGL 催化反应的可能机制[27]
由于 HMG-CoA 还来源于支链氨基酸的分解,HMGL也参与了该过程。支链氨基酸亮氨酸在体内分解过程大致为:氨基转移去除氨基生成 α-酮酸,而后通过氧化脱羧反应去除 α-酮酸的羧基,脱羟基生成 α,β 不饱和的酰基辅酶A 衍生物[29],HMGL 参与了亮氨酸分解代谢的最后一步,即分解 HMG-CoA[30]。
研究表明,HMGL 可参与生物合成单元碳单位的转移及分流,影响着体内某些物质的生物合成。生物体内氨基酸代谢、脂肪酸代谢、甾体合成等生理过程可以相互偶联,可利用共同的碳单元(如乙酰辅酶 A)库,该生理过程通过同位素标记代谢产物的方法已经在一系列试验中得到证实[31-34]。例如,Edmond 和 Popják[35]通过用碳同位素标记的甲羟戊酸饲喂小鼠,一段时间后同位素在脂肪酸中被检测到,其过程推测为甲羟戊酸转化为 HMG-CoA,而后被HMGL 裂解,产物进入脂肪酸代谢途径合成了脂肪酸。
4 HMGL 与疾病
动物体内 HMGL 功能若发生缺陷会引起 HMGL 缺陷性疾病。HMGL 缺陷性疾病是一种常染色体隐形遗传病,其主要症状有呕吐、脱水、低血糖、昏迷、有机酸尿症等。一般认为是 HMGL 基因发生了突变引起,如点突变(G835A、C922T、A434T[36]和 G122A[37]等),缺失两个核苷酸[38]和插入一个核苷酸[39]引起的阅读框移位,此外还有外显子间剪切位点发生突变导致的外显子拼接错误[40]。
除了 HMGL 缺陷能引起疾病外,其过表达也可能同某些疾病相关。在高等动物中,酮体可以被合成为脂类,如胆固醇。Hildebrandt 等[41]发现,在小鼠肝癌细胞细胞质中,酮体可以转化为胆固醇。近年来,有些研究认为酮体可以为肿瘤细胞提供能量,其原因推测为相邻正常细胞代谢产生的酮体可以转化为乙酰辅酶 A 进入肿瘤细胞,进而在肿瘤细胞线粒体中生成 ATP 提供能量,如乳腺癌细胞可以从邻近的纤维细胞[42],卵巢癌细胞可以从邻近的脂肪细胞[43]获得乙酰辅酶 A。Pavlides 等[44]分析了激光切割获取的小鼠乳腺癌组织的转录组情况,发现同酮体代谢相关的 HMGS、HMGL 等表达上升,其进一步指出这些基因表达的蛋白有可能成为肿瘤治疗的候选靶点。
酮体对脑部疾病也有影响,相关研究发现低热量的生酮饮食能有效地治疗恶性脑瘤[45],补充一定的酮体对阿尔茨海默症[46]、帕金森症[47]以及脑部损伤[48]等疾病均有一定的治疗作用。此外,根据 Puisac 等[49]从 mRNA、蛋白和酶活三个水平对人体脑部线粒体 HMGL 的研究证明,人体脑部并不存在与酮体生成相关的线粒体型 HMGL,因此脑部这些疾病的发展或许同人体其余组织 HMGL 表达异常相关,亦或是酮体运输出现障碍。
5 结语
HMGL 在自然界中广泛存在,种类众多但却相对保守。不同来源的 HMGL 在序列、三维结构及功能特点上均有相似性,如活性区域的桶状结构、序列中较多的半胱氨酸、活性发挥需要二价阳离子等。在功能上已经发现其不仅仅参与酮体生成、亮氨酸代谢等基本生命活动,还能为体内物质合成提供共同的碳单元。
由于参与形成的酮体能提供能量,HMGL 同人类健康息息相关。已经发现三种不同亚细胞定位的人 HMGL,不同亚型的 HMGL 由于具有不同的信号肽而定位于细胞不同的区域,虽然基本功能相同,但却可能参与着不同的生命过程。人体中线粒体型 HMGL 进入人们视线是由于HMGL 异常时会引起缺陷性疾病,导致某种功能的酶总量相对不足而不能产生足够的酮体供能引起机能障碍,而对于癌症患者有功能的酶总量过多,即 HMGL 表达上调,可能会加重病情。从治疗和药物开发的角度,对于缺陷患者在饮食上可采用生酮饮食以及开发一些能促进 HMGL 功能发挥的药物;而对某些癌症患者,应采用低酮饮食,并配合使用 HMG-CoA 的类似物作为 HMGL 的竞争性抑制剂。由于酮体代谢同大量疾病相关,相信将来会有此类药物被发现并作为辅助药物使用。
生命活动是个复杂的过程,HMGL 裂解 HMG-CoA 的产物乙酰乙酸及乙酰辅酶 A 既可以作为提供生命活动能量的物质,也可以作为直接参与生命活动物质合成的原料,可见 HMGL 在体内的平衡直接关系到能量与物质的平衡,HMGL 的异常将打破这种平衡从而影响生命活动。如何权衡这种平衡打破后带来的利弊,也是将来相关药物研究开发中需要考虑的因素。
[1] Katsuki H, Bloch K.Studies on the biosynthesis of ergosterol in yeast.Formation of methylated intermediates.J Biol Chem, 1967, 242(2):222-227.
[2] Cluis CP, Ekins A, Narcross L, et al.Identification of bottlenecks in Escherichia coli engineered for the production of CoQ(10).Metab Eng,2011, 13(6):733-744.
[3] Kuzuyama T, Seto H.Two distinct pathways for essential metabolic precursors for isoprenoid biosynthesis.Proc Jpn Acad Ser B Phys Biol Sci, 2012, 88(3):41-52.
[4] Rudney H.The biosynthesis of beta-hydroxy-beta-methylglutaric acid.J Biol Chem, 1957, 227(1):363-377.
[5] Durr IF, Rudney H.The reduction of beta-hydroxy-beta-methylglutaryl coenzyme A to mevalonic acid.J Biol Chem, 1960, 235:2572-2578.
[6] Baltscheffsky M, Brosché M, Hultman T, et al.A 3-hydroxy-3-methylglutaryl-CoA lyase gene in the photosynthetic bacterium Rhodospirillum rubrum.Biochim Biophys Acta, 1997, 1337(1):113-122.
[7] Scher DS, Rodwell VW.3-Hydroxy-3-methylglutaryl coenzyme A lyase from Pseudomonas mevalonii.Biochim Biophys Acta, 1989,1003(3):321-326.
[8] Narasimhan C, Roberts JR, Miziorko HM.Pseudomonas mevalonii 3-hydroxy-3-methylglutaryl-CoA lyase: testing the function of the active site cysteine by site-directed mutagenesis.Biochemistry, 1995,34(31):9930-9935.
[9] Chávez-Avilés M, Díaz-Pérez AL, Reyes-de la Cruz H, et al.The Pseudomonas aeruginosa liuE gene encodes the 3-hydroxy-3-methylglutaryl coenzyme A lyase, involved in leucine and acyclic terpene catabolism.FEMS Microbiol Lett, 2009, 296(1):117-123.
[10] Roberts JR, Narasimhan C, Hruz PW, et al.3-Hydroxy-3-methylglutaryl-CoA lyase: expression and isolation of the recombinant human enzyme and investigation of a mechanism for regulation of enzyme activity.J Biol Chem, 1994, 269(27):17841-17846.
[11] Kramer PR, Miziorko HM.Purification and characterization of avian liver 3-hydroxy-3-methylglutaryl coenzyme A lyase.J Biol Chem,1980, 255(22):11023-11028.
[12] Stegink LD, Coon MJ.Stereospecificity and other properties of highly purified beta-hydroxy-beta-methylglutaryl coenzyme A cleavage enzyme from bovine liver.J Biol Chem, 1968, 243(20):5272-5279.
[13] Prasanna P, Holmlund CE.Identification in tetrahymena pyriformis of 3-hydroxy-3-methyl glutaryl coenzyme a lyase: its purification and properties.Int J Biochem, 1987, 19(4):385-389.
[14] Ashmarina LI, Robert MF, Elsliger MA, et al.Characterization of the hydroxymethylglutaryl-CoA lyase precursor, a protein targeted to peroxisomes and mitochondria.Biochem J, 1996, 315(Pt 1):71-75.
[15] Arnedo M, Menao S, Puisac B, et al.Characterization of a novel HMG-CoA lyase enzyme with a dual location in endoplasmic reticulum and cytosol.J Lipid Res, 2012, 53(10):2046-2056.
[16] Bachhawat BK, Robinson WG, Coon MJ.The enzymatic cleavage of beta-hydroxy-beta-methylglutaryl coenzyme A to acetoacetate and acetyl coenzyme A.J Biol Chem, 1955, 216(2):727-736.
[17] Ashmarina LI, Pshezhetsky AV, Branda SS, et al.3-Hydroxy-3-methylglutaryl coenzyme A lyase: targeting and processing in peroxisomes and mitochondria.J Lipid Res, 1999,40(1):70-75.
[18] Montgomery C, Pei Z, Watkins PA, et al.Identification and characterization of an extramitochondrial human 3-hydroxy-3-methylglutaryl-CoA lyase.J Biol Chem, 2012, 287(40):33227-33236.
[19] Casals N, Gómez-Puertas P, Pié J, et al.Structural (beta alpha)8 TIM barrel model of 3-hydroxy-3-methylglutaryl-coenzyme A lyase.J Biol Chem, 2003, 278(31):29016-29023.
[20] Fu Z, Runquist JA, Forouhar F, et al.Crystal structure of human 3-hydroxy-3-methylglutaryl-CoA Lyase: insights into catalysis and the molecular basis for hydroxymethylglutaric aciduria.J Biol Chem,2006, 281(11):7526-7532.
[21] Hepper CM, Audley BG.The biosynthesis of rubber from beta-hydroxy-beta-methylgluarylcoenzyme A in Hevea brasiliensis latex.Biochem J, 1969, 114(2):379-386.
[22] Skrukrud CL, Taylor SE, Hawkins DR, et al.Subcellular fractionation of triterpenoid biosynthesis in Euphorbia lathyris latex.Physiologia Plantarum, 1988, 74(2):306-316.
[23] Bach TJ, Boronat A, Caelles C, et al.Aspects related to mevalonate biosynthesis in plants.Lipids, 1991, 26(8):637-648.
[24] van der Heijden R, de Boer-Hlupá V, Verpoorte R, et al.Enzymes involved in the metabolism of 3-hydroxy-3-methylglutaryl-coenzyme A in Catharanthus roseus.Plant Cell, Tissue Org Culture, 1994,38(2-3):345-349.
[25] Chávez-Avilés M, Díaz-Pérez AL, Campos-García J.The bifunctional role of LiuE from Pseudomonas aeruginosa, displays additionally HIHG-CoA lyase enzymatic activity.Mol Biol Rep, 2010, 37(4):1787-1791.
[26] Forouhar F, Hussain M, Farid R, et al.Crystal structures of two bacterial 3-hydroxy-3-methylglutaryl-CoA lyases suggest a common catalytic mechanism among a family of TIM barrel metalloenzymes cleaving carbon-carbon bonds.J Biol Chem, 2006, 281(11):7533-7545.
[27] Hruz PW, Narasimhan C, Miziorko HM.3-Hydroxy-3-methylglutaryl coenzyme A lyase: affinity labeling of the pseudomonas mevalonii enzyme and assignment of cysteine-237 to the active site.Biochemistry, 1992, 31(29):6842-6847.
[28] Hasselbalch SG, Knudsen GM, Jakobsen J, et al.Brain metabolism during short-term starvation in humans.J Cereb Blood Flow Metab,1994, 14(1):125-131.
[29] Brosnan JT, Brosnan ME.Branched-chain amino acids: enzyme and substrate regulation.J Nutr, 2006, 136(1 Suppl):207S-211S.
[30] Massey LK, Sokatch JR, Conrad RS.Branched-chain amino acid catabolism in bacteria.Bacteriol Rev, 1976, 40(1):42-54.
[31] Nes WD, Campbell BC, Stafford AE, et al.Metabolism of mevalonic acid to long chain fatty alcohols in an insect.Biochem Biophys Res Commun, 1982, 108(3):1258-1263.
[32] Nes WD, Bach TJ.Evidence for a mevalonate shunt in a tracheophyte.Proc Royal Soc London Ser B Biol Sciences, 1985, 225(1241):425-444.
[33] Brady PS, Scofield RF, Schumann WC, et al.The tracing of the pathway of mevalonate's metabolism to other than sterols.J Biol Chem, 1982, 257(18):10742-10746.
[34] Weinstock SB, Kopito RR, Endemann G, et al.The shunt pathway of mevalonate metabolism in the isolated perfused rat liver.J Biol Chem,1984, 259(14):8939-8944.
[35] Edmond J, Popják G.Transfer of carbon atoms from mevalonate to n-fatty acids.J Biol Chem, 1974, 249(1):66-71.
[36] Muroi J, Yorifuji T, Uematsu A, et al.Molecular and clinical analysis of Japanese patients with 3-hydroxy-3-methylglutaryl CoA lyase (HL)deficiency.Hum Genet, 2000, 107(4):320-326.
[37] Pospísilová E, Mrázová L, Hrdá J, et al.Biochemical and molecular analyses in three patients with 3-hydroxy-3-methylglutaric aciduria.J Inherit Metab Dis, 2003, 26(5):433-441.
[38] Mitchell GA, Robert MF, Hruz PW, et al.3-Hydroxy-3-methylglutaryl coenzyme A lyase (HL).Cloning of human and chicken liver HL cDNAs and characterization of a mutation causing human HL deficiency.J Biol Chem, 1993, 268(6):4376-4381.
[39] Mitchell GA, Jakobs C, Gebson KM, et al.Molecular prenatal diagnosis of 3-hydroxy-3-methylglutaryl CoA lyase deficiency.Prenat Diagn, 1995, 15(8):725-729.
[40] Buesa C, Pié J, Barceló A, et al.Aberrantly spliced mRNAs of the 3-hydroxy-3-methylglutaryl coenzyme A lyase (HL) gene with a donor splice-site point mutation produce hereditary HL deficiency.J Lipid Res, 1996, 37(11):2420-2432.
[41] Hildebrandt LA, Spennetta T, Elson C, et al.Utilization and preferred metabolic pathway of ketone bodies for lipid synthesis by isolated rat hepatoma cells.Am J Physiol, 1995, 269(1 Pt 1):C22-C27.
[42] Migneco G, Whitaker-Menezes D, Chiavarina B, et al.Glycolytic cancer associated fibroblasts promote breast cancer tumor growth,without a measurable increase in angiogenesis: evidence for stromal-epithelial metabolic coupling.Cell Cycle, 2010, 9(12):2412-2422.
[43] Nieman KM, Kenny HA, Penicka CV, et al.Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth.Nat Med, 2011, 17(11):1498-1503.
[44] Pavlides S, Tsirigos A, Migneco G, et al.The autophagic tumor stroma model of cancer: role of oxidative stress and ketone production in fueling tumor cell metabolism.Cell Cycle, 2010, 9(17):3485-3505.
[45] Zhou W, Mukherjee P, Kiebish MA, et al.The calorically restricted ketogenic diet, an effective alternative therapy for malignant brain cancer.Nutr Metab (Lond), 2007, 4:5.
[46] Van der Auwera I, Wera S, Van Leuven F, et al.A ketogenic diet reduces amyloid beta 40 and 42 in a mouse model of Alzheimer's disease.Nutr Metab (Lond), 2005, 2:28.
[47] Tieu K, Perier C, Caspersen C, et al.D-beta-Hydroxybutyrate rescues mitochondrial respiration and mitigates features of Parkinson disease.J Clin Invest, 2003, 112(6):892-901.
[48] Prins ML, Fujima LS, Hovda DA.Age-dependent reduction of cortical contusion volume by ketones after traumatic brain injury.J Neurosci Res, 2005, 82(3):413-420.
[49] Puisac B, Arnedo M, Casale CH, et al.Differential HMG-CoA lyase expression in human tissues provides clues about 3-hydroxy-3-methylglutaric aciduria.J Inherit Metab Dis, 2010, 33(4):405-410.

