地高辛标记探针检测重组白细胞抑制因子-水蛭肽嵌合蛋白宿主DNA残留量的研究
蔡晓娜,王鹏,贺晓强,刘立平,陈海容,郭晋霞,范开
重组白细胞抑制因子-水蛭肽嵌合蛋白(recombinant neutrphil inhibitory factor and hirulog hybrid,TNHH)是一种通过基因工程技术改造的新型嵌合蛋白,临床上可用于急性脑栓塞后的脑组织损伤修复,减少脑水肿,防止微小血栓形成从而改善微循环,是一种有前景的心脑血管疾病治疗创新药物,目前已进入临床 I、II 期研究[1-2]。由于在生产过程中使用了工程菌大肠杆菌,而宿主菌的残留 DNA 是重组药物中特有的潜在致癌性杂质,可能会随药物一同进入人体最终致癌,因此对 TNHH 原液中外源性 DNA 残留量的检测极为重要[3]。
目前对重组生物制品的残留宿主 DNA 检测方法有多种[4-6],与其他方法相比,地高辛标记探针杂交法具有灵敏度高、特异性强、对操作人员无放射危害等优点[7]。本文采用分子杂交法,从小片段基因组 DNA 的制备、纯化、处理、阳性样品的制备等方面进行优化,建立了 TNHH 制备过程中工程菌 DNA 残留的质控方法。
1 材料与方法
1.1 材料
TNHH 工程菌、TNHH 原液由重庆富进生物医药有限公司制备;地高辛标记和检测试剂盒购自美国罗氏公司;正电荷尼龙膜购自美国安玛西亚公司;细菌基因组 DNA 提取试剂盒购自美国 Invitrogen 公司。
1.2 方法
1.2.1 工程菌基因组 DNA 的制备 按照基因组 DNA提取试剂盒说明制备 TNHH 工程菌基因组 DNA,并通过1% 琼脂糖凝胶电泳和微量核酸蛋白测定仪测定 DNA 纯度和浓度,并于 –20 ℃ 冻存备用。
1.2.2 模板 DNA 的制备 超声处理基因组 DNA,恒定功率,不同超声次数得到大小不同的 DNA 样品,电泳检测 DNA 片段大小。
1.2.3 探针的制备 取 1 μg 超声处理过的基因组 DNA,加入无菌水至终体积 16 μl,沸水浴 10 min 后,立即冰浴10 min 迅速冷却。取 4 μl 地高辛高效标记引物加入变性DNA 中,混匀后 500×g 离心 20 s。37 ℃ 孵育过夜,加入 2 μl 0.2 mol/L EDTA(pH 8.0)终止反应,置于 –20 ℃ 保存。另一组 EDTA 终止后,加 5 μl 4 mol/L 氯化锂、75 μl 冰乙醇,然后置于 –20 ℃,2 h。15000×g 离心 15 min 后,用 100 μl 70% 的乙醇洗一次,风干后加 50 μl TE 缓冲液复溶上述沉淀即为纯化的探针。
1.2.4 探针标记效率的检测 先将标记好的两组探针和地高辛标记对照探针稀释成 l ng/μl,再分别依次稀释至 10、3、1、0.3、0.1、0.03、0.01 pg/μl,分别取 1 μl 各浓度样品点于尼龙膜上,经固定和封闭后,进行 Anti-DIG-AP 和NBP/BCIP 显色反应。
1.2.5 供试液的制备
1.2.5.1 阳性标准品及供试品溶液、阳性样品的制备
⑴阳性标准 DNA 溶液的制备:用 pH 8.0 的 TE 溶液稀释工程菌基因组 DNA 至 10 ng/μl,然后依次 10 倍稀释为 1 ng/μl、0.1 ng/μl、10 pg/μl、1 pg/μl、0.1 pg/μl。阴性对照为 TE 溶液。
⑵供试品溶液的制备:取 3 批 TNHH 原液,用 TE 溶液将样品稀释至每 300 μl 含 4 mg TNHH (相当于临床最大剂量)用于点膜。
⑶阳性样品的制备:取供试品 450 μl,加 10 ng/μl 标准 DNA 溶液 1.5 μl,使其中含 1.5 ng标准 DNA,即与阳性标准 1 ng 对比。
1.2.5.2 样品处理
⑴制备的阳性标准、供试品溶液及阳性样品不进行任何处理;
⑵分别按表 1 反应体系进行处理;
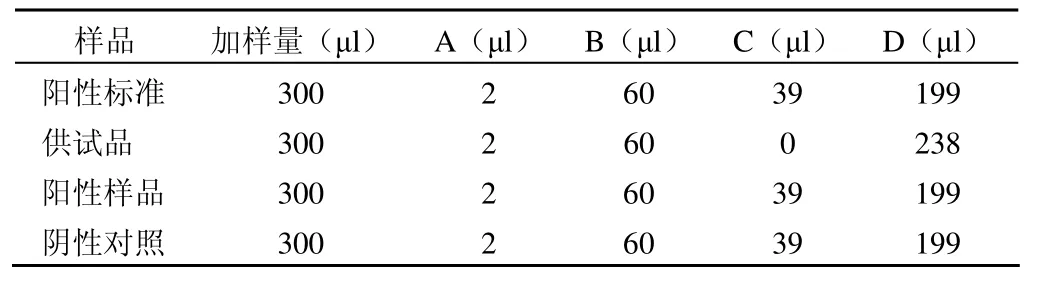
表1 样品处理反应体系
⑶按表 1 反应体系进行处理后,DNA 纯化试剂盒进行回收;
⑷按表 1 反应体系进行处理后,酚氯仿抽提法进行回收。
1.2.6 点膜、固定、杂交和免疫检测 将 1.2.5 项下不同处理方法所得阳性标准品系列、供试品、阳性样品、阴性对照品和空白对照品(未经过蛋白酶 K 预处理的 TE 缓冲液)按地高辛标记检测试剂盒说明书进行变性、点膜、固定、杂交、洗膜和免疫检测。显色后,将供试品与阳性标准比较,根据显色深浅判定原液中宿主 DNA 的含量。
2 结果
2.1 工程菌基因组 DNA 含量
工程菌基因组 DNA 的 A260/A280比值为 1.82,微量核酸测定仪测定浓度为 856 ng/μl。电泳结果如图 1 所示,制备的基因组 DNA 完整性较好,纯度较高,符合实验要求。
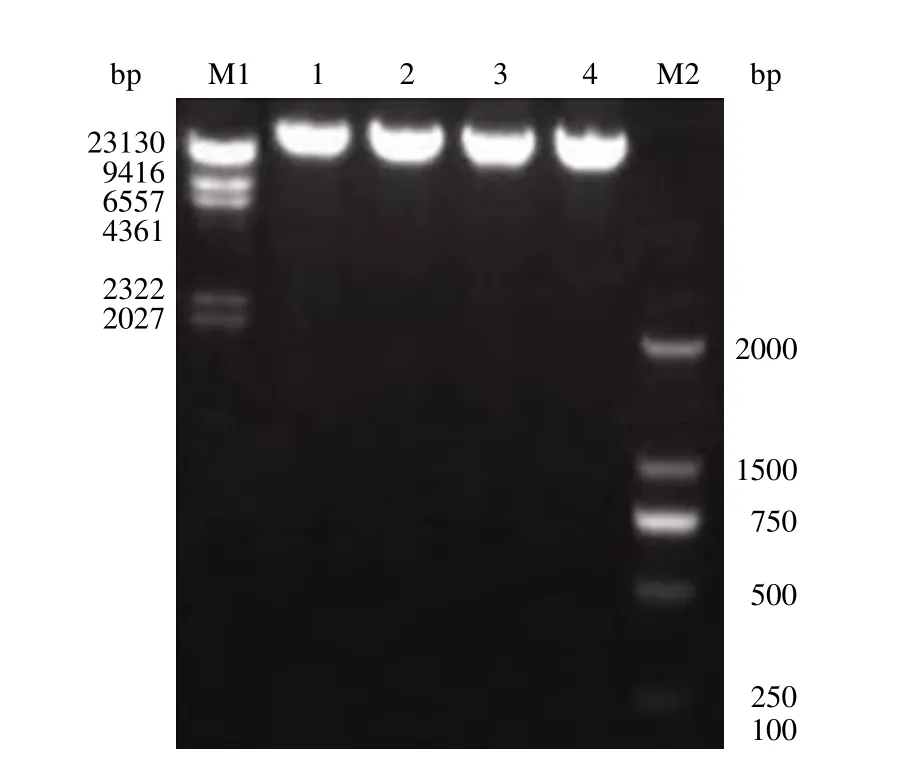
图1 工程菌基因组 DNA 琼脂糖凝胶电泳图谱
2.2 探针标记效率的检测
2.2.1 超声处理制备小片段 DNA 基因组 DNA 经不同次数超声处理后的电泳结果显示:超声次数越多,基因组DNA 片段越小;超声 2 次得到 100 bp~5 kb 的 DNA 片段;超声 4 次得到 100 bp~1 kp 的 DNA 片段(图 2)。
2.2.2 DNA 片段大小对探针标记效率的影响 制备的探针进行有效性检测,通过比较标记探针和对照探针显色程度,从而确定 DNA 片段大小对标记率的影响。超声多次得到的 DNA 片段标记所得探针(图 3A),只能检测到10 pg 呈显色反应;而超声 2 次所得 DNA 片段标记的探针(图 3B),显色程度和对照探针(图 3C)一致。以下试验中,均选择 2 次超声处理的 DNA 片段作为模板进行探针标记。超声次数过多,会使 DNA 片段过小,探针的标记效率反而更低。
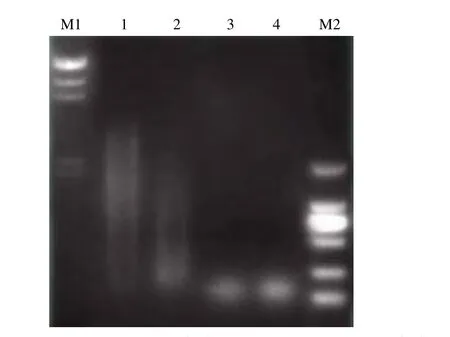
图2 超声处理 DNA 电泳检测图
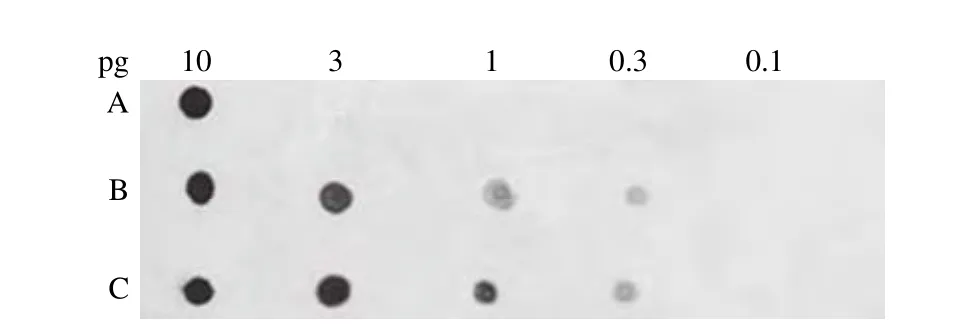
图3 超声次数对 DNA 标记效率的影响

图4 DNA 片段纯度对标记效率的影响
2.2.3 DNA 片段纯度对探针标记效率的影响 检测结果如图 4 所示,未纯化探针(图 4A)的标记效率明显低于纯化探针(图 4B),纯化处理后的探针能够在 0.3 pg 呈显色反应,而未处理的探针只能检测到 3 pg 的反应点。试验结果显示,选择纯化处理的探针能达到更高的标记效率。
2.3 样品不同处理方法检测结果对比
阳性标准品及供试品溶液、阳性样品经不同方法处理后,用标记好的探针进行杂交,检测 DNA 残留量,检测结果如图 5 所示,表明蛋白酶 K 处理后用 DNA 纯化试剂盒回收的样品检测灵敏度明显提高;加样回收的阳性样品显色均与相应的阳性标准显色相当,证明供试品溶液蛋白并无对 DNA 杂交反应造成干扰,即验证了试验结果的准确性。
2.4 TNHH 原液中外源性 DNA 残留量的检测
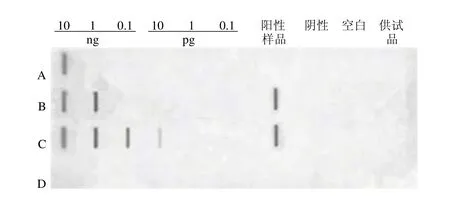
图5 样品不同处理方法对检测结果的影响

图6 3 批次 TNHH 原液宿主 DNA 残留量检测图
检测 3 个批次的 TNHH 原液,首先制备阳性标准DNA 梯度溶液,同时制备同系列梯度的阳性样品,即参照1.2.5.1 阳性样品的制备方法;标准及样品经蛋白酶 K 酶切后,用 DNA 纯化试剂盒进行回收处理,然后进行杂交显色。检测结果如图 6 所示,3 批原液正常用剂量的外源性DNA 残留量均小于 10 ng,且阳性样品组(图 6B)与阳性标准组(图 6A)梯度显色结果基本一致,表明供试品溶液自身不干扰其中 DNA 残留量的测定。故 3 批次供试品均符合 2010年版《中国药典》三部中有关工程菌 DNA 残留量的质控要求。
3 讨论
本研究利用地高辛标记工程菌 DNA 片段作探针,通过分子杂交和免疫显色检测重组 TNHH 原液中残余DNA,并优化了实验方案,实验结果证明此方法快速高效、重现性好。基因工程产品残余 DNA 检测受到很多因素影响,因此制备特异性强、灵敏度高的探针及恰当大小的模板已成为关键步骤。通过实验研究发现,地高辛标记探针法测定 DNA 的残留量有着特异性高、操作简便和重现性好的特点,可以用于注射用 TNHH 生产过程中的质量监控,符合国家制定的相关质量控制标准。
利用超声所得 100 bp~5 kb 基因组 DNA 作为模板进行探针标记,并对标记探针纯化处理,供试品、标准品及阳性样品经蛋白酶 K 在 37 ℃ 下酶切作用 4 h,再用DNA 纯化试剂盒进行回收去除干扰蛋白,对杂交膜进行免疫检测后采用底物显色法显色,从而建立了灵敏度为 10 pg的宿主 DNA 残留检测方法。
探针片段的长短、纯度等影响探针标记率的高低进而对检测结果有着至关重要的影响。地高辛进行探针标记是以随机的方式进行的,因此制备探针用的 DNA 片段不宜太长,也不宜太短,实验结果证明基因组 DNA 片段过小,反而会大大降低标记率。在制备好探针后进一步纯化除去蛋白杂质也是必要的,实验证明纯化后标记效率明显提高。
微量残余 DNA 的检测受蛋白质的干扰较大,由于蛋白质含量远远高于残余 DNA,有可能导致假阳性。排除蛋白质对检测的影响至关重要,采用蛋白酶 K 处理的方法,37 ℃ 作用 4 h 后 DNA 纯化试剂盒回收除去大量蛋白质后,再检测残余 DNA,证明试剂盒回收处理效果是最好的。同时设置阳性样品组作为对照,进一步证明实验结果方法是可行的。
综上所述,本文建立的地高辛标记探针检测 TNHH 原液中宿主 DNA 残留量的方法灵敏度高、特异性强、重现性好、操作相对简单且对人体无害,能够满足检测和质控的要求,同时本研究对实验条件优化进行摸索,为那些国内尚无通过药检、无先例的生物制品的宿主 DNA 残留量测定提供参考。
[1] Rao ML.China cerebrovascular disease prevention and control guidelines (a).J Apoplexy Nervous Diseases, 2005, 22(5):388-393.(in Chinese)饶明俐.《中国脑血管病防治指南》摘要(一).中风与神经病杂志,2005, 22(5):388-393.
[2] Yang H, Wang N, Zhou YD, et al.Comparison of protective effects of gene engineering agents, NIF, NHH or TNHH on focal cerebral ischemia injury in rats subjected to middle cerebral artery occlusion.China Pharm, 2004, 15(6):337-338.(in Chinese)杨辉, 王宁, 周远大, 等.3种基因工程药物对大鼠动脉阻塞性脑损伤治疗作用的比较研究.中国药房, 2004, 15(6):337-338.
[3] Xin ZS, Li KJ, Yang HX, et al.Study on specifications for quality control of recombinant neutrphil inhibitory factor and hirulog hybrid.Chin J New Drugs, 2008, 17(21):1865-1868.(in Chinese)辛中帅, 李克坚, 杨化新, 等.重组白细胞抑制因子和水蛭肽嵌合蛋白质量标准研究.中国新药杂志, 2008, 17(21):1865-1868.
[4] Kuroda S, Itoh Y, Miyazaki T, et al.A supersensitive dot-hybridization method: rapid and quantitative detection of host-derived DNA in recombinant products at the one picogram level.Biochem Biophys Res Commun, 1988, 152(1):9-14.
[5] Briggs J, Panfili PR.Quantitation of DNA and protein impurities in biopharmaceuticals.Anal Chem, 1991, 63(9):850-859.
[6] Lokteff M, Klinguer-Hamour C, Julien E, et al.Residual DNA quantification in clinical batches of BBG2Na, a recombinant subunit vaccine against human respiratory syncytial virus.Biologicals, 2001,29(2):123-132.
[7] Liu J, Zhang ZL.Analysis for residual DNA in recombinant human interferon beta 1b using Digoxin labeled probe.Prog Microbiol Immunol, 2007, 35(2):19-21.(in Chinese)刘俊, 张振龙.地高辛标记探针检测重组人干扰素β1b中DNA残留量.微生物学免疫学进展, 2007, 35(2):19-21.

