改良抗体结合实验检测灭活狂犬病疫苗效价
陈继军,马超,秦海燕,马瑞,毛晓燕
兰州生物制品研究所有限公司,甘肃 兰州 730046
小鼠中和试验法(NIH 法)是测定狂犬病疫苗效价的标准方法,但该方法耗时长(28 d),结果易受动物质量、操作人员技术等多种因素的影响,重复性较差;需要使用大量动物,成本高,也不符合动物人道主义和3R原则[1],因此WHO建议积极寻找适宜的替代方法进行狂犬病疫苗的效价检测。快速免疫荧光灶抑制试验(rapid fluoresce focus inhibition test,RFFIT)能够特异、快速、灵敏地测定狂犬病毒中和性抗体[2],是WHO 推荐的抗狂犬病病毒免疫球蛋白测定方法,也是《中华人民共和国药典》2010 年版收录的测定方法。我们结合抗体结合试验和免疫荧光灶抑制试验,初步建立了改良抗体结合试验(modified antibody binding test,M-ABT)检测狂犬病疫苗效价的方法。该方法通过将待检测疫苗连续稀释,与已定量的人抗狂犬病免疫球蛋白标准品于37℃中和1 h,加入80%感染剂量的狂犬病毒CVS-11,于37℃中和1 h 后接种BSR 细胞,培养24 h,经丙酮固定后,使用荧光标记的抗狂犬病病毒核蛋白单克隆抗体检测细胞感染情况;同时将疫苗标准品按同样方法处理并观察感染情况,通过公式计算待检测疫苗中的抗原含量。该方法快速、灵敏、重复性好,无需试验动物,在48 h 内即可获得结果,在狂犬病疫苗的生产过程中具有较好的应用价值。
1 材料与方法
1.1 材料
12~14 g 雌性昆明系小鼠来自兰州生物制品研究所实验动物室;M-ABT 用狂犬病毒CVS-11毒株、BSR 细胞来自中国疾病预防控制中心病毒病预防控制所;狂犬病疫苗参比品、待检测样品(纯化灭活的aG 株疫苗)、动物实验用CVS 来自兰州生物制品研究所疫苗二室;人抗狂犬病免疫球蛋白标准品来自中国药品生物制品检定所;FITC 标记的抗狂犬病病毒核蛋白单克隆抗体购自北京康思尔泰医学科技发展中心;新生胎牛血清(FBS)购自Sigma 公司;DMEM 及胰蛋白酶购自Gibco 公司;IX-71 倒置荧光显微镜为奥林巴斯公司产品。
1.2 80%细胞感染量CVS-11株测定
取一块96 孔板,加入100μL 含10% FBS 的DMEM 培养液;取100μL CVS-11 病毒液加入第一孔,混匀;吸出100μL 加入下一孔,混匀;重复上述步骤,连续12 孔;每孔取出50μL 稀释好的病毒,加入另一96 孔板中,再加入50μL 1.0×106/mL BSR细胞,37℃、5% CO2培养24 h;弃去培养板中的液体,每孔加入200μL PBS 洗1 次,甩干后加入200μL 80%冷丙酮,-20℃固定15 min,弃丙酮,室温干燥15 min;用PBS 将FITC 标记的抗狂犬病毒核蛋白抗体1∶200稀释,按1∶1000加入1%伊文思蓝,混匀,每孔加入50μL 稀释好的抗体,37℃孵育1 h;弃去液体后每孔加入200μL PBS,洗3 次;加入25μL 50%甘油,在倒置荧光显微镜下观察,80%细胞被感染孔对应的CVS-11浓度即为80%病毒感染剂量。
1.3 改良抗体结合实验(M-ABT)
1.3.1 抗原中和 取一块96 孔板,加入100μL 含10% FBS 的DMEM 培养液;取100μL 待检样品加入第一孔,混匀;吸出100μL 加入下一孔,混匀;重复上述步骤,连续稀释8 孔,最后一孔吸出100μL弃去;狂犬病疫苗参比品做同样处理;每孔加入100μL 0.1 U/mL 的人抗狂犬病毒免疫球蛋白国家标准品;取100μL DMEM 加入100μL FBS作为抗体阴性对照;37℃中和1 h。
1.3.2 病毒感染 每孔取100μL混合液,加入另一块96 孔板中,加入80%细胞感染量的CVS-11 病毒株50μL;另取含10% FBS 的DMEM 培养液100μL,加入80%感染CVS-11 毒株50μL,作为病毒对照;37℃孵育1 h,加入1.0×106/mL 的BSR 细胞50μL,37℃、5% CO2培养24 h。
1.3.3 荧光灶检测及疫苗效价计算 弃去培养板中的液体,每孔加入200μL PBS 洗1 次,甩干后加入200μL 80%冷丙酮于-20℃固定,15 min 后弃丙酮,室温干燥15 min;用PBS 将FITC 标记的抗狂犬病毒核蛋白抗体按1∶200稀释,按1∶1000加入1%伊文思蓝,混匀,每孔加入50μL 稀释好的抗体,37℃孵育1 h;弃去液体后每孔加入200μL PBS,洗3次;加入25μL 50%甘油,在倒置荧光显微镜下观察。抗体阴性对照及病毒对照应一致,并感染约80%细胞。记录各样品50%感染分界点前后孔内细胞感染比例,50%细胞孔中出现荧光灶的最高稀释度为待测疫苗和疫苗参比品的50%阳性终点。依据Reed&Muench 法,疫苗效价(U/mL)=(待测疫苗50%阳性终点对应稀释度/疫苗参品50%阳性终点对应稀释度)×(待测疫苗剂量/疫苗参比品剂量)。
1.4 小鼠中和试验(NIH法)
待检测样品及参比品按1∶25、1∶125及1∶625稀释,腹腔注射昆明鼠,每稀释度6 只,1 周后再次免疫,14 d 后用约20LD50的CVS 进行脑内攻击,每只0.03 mL,攻击后每日观察,统计第5~14 d 死亡的小鼠,根据参比品计算待测样品效价。
1.5 统计方法
应用Spss18.0 统计学软件,采用线性相关分析及配对t检验方法。
2 结果
对8 批疫苗生产中连续生产的中间品进行MABT 及NIH 测定效价,结果见表1;2 种方法测定结果呈正相关(R2=0.8749),见图1;配对t检验表明二者无显著统计学差异(P=0.997)。
3 讨论
疫苗效价反映了注射疫苗后产生的抗体水平,是狂犬病疫苗生产中一项关键技术指标。NIH 法是狂犬病疫苗效价检测的标准方法,但该方法周期长,结果受多种因素影响,重复性较差。通过将抗体结合试验与RFFIT 结合,我们建立了一种检测aG 株狂犬病疫苗的方法。试验结果表明,M-ABT 与NIH 法效价检测结果呈正相关,二者没有显著统计学差异,这与其他文献报道结果一致[3-5]。M-ABT 是一种体外测定狂犬病疫苗效价的试验方法,与NIH 法相比,具有如下优点:①耗时短,2 d 内即可得到结果,而NIH 法需要28 d;②无需实验动物,成本低,也符合WHO 提倡的动物试验3R 原则;③重复性好,结果在不同实验室之间具有一致性[6];④操作简单,通量高,可以大大减少工作量。
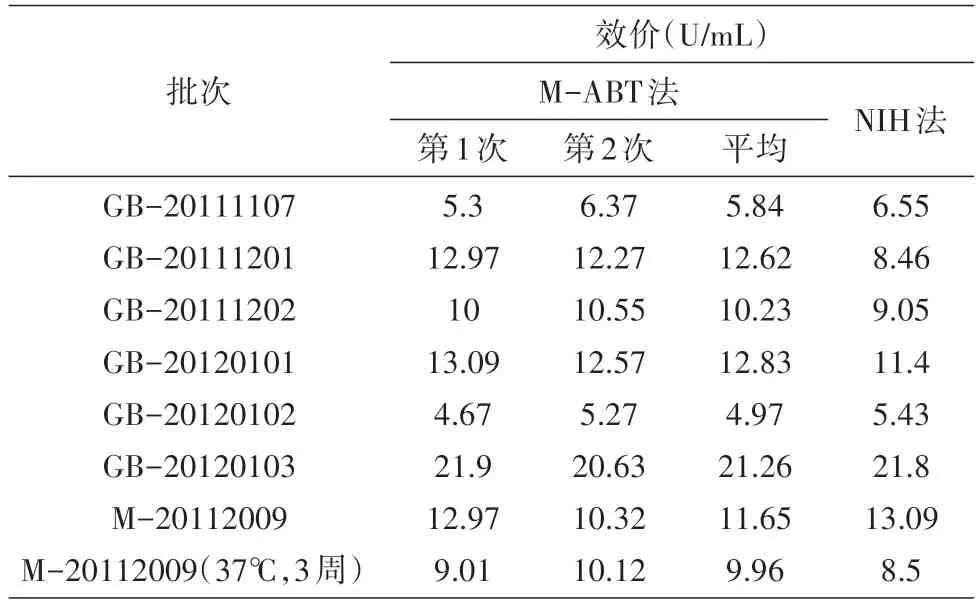
表1 M-ABT法和NIH法测定狂犬病毒疫苗效价

图1 NIH效价与改良抗体结合试验效价相关关系
除抗体结合试验外,试验室替代NIH 法测定狂犬疫苗效价的方法还有竞争ELISA 法[7-8]、火箭电泳法[9]、单向辐射免疫扩散试验、抗体结合试验等,但目前NIH 法仍是检测狂犬病疫苗效价的金标准。在疫苗生产过程中应用M-ABT 有利于加强狂犬病疫苗质量控制,缩短生产周期,节约成本,提高生产效率。
[1]Lewis C E,Fry A M,Hermann J R,et al.Potency testing ofveterinary rabies vaccines:replacement of challenge by in vitro testing:considerations for development of alternative assays[J].Dev Biol(Basel),2012,134:29-33.
[2]于鹏程,申辛欣,吕新军,等.狂犬病抗血清WHO 标准品和国家标准品用于RFFIT 方法的比较[J].中华实验和临床病毒学杂志,2010,24(2):91-93.
[3]李云云,徐文超,李勇,等.改良抗体结合试验的建立和在灭活狂犬病疫苗效价检测中的应用[J].国际检验医学杂志,2011(9):923-924.
[4]吕新军,唐青,Hervé B,等.狂犬病病毒中和抗体检测快速荧光灶抑制试验的建立[J].中国卫生检验杂志,2010,20(2):439-440.
[5]Kramer B,Schildger H,Behrensdorf-Nicol H A,et al.The rapid fluorescent focus inhibition test is a suitable method for batch potency testing of inactivated rabies vaccines[J].Biologicals,2009,37(2):119-126.
[6]Yu P C,Noguchi A,Inoue S,et al.Comparison of RFFIT tests with different standard sera and testing procedures[J].Virol Sin,2012,27(3):187-193.
[7]崔文广,杨屹,常军亮,等.狂犬病病毒抗原定量双抗体夹心ELISA 检测方法的建立及应用[J].中国生物制品学杂志,2012,12(25):1684-1687.
[8]Rooijakkers E J,Uittenbogaard J P,Groen J,et al.Rabies vaccine potency control:comparison of ELISA systems for antigenicity testing[J].J Virol Methods,1996,58(1-2):111-119.
[9]李红芳,陈继军,李晓莉,等.火箭电泳法进行人用狂犬病疫苗抗原的检测[J].微生物学免疫学进展,2007,35(3):39-41.

