成骨细胞特异性转录因子Cbfa1重组腺病毒质粒的构建与鉴定
李章华 ,赵强,唐欢,许海甲,廖文,潘峰,刘农乐
1.武汉大学人民医院骨一科,湖北 武汉 430060;2.军事医学科学院 基础医学研究所,北京 100850;3.湖北中医药大学,湖北 武汉 430065
无论是骨坏死、大面积骨缺损还是长节段粉碎性骨折患者,都必将面临着成骨细胞不足、骨生成因子缺乏的困境,如何增强这些患者的成骨能力已是困扰骨科医生多年的临床难题。外源性增加骨病区域的成骨细胞和骨生成因子,无疑能为治愈这些疾病奠定坚实的基础。间充质干细胞(mesenchymal stem cells,MSC)是骨髓干细胞中具有成骨分化潜能的主要细胞群,目前已广泛应用于多种疾病的治疗中,而在骨科疾患如骨折、骨坏死和骨质疏松症等的应用中也体现了良好的临床应用前景。1998 年Komori等[1]证实,在MSC向成骨细胞系的分化过程中存在一种特异性的转录因子来决定这一分化过程,这种转录因子就是核心结合因子α1(core binding factor alpha 1,Cbfa1),并证实Cbfa1 基因是骨形成的关键基因,它对维持骨的生长发育起着至关重要的作用。Cbfa1是Cbfa家族成员,又被称为多瘤病毒增强结合蛋白2αA 或急性骨髓性白血病因子3,最近又被命名为Runx2。目前已知Cbfa1 mRNA 全长约14 kb,由9个外显子组成。Cbfa1有3个异形体,第3个异形体Cbfa1/Osf2 的N 端由MLHSPH 构成,仅在骨组织和成骨细胞中有表达,在其他组织中未见表达[2]。Cbfa1/Osf2 是人类第一个、也是迄今发现的惟一的成骨特异性转录因子,具有极大的研究价值和应用前景。我们拟构建含Cbfa1 基因的重组腺病毒载体,为后期应用Cbfa1治疗股骨头坏死、骨折、骨缺损和骨质疏松症等疾患奠定基础。
1 材料与方法
1.1 材料
HEK293 细胞、MSC、大肠杆菌BJ5183 来自军事医学科学院基础医学研究所生物化学与分子生物学研究室;Adeasy 系统购自Stratagene 公司;PCR 酶、限制性内切酶、修饰酶和工具酶购自Promega公司;Real-time 检测试剂盒购自TaKaRa 公司;Cbfa1 兔抗鼠单克隆抗体购自Santa Cruz 公司;TRIzol 试剂购自Invitrogen公司;Cbfa1全长引物由北京奥科生物技术有限公司合成,扩增片段长度为1015~2559 bp,引物为P1(5'-CGGGAATGATGAGAACTAC-3')和P2(5'-ACCGTCCACTGTCACTTTA-3')。
1.2 PCR扩增Cbfa1片段、克隆
由北京奥科生物技术有限公司合成1015~2559 bp 的目的基因Cbfa1,并将其克隆到Teasy 载体上。PCR 扩增目的基因Cbfa1(携带BglⅡ和XhoⅠ酶切位点),并将其克隆到pShuttle-CMV 载体的相应酶切位点,获得载体pShuttle-CMV-Cbfa1,先通过酶切鉴定是否正确,再行测序鉴定目的基因序列。
1.3 采用Adeasy系统制备获得重组腺病毒质粒
按照Adeasy系统说明书进行操作。将pShuttle-CMV-Cbfa1用PmeⅠ酶切,使其线性化,然后进行去磷酸化处理;接着,将其进行酚氯仿抽提纯化;取1μg 线性化质粒电转100μL BJ5183-Adeasy 感受态细胞;最后,在卡那霉素抗性LB 平板上筛选获得阳性克隆,通过PacⅠ酶切鉴定结果是否正确。
1.4 AdEasy1/Cbfa1的形成、病毒滴度测定及纯化
按照Adeasy 系统说明书进行操作。将Ad5-pSh-CMV-Cbfa1 经PacⅠ酶切后用酚氯仿抽提,并测定其纯度和浓度(纯度:D260nm/D280nm=1.8652;浓度=425 ng/μL);分别取0.8、1.2μg,用脂质体介导的方式转染HEK293 细胞,观察细胞病变情况,可见7 d产生噬斑,10 d 出现完全病变,病变完全形成后收集上清液感染293T 细胞以扩增病毒,离心后留上清即为病毒液。再将病毒液按不同比例(1∶103~1∶1011)稀释,取稀释液100μL 加至293T 细胞培养板(96 孔)中,24 h 后于荧光显微镜下计数GFP 阳性细胞数,计算病毒滴度[病毒滴度(pfu/mL)=GFP 阳性细胞数×病毒上清稀释率/0.1 mL],2 次CsCl 梯度离心,收集病毒层,过滤后小份分装,-70℃保存。
1.5 AdEasy1/Cbfa1感染MSC后Cbfa1 mRNA的表达
参照Halvorsen 等[3]的方法,在NCBI 数据库找到Cbfa1 基因序列,用Premier 5 进行引物设计,所有引物由生工生物工程(上海)有限公司合成。Cbfa1 上游引物为5'-CCCAGCCACCTTTACCTACA-3',下游引物为5'-TATGGAGTGCTGCTGGTCTG-3';β-actin上游引物为5'-TCACCCACACTGTGCCCCATCTAC GA-3',下游引物为5'-CAGCGGAACCGCTCATTGC CAATGG-3'。在37℃、5% CO2、95%空气、100%湿度条件下培养72 h后检测Cbfa1 mRNA的表达。
将MSC 按2×105/孔接种6 孔板,第2 d 用150 MOI(感染复数)的Ad-Cbfa1 感染MSC,并以不感染的MSC 作为对照,感染后48 h 收集细胞,提取RNA,-80℃保存备用;取2.0μg RNA,用Promega公司的cDNA 第一链合成试剂盒合成cDNA,产物于-20℃保存;行Real-time PCR 检测,30μL 反应体系包括2×PCR 反应液15μL,上、下游引物各1μL,cDNA 模板1μL,无菌水12μL,反应条件为50℃2 min、95℃2 min、95℃3 s、60℃30 s,共41 个循环;测出各组目的基因mRNA 的相对定量,并计算其和β-actin mRNA的比值。
1.6 AdEasy1/Cbfa1感染MSC后Western印迹检测
将MSC消化离心后转移到EP管中,加入裂解液(每孔200μL 细胞裂解液,每100μL 裂解液加1μL 蛋白酶抑制剂),冰上裂解30 min,吸取上清,4℃、12 000 r/min 离心15 min,上清即为含有总蛋白的提取液,可在-70℃冰箱中保存,取5μL测定蛋白浓度,以每泳 道10μL(3μg/μL)进行SDSPAGE,电泳完毕后转移至醋酸纤维素薄膜,室温下用脱脂奶粉封闭3 h 后加入Cbfa1 兔抗鼠单克隆抗体(1∶200),4℃过夜,TBST 洗膜3 次,室温下用二抗(1∶200)孵育2 h,TBST 洗膜3 次,ALP 显色,SDS-8000 成像系统拍照。每组5 个样本,β-actin 为内参,采用ScnImage图像分析软件测定灰度值。
2 结果
2.1 目的基因载体pShuttle-CMV-Cbda1和重组质粒Ad5-pSh-CMV-Cbfa1的酶切鉴定
测序表明PCR 扩增获得预想大小的Cbfa1 片段,目的基因载体pShuttle-CMV-Cbda1 经BglⅡ和XhoⅠ双酶切鉴定正确(图1)。重组质粒Ad5-pSh-CMV-Cbfa1经PacⅠ酶切鉴定亦正确(图2)。
2.2 AdEasy1/Cbfa1感染MSC的效率
AdEasy 系统携带有GFP,根据GFP 计数法得出腺病毒的滴度为1×1010U/mL。当AdEasy1/Cbfa1 感染MSC 后,在荧光显微镜下可见细胞发出绿色荧光;当MOI 为80 时,80%的细胞出现荧光,表明所构建的腺病毒能够有效地转导目的基因(图3)。
2.3 Real-time PCR 检测Cbfa1 mRNA的表达
一般情况下,MSC 中Cbfa1 mRNA 的表达量很低,但AdEasy1/Cbfa1 转染后MSC 中Cbfa1 mRNA 的表达水平提高了近千倍,说明导入的外源性Cbfa1能极大地增强MSC表达Cbfa1 mRNA的能力(图4)。
2.4 Western印迹检测Cbfa1蛋白的表达

图1 pShuttle-CMV-Cbfa1的酶切鉴定电泳图

图2 PacⅠ酶切鉴定重组质粒Ad5-pSh-CMV-Cbfa1

图3 重组腺病毒AdEasy1/Cbfa1转染MSC后GFP的表达
一般情况下,MSC 中Cbfa1 蛋白的表达水平很低,而感染AdEasy1/Cbfa1后,MSC中Cbfa1蛋白的表达提高明显,说明导入的外源性Cbfa1既能极大地提高MSC 表达Cbfa1 mRNA 的能力,同时也能极大地提高其Cbfa1蛋白表达能力(图5)。
3 讨论
严重骨坏死、大面积骨缺损及长节段粉碎性骨折患者,其损伤组织周围的微环境因血供锐减常发生严重低氧,损伤中心区域的氧浓度甚至会降至0~2%,在这种环境中,对缺氧敏感的骨细胞、破骨细胞和成骨细胞在12~48 h 即会死亡[4-6]。同时,低氧使损伤区域里代谢产物大量累积,这些代谢产物具有毒性作用,会进一步增加细胞凋亡和死亡的数目。另外,低氧还可对骨组织细胞活力产生直接影响,抑制成骨细胞生长、分化及其骨形成能力[6]。此外,这些损伤还可造成患者的MSC 活性降低和数量减少,如Suh 发现骨坏死病人股骨近端MSC 增殖能力、成骨能力明显下降,而成脂能力却增加[7];Wang发现骨坏死患者的干细胞活性明显降低,且干细胞库的细胞集落数明显减少[8]。综上所述,骨缺血性坏死后患者全身骨髓MSC 活性和成骨能力降低[9],以及病变区局部MSC和骨细胞的数量减少、活性降低[10-11],使骨坏死后无法有效地完成骨重建或修复。
间充质干细胞是中胚层来源的一类多能干细胞,因其具有多向分化潜能和自我复制的特点而日益受到关注,目前已作为理想的干细胞用于多种疾患的治疗。如近年来MSC 已被较多地用于股骨头坏死治疗,并取得了较大进展。Yan[11]和Gangji[12]等在髓芯减压的基础上植入自体MSC,证实MSC 能提供股骨头修复重建所需的种子细胞,为新骨生成创造良好的环境。Müller 等[13]对白血病患儿的股骨头坏死进行髓芯减压、自体MSC 移植,随访16个月,所有患儿的骨坏死区均可见矿化骨形成。既往我们也应用MSC 治疗实验性兔股骨头坏死,通过X 线、CT、组织学、Real-time PCR、Western 印迹等多种检测,证实外源性MSC 植入动物体内能增加新骨形成所需的成骨细胞,为骨坏死修复奠定基础[14]。
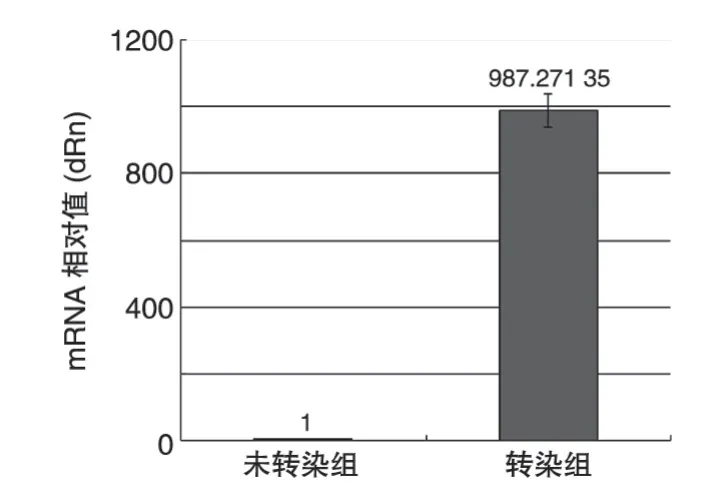
图4 Real-time PCR 检测AdEasy1/Cbfa1转染MSC后Cbfa1 mRNA的表达
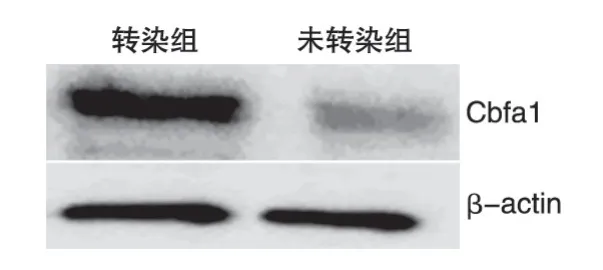
图5 Western印迹检测AdEasy1/Cbfa1转染MSC后Cbfa1的表达
然而,骨生成是一个复杂的动态过程,除了相关细胞外,还需要众多细胞因子或生长因子,如骨形态发生蛋白(BMP)、转化生长因子β(TGF-β)、胰岛素样生长因子(IGF)、成纤维细胞生长因子(FGF)、血小板衍化生长因子(PDGF)、Cbfa1等参与,甚至有些学者认为在MSC 修复损伤的组织和器官中,更多的是依靠其自分泌和旁分泌的各种生长因子,而不是其自身的定向分化。我们曾在兔骨缺损和股骨头坏死模型中都发现病变局部BMP-2、血管内皮生长因子(VEGF)、Cbfa1、骨桥蛋白(OPN)等生长因子的表达发生变化,而且在不同病变期其表达存在较大差异。尤其是Cbfa1 在骨折和股骨头坏死修复过程中会自发持续高水平表达,表明其在这些疾患的修复中起重要作用[15-16]。Cbfa1/Osf2 参与成骨细胞分化,通过调节成骨细胞分化标志基因和成骨表型相关基因的表达而促进MSC 向成骨分化和生成新骨。已发现在骨钙素、骨唾液蛋白、Ⅰ型胶原纤维等多种成骨特异性表达基因的启动子存在与Cbfa1 特异结合的成骨细胞特异性顺式反应元件。骨生成诱导因子与Cbfa1 存在相互增强的作用,骨诱导因子可通过Cbfa1 促进成骨,Cbfa1 也可上调骨诱导因子或其受体的表达。说明在骨生成的复杂过程中,Cbfa1是多种骨生成诱导因子促进成骨的共同信号分子。
虽然Cbfa1 在骨缺损和股骨头坏死修复过程中会持续出现高水平表达,但我们在实验中发现,要修复这些疾患不仅需要持续高水平的Cbfa1表达,还需要达到一定的数值才能有效促进骨缺损和骨坏死修复[15]。尤其是在一般情况下MSC 分泌产生的Cbfa1量非常少,这样要在骨缺损和骨坏死局部维持高浓度的Cbfa1,单纯依靠外源性MSC 产生显然不够。为了增强MSC 分泌Cbfa1 的能力,人为地将外源性Cbfa1 基因通过载体导入MSC 无疑是一种可行的良好选择。为了证实外源性Cbfa1 基因导入确实能提高MSC 分泌Cbfa1 的能力,我们在确认AdEasy1/Cbfa1 构建成功后直接将它感染MSC,通过检测其mRNA和蛋白水平,证实MSC分泌Cbfa1的能力提高了近千倍,为下一步应用AdEasy1/Cbfa1治疗骨缺损和股骨头坏死修复奠定了良好的基础。
[1]Komori T,Kishimotto T.Cbfa1 in bone development[J].CurrOpin Genet Dev,1998,8(4):494-499.
[2]Ducy P,Zhang R,Geoffroy V,et al.Osf2/Cbfa1:a transcriptional activator of osteoblast differentiation[J].Cell,1997,89(5):747-754.
[3]Halvorsen Y D,Franklin D,Bond A L,et al.Extracellular matrix mineralization and osteoblast gene expression by human adipose tissue-derived stromal cells[J].Tissue Eng,2001,7(6):729-741.
[4]D'Ippolito G,Diabira S,Howard G A,et al.Low oxygen tension inhibits osteogenic differentiation and enhances stemness of human MIAM I cells[J].Bone,2006,39(3):513-522.
[5]He J,Genetos D C,Yellowley C E,et al.Oxygen tension differentially influences osteogenic differentiation of human adipose stem cells in 2D and 3D cultures[J].J Cell Biochem,2010,110(1):87-96.
[6]Potier E,Ferreira E,Andriamanalijaona R,et al.Hypoxia affects mesenchymal stromal cell osteogenic differentiation and angiogenic factor expression[J].Bone,2007,40(4):1078-1087.
[7]Suh K T,Kim S W,Roh H L,et al.Decreased osteogenic differentiation of mesenchymal stem cells in alcohol-induced osteonecrosis[J].Clin Orthop Relat Res,2005,(431):220-225.
[8]Wang B L,Sun W,Shi Z C,et al.Decreased proliferation of mesenchymal stem cells in corticosteroid-induced osteonecrosis of femoral head[J].Orthopedics,2008,31(5):444.
[9]Gangji V,Hauzeur J P,Matos C,et al.Treatment of osteonecrosis of the femoral head with implantation of autologous bone-marrow cells:a pilot study[J].J Bone Joint Surg Am,2004,86A(6):1153-1160.
[10]Zhu W,Chen J,Cong X,et al.Hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells[J].Stem Cells,2006,24(2):416-425.
[11]Yan Z Q,Chen Y S,Li W J,et al.Treatment of osteonecrosis of the femoral head by percutaneous decompression and autologous bone marrow mononuclear cell infusion[J].Chin J Traumatol,2006,9(1):3-7.
[12]Gangji V,Hauzeur J P.Treatment of osteonecrosis of the femoral head with implantation of autologous bone-marrow cells.Surgical technique[J].J Bone Joint Surg Am,2005,87 Suppl 1(Pt 1):106-112.
[13]Müller I,Vaegler M,Holzwarth C,et al.Secretion of angiogenic proteins by human multipotent mesenchymal stromal cells and their clinical potential in the treatment of avascular osteonecrosis[J].Leukemia,2008,22(11):2054-2061.
[14]Li Z H,Liao W,Cui X L,et al.Effects of Cbfa1 on osteoanagenesis during avascular necrosis of femoral head[J].Sci Res Essays,2010,5(18):2721-2730.
[15]Li Z H,Liao W,Zhao Q,et al.Angiogenesis and bone regeneration by allogeneic mesenchymal stem cell intravenous transplantation in rabbit model of avascular necrotic femoral head[J].J Surg Res,2013,183(1):193-203.
[16]Kawahata H,Kikkawa T,Higashibata Y,et al.Enhanced expression of Runx2/PEBP2alphaA/CBFA1/AML3 during fracture healing[J].J Orthop Sci,2003,8(1):102-108.

