人脐带间充质干细胞对炎症性肠病小鼠模型的治疗作用
葛翠翠 ,王慧娜,杜丽欣,陈冬波,宋亚昆,2,吴东颖,2,刘兵,邱泽武,吕双红
1.军事医学科学院 附属医院 a.中毒救治科;b.307-青藤转化医学中心;北京 100071;2.北京青藤谷禧干细胞科技研究院有限公司,北京 100071
炎症性肠病(inflammatory bowel disease,IBD)是一组特发性、慢性、炎症性肠道疾病状态,可以造成肠道结构和功能不可逆的损伤。目前IBD 的治疗主要采用糖皮质激素、水杨酸类、免疫抑制剂等药物,但这些药物很难维持疾病长时间的缓解,复发率很高,且副作用较大,价格昂贵。因此,寻找新的治疗方法以延长缓解期时间,降低致残率,提高患者生活质量,已是亟待解决的难题。
间充质干细胞(mesenchymal stem cells,MSC)最早从骨髓中分离,存在于脂肪、脐血、脐带、胎盘、羊膜等多种组织中。MSC具有多向分化、抗炎、免疫调节等潜能,为治疗许多复杂的疾病带来希望。与骨髓来源的MSC 相比,人脐带MSC(umbilical cordderived MSC,UCMSC)来源广泛,易于取材,对供者不造成创伤,无伦理道德限制,并且具有细胞免疫原性低,增殖、分化能力强等优势,因此受到研究人员的广泛青睐。目前已有应用UCMSC 治疗肝硬化、系统性红斑狼疮、多发性硬化等疾病的临床研究报道,并取得了较好的疗效,但在IBD 研究方面尚处于起步阶段。此外,以往的研究中多采用尾静脉注射移植MSC,腹腔注射移植较少。但对于治疗结肠炎而言,腹腔注射更接近损伤部位,且更加简便易行和安全。因此,我们拟探讨2 种途径移植人UCMSC 对TNBS诱导的IBD小鼠模型的治疗作用。
1 材料与方法
1.1 动物
SPF 级雄性BALB/c 小鼠,体重18~22 g,由军事医学科学院实验动物中心提供,灌肠前在该中心适应性饲养5~7 d。
1.2 UCMSC的分离培养鉴定
取健康胎儿脐带样品冲洗干净,剪成2~3 mm3的小块,加入1%胶原酶消化液于37℃消化2 h,用70 μm 筛网过滤,收集上清,离心收集细胞,用PBS清洗后,加入5 mL 培养液重悬细胞,于37℃、5%CO2普通培养箱中培养至80%~90%汇合时,按1∶2~1∶3 的比例传代。动物体内移植采用6~8 代细胞。用流式细胞仪检测UCMSC表面标志的表达情况。
1.3 TNBS诱导小鼠IBD模型制备
2,4,6-三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)购自Sigma 公司,为5%水溶液。按照4∶1 的比例配制丙酮-橄榄油混合溶剂,然后将该溶剂与TNBS以4∶1混合制备皮肤致敏液。将TNBS 与无水乙醇以1∶1混合制备TNBS灌肠溶液。
模型制备参考Wirtz等[1]的方法。小鼠背部剪去1.5 cm 见方的毛发,露出皮肤,每只小鼠涂150 μL皮肤致敏液后正常饲养,7 d 后用150 mg/kg TNBS灌肠。抚摸小鼠背部刺激远端大便排空;腹腔注射戊巴比妥钠(30 mg/kg)麻醉后,倒悬位,将直径0.2 mm聚乙烯管插入结肠4 cm处,缓慢灌入灌肠溶液,放回笼中正常饲养。观察小鼠大便性状、精神状态等,每天记录小鼠体重变化。7 d 后处死,取结肠进行大体评分,并取受损部位石蜡包埋切片,HE 染色后进行病理评分。
小鼠结肠组织大体评分按照Morris[2]的评分标准进行(0 分:大致正常;1 分:无溃疡,局部充血;2分:可见溃疡,但无充血;3 分:仅1 处溃疡和炎症;4分:2 处或更多处的溃疡和炎症;5 分:溃疡长于2 cm;6~10 分:大于2 cm 的溃疡,每增加1 cm 多计1分)。组织学评分参照Appleyard[3]评分标准进行[水肿:0 或1(有或没有);溃疡:0 或1(有或没有);细胞浸润:0,1,2 或3(无,轻度,重度);肌层增厚:0,1,2或3(无,轻度,重度);血管新生:0 或1(有或没有);黏膜结构破坏:0 或1(有或没有);黏膜结构丧失:0,1,2或3(无,轻度,重度);合计总分]。
1.4 UCMSC输注治疗IBD
小鼠TNBS 灌肠造模后分为3组:对照组(n=8),灌肠后24 h 尾静脉输注PBS;尾静脉治疗组(n=11),灌肠后24 h 尾静脉输注2×105/只;腹腔移植治疗组(n=10),灌肠后24 h腹腔输注2×105/只。
1.5 统计学处理
用SPSS17.0统计软件对实验数据进行分析。计量资料均以表示,组间比较用t检验。
2 结果
2.1 人UCMSC的培养和鉴定
UCMSC 经传代培养后,显微镜下呈梭形,放射状排列生长或旋涡状生长。流式细胞仪检测结果显示(图1)具有MSC 特征性表面标志的表达。三系分化结果表明,可向骨、软骨和脂肪方向分化。
2.2 腹腔和尾静脉输注UCMSC 对小鼠生存率和体重的影响
如图2 所示,腹腔和尾静脉输注UCMSC 均可提高动物生存率,腹腔输注方式在改善小鼠生存率方面要优于尾静脉移植治疗组。
如图3所示,UCMSC移植后,尾静脉移植治疗组体重缓慢回升;腹腔移植治疗组体重在移植后第2 d 降到最低,然后缓慢回升,实验终点体重恢复和尾静脉移植治疗组基本持平;对照组小鼠体重在第2 d体重降到最低,然后维持一个平稳的水平。
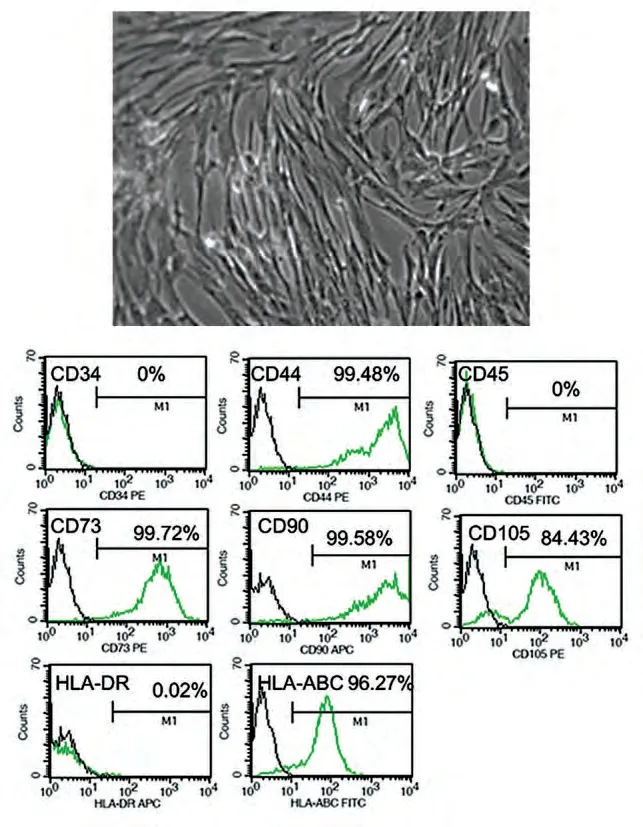
图1 人UCMSC的相差显微镜观察(上)及流式细胞鉴定(下)
2.3 大体及病理组织学观察和评分
移植后第5 d,取出小鼠全结肠,在解剖显微镜下观察评分。对照组小鼠结肠全部可见溃疡伴充血、水肿;尾静脉移植治疗组小鼠恢复较好,仅有个别动物有溃疡,且病变较小;腹腔移植治疗组动物结肠溃疡减轻,而且病变范围减小。大体评分结果显示(表1),UCMSC 尾静脉或腹腔移植后均可对溃疡起到修复效果。
结肠石蜡包埋后切片,HE染色,光镜下观察(图4),发现对照组小鼠结肠组织肠壁增厚,黏膜层广泛坏死,大量淋巴细胞浸润全层;尾静脉移植治疗组和腹腔移植治疗组动物有些仅见到肠壁略有增厚,但黏膜完整;有些仅在黏膜层见到轻微缺损,淋巴细胞浸润较对照组减少。少数小鼠仍可见溃疡,大量淋巴细胞浸润并伴有新生血管生成。与对照组相比,2种移植方式的结肠病理评分均显著下降。
3 讨论
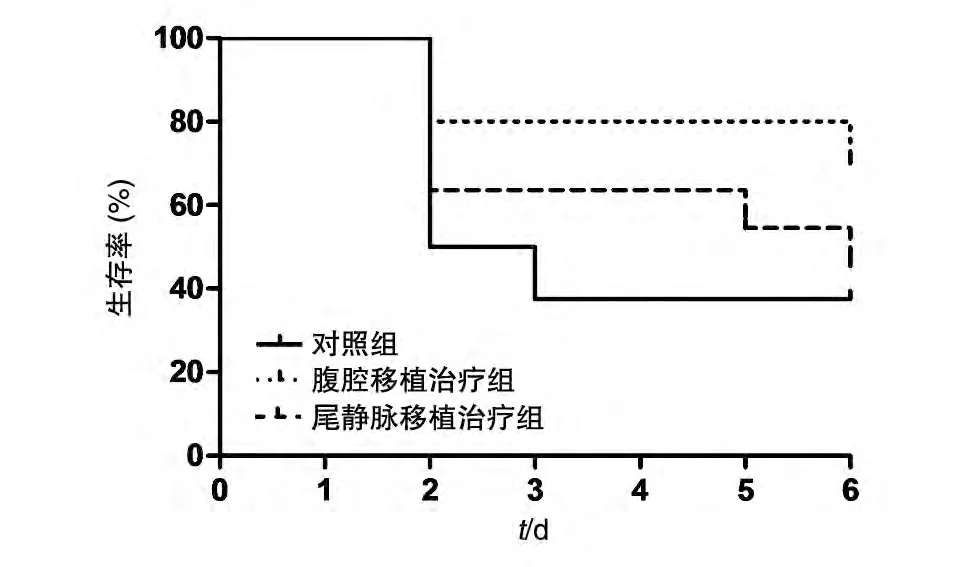
图2 小鼠生存曲线图
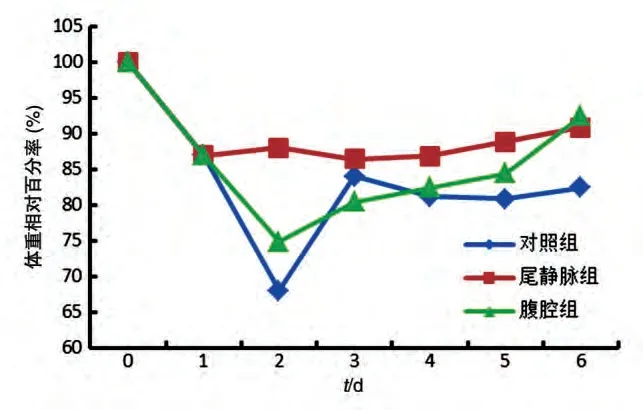
图3 对照组和治疗组小鼠体重变化

表1 各组小鼠大体评分和病理评分结果
MSC 已用于多种疾病的治疗研究。Tanaka 等[4]将骨髓来源的MSC 经尾静脉植入DSS诱导的IBD 动物模型,证实MSC 可改善肠道损伤和炎症反应,其修复作用主要通过结肠局部抗炎作用完成。González 等[5]研究发现,人脂肪MSC 可提高IBD 小鼠生存率,并且可阻止疾病复发。Zhang 等[6]采用牙龈来源的MSC 通过静脉给药,也观察到GMSC 通过上调抗炎因子、下调致炎因子及氧自由基来修复IBD。这些研究采用不同来源的MSC治疗IBD,都取得了疗效,但这些MSC 仍存在来源有限、增殖能力有限或取材有创伤等缺陷。而UCMSC 因其来源充足,无创,MSC增殖、分化能力强,分泌多种活性因子等优点,近年来广受青睐。但采用UCMSC 治疗IBD的研究报道目前较少。梁璐等[7]应用人UCMSC 对TNBS 诱导的IBD 进行治疗并探讨其机制,发现其可以快速归巢到有炎症的肠道组织,并且可以明显改善结肠炎的临床表现和组织病理改变。
然而,MSC 移植后能否发挥治疗作用受诸多因素的影响,如移植途径、移植数量、移植时机、移植频次等。在移植途径方面,现有基础研究和临床研究多采用静脉输注方式,并取得较好的疗效。但有关MSC 治疗IBD 哪种移植途径最佳问题尚有争论。Castelo-Branco 等[8]报道,颈静脉输注MSC 未归巢到受损肠组织,对TNBS诱导的结肠炎模型没有发挥治疗效果;而经腹腔注射MSC 可归巢到结肠病灶并发挥疗效,其主要分布于黏膜下层、肌层、固有层。Hayashi 等[9]证实,外源性BMSC 经尾静脉注射后不能改善大鼠一般状况且不能修复受损肠组织,局部注射至受损组织边缘效果较好。Ando 等[10]报道,黏膜下注射AT-MSC 到TNBS 诱导的大鼠结肠炎模型内,FISH 检测到Y 染色体标记的AT-MSC 主要分布在肌层和脂肪组织里。本研究探讨了尾静脉和腹腔注射2 条移植途径所产生疗效的差异。研究结果显示,尾静脉和腹腔注射移植UCMSC 均可对溃疡性结肠炎动物模型起到治疗作用,降低大体和病理评分,但2 条途径的疗效无显著差异。从数据上看,在改善生存率方面腹腔输注UCMSC 优于尾静脉移植,而溃疡修复效果上尾静脉移植优于腹腔移植。这可能意味着2种注射方式发挥治疗作用的机理有差异。
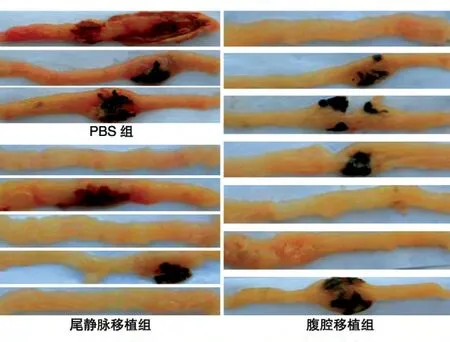
图4 结肠大体观察图片
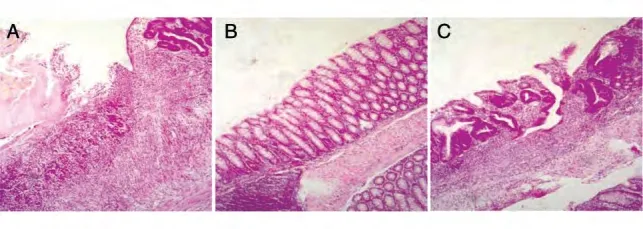
图5 HE染色图片
此外,在移植细胞数量方面,文献报道每只动物一般移植1×106细胞,相当于5×107/kg,虽然取得了一定的疗效,但与临床常用数量1×106/kg 比较,数量过大,因而降低了其对临床应用的指导意义。而在本研究中,我们发现较高细胞数量移植后动物死亡率较高,因此根据预实验结果,采用2×105/只(相当于1×107/kg)进行治疗,结果显示该细胞剂量也能起到治疗作用,人UCMSC 注射移植后动物体重恢复较快,死亡率降低,肠黏膜炎症减轻,大体和病理评分均有所降低。这表明,较低UCMSC 即可对IBD 起到治疗作用,但治疗的最佳细胞数量(范围)及其机理尚须进一步探讨。
本研究表明,采用尾静脉和腹腔2 条途径移植UCMSC 均可对溃疡性结肠炎起到治疗效果,但具体治疗机理尚须进一步探讨。
[1]Wirtz S,Neufert C,Weigmann B,et al.Chemically induced mouse models of intestinal inflammation[J].Nat Protoc,2007,2(3):541-546.
[2]Morris G P,Beck P L,Herridge M S,et al.Hapten-induced model of chronic inflammation and ulceration in the colon[J].Gastroenterology,1989,96(3):795-803.
[3]Appleyard C B,Wallace J L.Reactivation of hapten-induced colitis and its prevention by anti-inflammatory drugs[J].Am J Physiol,1995,269:G119-125.
[4]Tanaka F,Tominaga K,Ochi M,et al.Exogenous administration of mesenchymal stem cellsameliorates dextran sulfate sodium-induced colitis via anti-in fl ammatory action in damaged tissue in rats[J].Life Sci,2008,83(23-24):771-779.
[5]González M A,Gonzalez-Rey E,Rico L,et al.Adipose-derived mesenchymal stem cells alleviate experimental colitis by inhibiting inflammatory and autoimmune responses[J].Gastroenterology,2009,136(3):978-989.
[6]Zhang Q,Shi S,Liu Y,et al.Mesenchymal stem cells derived from human gingiva are capable of immunomodulatory functions and ameliorate inflammation-related tissue destruction in experimental colitis[J].J Immunol,2009,183(12):7787-7798.
[7]Liang L,Dong C,Chen X,et al.Human umbilical cord mesenchymal stem cells ameliorate mice trinitrobenzene sulfonic acid(TNBS)-induced colitis[J].Cell Transplant,2011,20(9):1395-1408.
[8]Castelo-Branco M T,Soares I D,Lopes D V,et al.Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis[J].PLoS One,2012,7(3):1-12.
[9]Hayashi Y,Tsuji S,Tsujii M,et al.Topical implantation of mesenchymal stem cells has beneficial effects on healing of experi-mental colitis in rats[J].J Pharmacol Exp Ther,2008,326(2):523-531.
[10]Ando Y,Inaba M,Sakaguchi Y,et al.Subcutaneous adipose tissue-derived stem cells facilitate colonic mucosal recovery from 2,4,6-trinitrobenzene sulfonic acid(TNBS)-induced colitis in rats[J].Inflamm Bowel Dis,2008,14(6):826-838.

