人乳头瘤病毒18型L1蛋白的包涵体和可溶性表达及纯化
麻粉莲,张骞,郑丽舒
中国疾病预防控制中心 病毒病预防控制所,北京 100052
人乳头瘤病毒(human papillomavirus,HPV)与人类多种疾病的发生有关,宫颈癌与HPV 感染密切相关。HPV L1 蛋白能够自发组装成病毒样颗粒,具有与完整病毒相同的抗原空间表位,免疫后可产生高滴度的中和抗体。因此,L1蛋白是HPV 疫苗研究的主要靶抗原。我们采用GST标记的原核表达系统,构建重组质粒pGEX-4T-1-HPV18 L1,HPV L1融合蛋白在大肠杆菌BL21 中以包涵体和可溶性形式高效表达,并建立了蛋白纯化方法,获得了HPV18 L1蛋白,为研究HPV疫苗奠定了基础。
1 材料和方法
1.1 材料
大肠杆菌BL21(DE3)和DH5α感受态购于博迈德生物有限公司;pGEX-4T-1和pMD18-T载体均由本实验室保存。凝血酶、谷胱甘肽琼脂糖凝胶4B购自GE 公司;蛋白marker、T4DNA 连接酶、限制性内切酶购自TaKaRa 公司;尿素、DTT、Tris、IPTG、氧化型和还原型谷胱甘肽购自Promega公司。
1.2 HPV18 L1序列的优化及TA克隆
根据GenBank中HPV18 L1(NC_001357.1)序列和大肠杆菌密码子嗜性优化L1 序列,在5′和3′端分别引入限制性酶切位点EcoRⅠ和XhoⅠ,送Invitrogen 公司合成。将L1 序列连接至pMD18-T 载体,转化宿主菌,测序鉴定。
1.3 重组质粒pGEX-4T-1-HPV18 L1的构建
用EcoR Ⅰ和XhoⅠ双酶切质粒pMD18-THPV18 L1,用T4DNA 连接酶连接于经同样酶切的表达质粒pGEX-4T-1上,将构建的重组质粒pGEX-4T-1-HPV18 L1 转化大肠杆菌BL21,挑选阳性菌落,提取质粒,双酶切和PCR鉴定。
1.4 HPV18 L1蛋白的表达
将鉴定正确的阳性克隆接种于含氨苄西林(l00 μg/mL)的LB 培养基中过夜培养后,按1∶50 的比例转接到LB 培养液中,当菌液D600nm值达0.6 时加入IPTG 于37℃诱导培养4 h(IPTG 终浓度为0.2 mmol/L)或于16℃诱导培养24 h(IPTG 终浓度为0.1 mmol/L),4℃、5000 r/min 离心10 min 收集菌体,重悬于PBS,超声破碎细菌,离心收集上清和沉淀,12% SDS-PAGE鉴定并分析目的蛋白的表达。
1.5 HPV18 L1蛋白的纯化
1.5.1 包涵体纯化 经12% SDS-PAGE 鉴定,37℃诱导时HPV18 L1 蛋白为包涵体形式,在破碎菌体的沉淀内有大量目的蛋白。大量表达HPV18 L1蛋白,收集菌体,PBS 洗涤,加入菌体超声波裂解缓冲液(20 mmol/L Tris-Cl,0.1 mmol/L EDTA,0.5 mol/L NaCl,0.1% TrixtonX-100,pH8.0)破碎菌体,4℃、5000 r/min 离心25 min,弃上清,收集沉淀;沉淀中加入包涵体洗涤液Ⅰ(50 mmol/L Tris-Cl,5 mmol/L EDTA,2 mol/L 尿素,0.5% Triton X-100,pH8.0)洗涤,4℃、12 000 r/min 离心30 min,收集沉淀;沉淀中加入包涵体洗液Ⅱ(50 mmol/L Tris-Cl,pH8.0)洗涤,离心后用双蒸水洗涤沉淀,离心收集沉淀;用包涵体裂解液(50 mmol/L Tris-Cl,2 mol/L 尿素,pH12.0)溶解沉淀,将变性的包涵体装入透析袋,用复性液Ⅰ(50 mmol/L Tris-Cl,0.1 mmol/L DTT,pH8.0)于4℃透析12 h,50 mmol/L Tris-Cl(pH8.0)于4℃透析12 h,复性液Ⅱ(50 mmol/L Tris-Cl,0.2 mmol/L 氧化型谷胱甘肽,1 mmol/L 还原型谷胱甘肽,pH8.0)于4℃透析12 h;透析结束,4℃、12 000 r/min 离心30 min,收集上清和沉淀;包涵体复性产物用0.45 μm 滤器过滤,用GST 4B 纯化试剂盒纯化;用PBS 平衡GST 柱子后将复性产物上样,充分洗去杂蛋白,用还原型谷胱甘肽洗脱目的蛋白,收集不同峰值样品,经12% SDS-PAGE和Western印迹鉴定。
1.5.2 可溶性L1 蛋白的纯化 经12% SDS-PAGE鉴定,16℃诱导时HPV18 L1 蛋白为可溶性表达,在破碎菌体的上清和沉淀内均有目的蛋白。大量表达HPV18 L1 蛋白,超声波破碎菌体,收集上清,进行GST 4B亲和纯化。为去除分子伴侣,在破碎菌体中加入1 mmol/L ATP 孵育30 min,再加入3.5 mol/L尿素孵育30 min,4℃、14 400 r/min 离心75 min,收集上清,进行GST 4B亲和纯化。收集不同峰值的样品,经超滤管浓缩后,用50 mmol/L Tris-Cl(pH8.0)于4℃透析18 h。每毫升蛋白加入20 U 凝血酶,22℃孵育8 h,用Western印迹鉴定酶切结果。
2 结果
2.1 HPV18 L1序列的优化及TA克隆
HPV18 L1 基因全长1602 bp,编码533 个氨基酸残基。按照大肠杆菌密码子嗜性优化L1 基因序列后,密码子适应指数(CAI)由0.228 上升为0.578,密码子偏爱指数(CBI)由-0.09 上升为0.470,氨基酸序列未发生改变。测序结果显示重组质粒pMD18-T-L1的序列正确。
2.2 重组质粒pGEX-4T-1-HPV18 L1 的双酶切和PCR鉴定
用EcoRⅠ和XhoⅠ双酶切重组质粒pGEX-4T-1-HPV18 L1,同时进行PCR 鉴定,1%琼脂糖凝胶电泳显示在1600 bp 处均有目的条带(图1),表明L1基因成功插入pGEX-4T-1载体。
2.3 HPV18 L1蛋白原核表达的鉴定
经12% SDS-PAGE 检测,在37℃用0.2 mmol/L IPTG 诱导表达4 h,L1 蛋白以包涵体形式存在,在相对分子质量约86 000 处可见明显条带(图2),与HPV18 L1-GST融合蛋白预期大小吻合。在16℃用0.1 mmol/L IPTG 诱导表达24 h,L1 蛋白为可溶性表达,在破碎菌体的上清和沉淀中均有相对分子质量约86 000的新增条带,上清孔中约60 000的条带为分子伴侣GroEL(图3)。
2.4 包涵体形式表达的HPV18 L1蛋白的纯化
12% SDS-PAGE 结果表明,包涵体经洗涤后杂蛋白减少,目的蛋白含量较高。经碱变性溶解包涵体,大量菌体被溶解。蛋白复性后用GST 4B进行亲和纯化,在相对分子质量约86 000 处有单一条带,为HPV18L1-GST融合蛋白(图4)。
2.5 可溶性形式表达的HPV18 L1蛋白的纯化
将破碎的菌体上清进行GST 4B亲和纯化,发现GroEL 和HPV18L1-GST 融合蛋白共同被纯化,相对分子质量分别为60 000 和86 000。但是,如果在超声波破碎的菌体中加入ATP 和尿素作用后,经GST 4B 亲和层析纯化可得到HPV18 L1-GST 融合蛋白,同时可去除GroEL(图5)。
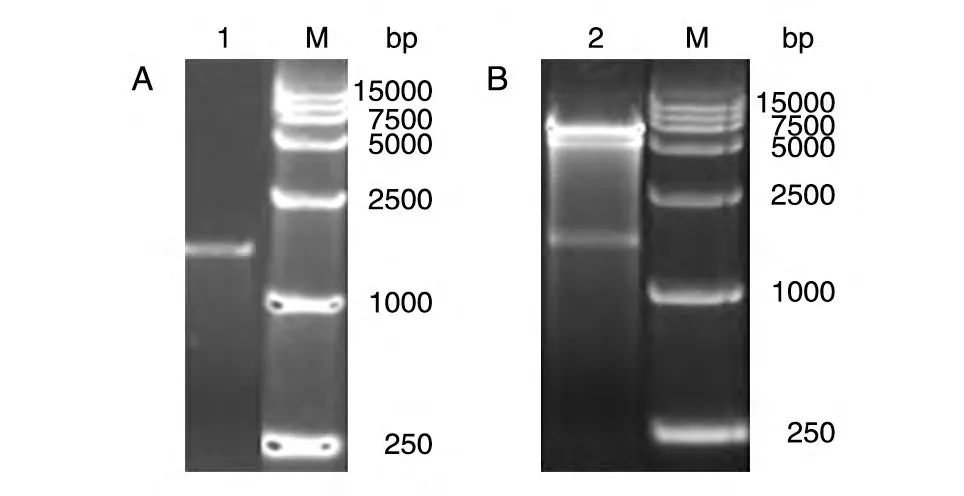
图1 重组质粒的PCR(A)和酶切(B)鉴定
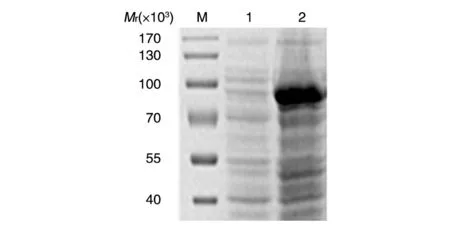
图2 HPV18 L1表达的SDS-PAGE分析
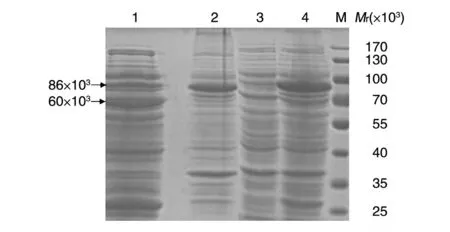
图3 HPV18 L1不同表达方式的SDS-PAGE分析
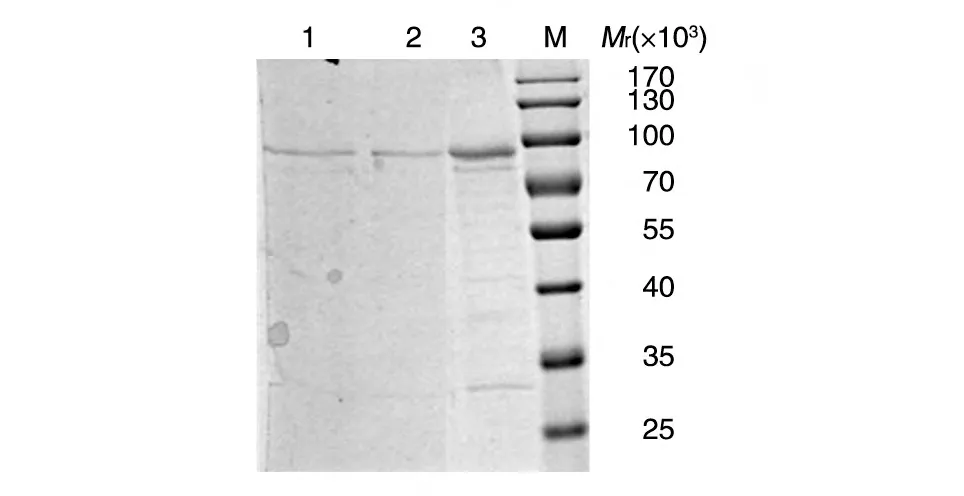
图4 以包涵体形式表达的HPV18 L1蛋白的GST 4B纯化
2.6 HPV18 L1-GST融合蛋白的Western印迹鉴定
包涵体形式表达的HPV18 L1-GST融合蛋白纯化后降解条带较多,而可溶性表达的融合蛋白纯化后条带单一,无蛋白降解现象(图6)。
2.7 HPV18 L1-GST融合蛋白的凝血酶酶切
可溶性表达的蛋白纯化后得到的HPV18 L1-GST 融合蛋白条带单一,经凝血酶酶切后可去除GST 标签,Western 印迹检测显示在相对分子质量60 000 处有明显条带,能被HPV18 L1 特异性抗体识别,为HPV18 L1蛋白,相对分子质量42 000处的条带为L1蛋白的降解产物(图7)。
3 讨论
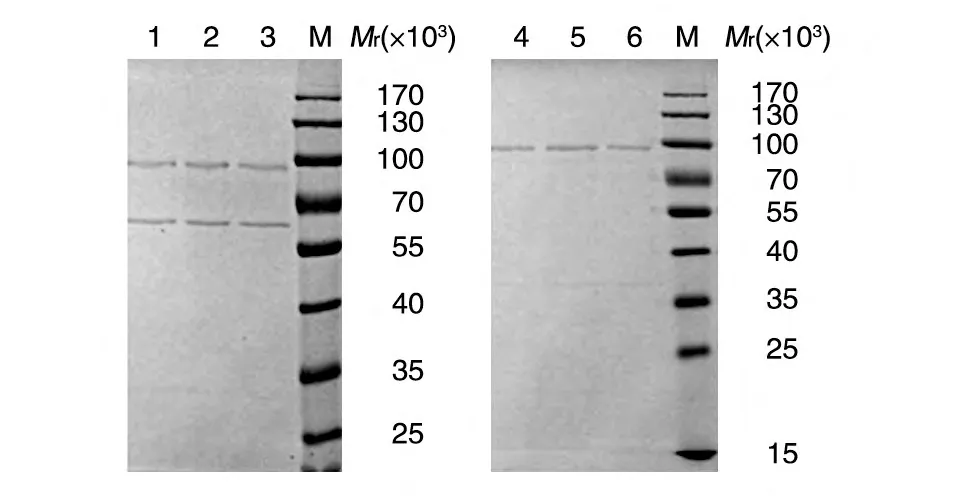
图5 以可溶性形式表达的HPV18 L1蛋白的GST 4B纯化
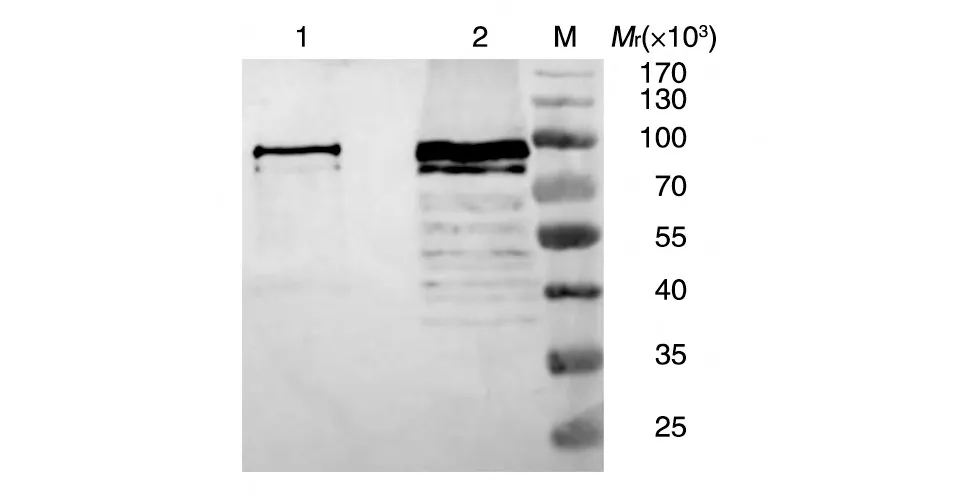
图6 HPV18L1-GST融合蛋白的Western印迹
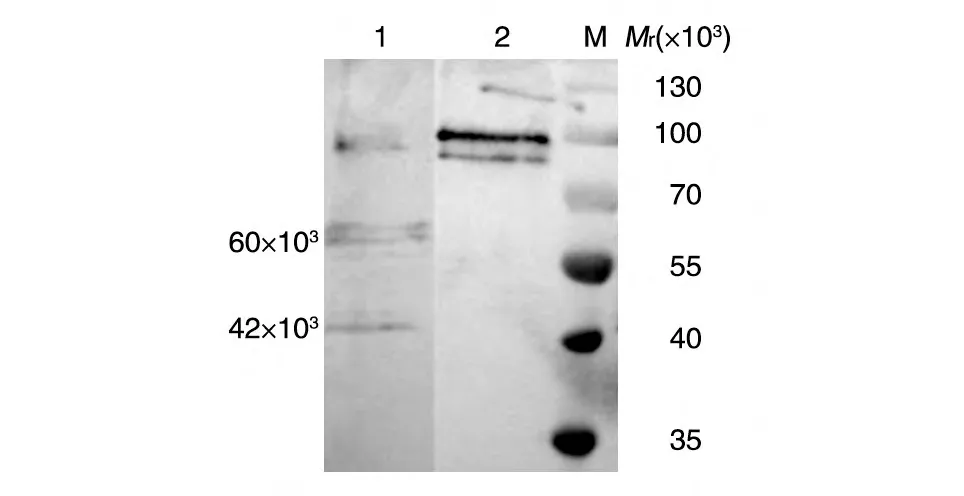
图7 HPV18L1-GST融合蛋白的凝血酶酶切
外源基因在大肠杆菌中的高效表达受很多因素的影响。用pUC 表达载体表达HPV18 L1 蛋白时,目的蛋白发生降解,表达量低。本实验采用了带有GST 标签的原核表达载体pGEX-4T-1,GST 既能增加外源蛋白的可溶性,提高蛋白质的表达量,又便于亲合层析纯化目的蛋白。本实验构建了pGEX-4T-1-HPV18 L1 重组质粒,诱导后HPV18 L1 以GST 融合蛋白的形式表达,SDS-PAGE 可见相对分子质量86 000 条带。37℃以0.2 mmol/L 的IPTG 诱导表达4 h,蛋白为包涵体形式,经洗涤、变性、复性和GST 4B 亲和纯化,可获得HPV18 L1-GST 融合蛋白,但降解条带较多。16℃以0.1 mmol/L IPTG 诱导表达24 h,蛋白为可溶性形式,经去除分子伴侣GroEL、GST 4B亲和纯化和凝血酶酶切去除GST标签,可获得HPV18 L1纯化蛋白,但酶切效率有待提高。
尿素、盐酸胍变性会破环蛋白质二级结构,使疏水性氨基酸残基暴露在表面。包涵体溶解与尿素浓度、蛋白质浓度和溶液pH 值有关。本实验中,将包涵体在碱变性条件下溶解,将可溶部分用含有还原剂的中性缓冲液透析促进二硫键正确折叠,多余的还原剂可再次透析除去,大部分包涵体在50 mmol/L Tris(pH12.0)和2 mol/L 尿素中可以溶解。此方法既能保持蛋白质二级结构,又使蛋白质溶解达到最大化[1]。在复性过程中,有许多条件影响目的蛋白的重折叠。一是细菌成分和杂蛋白的影响。低浓度尿素、TritonX-100 和EDTA 有利于除去脂类、脂多糖、核酸等杂质。其次,复性时蛋白质浓度很关键,蛋白质浓度高于1 mg/mL,则复性得率低于10%,蛋白质浓度为10~50 μg/mL时复性得率最高。三是小分子添加剂的使用。L1 蛋白含有12 个半胱氨酸残基,为高度富含二硫键的蛋白质,DTT、氧化型和还原型谷胱甘肽能够促进L1蛋白的正确折叠。
将可溶性HPV18 L1 蛋白进行GST 4B 亲和层析纯化,同时得到分子伴侣GroEL 和HPV18L1-GST融合蛋白,这与Chen 的报道一致[2]。在蛋白质折叠过程中,GroEL 结合伸展的肽链或折叠的中间态,并在ATP 和GroES 的作用下,水解ATP 释放底物蛋白质和能量,促进底物蛋白质的折叠。GroEL 可通过不同的作用力与各种底物结合,利用层析技术也不能使其分开,说明两者之间存在相互作用。去除与底物多肽紧密结合的GroEL 有三种方法:一是通过ATP 和大肠杆菌变性蛋白质的作用可以有效去除GroEL[3],但考虑到大肠杆菌变性蛋白中杂带较多,我们未采取此方法。二是改变GroEL 的基因片段,使后期纯化时无GroEL 存在[4]。三是ATP 和尿素共同作用去除GroEL。GroEL 具有ATP 激酶活性[5]。ATP 水解是诱导GroEL 构象变化的关键,在ATP 的作用下,分子伴侣与目的蛋白之间从紧密结合变成疏松结合状态。3.5 mol/L尿素可以打乱GroEL二级结构[6]。ATP 结合GroEL 后,尿素能进一步诱导GroEL 和底物蛋白质解聚,将目的蛋白从GroEL 上释放出来,本研究即采用此法。
大肠杆菌表达系统是表达外源蛋白质的首选系统。若大肠杆菌中表达的蛋白折叠成对热不稳定的中间体,便会促进包涵体形成。低温表达可降低翻译速率,使蛋白质有足够时间正确折叠,并能减少重组蛋白的热变性,因此,低温培养条件能在一定程度上抑制包涵体的形成。虽然低温表达时延长了外源蛋白诱导时间,但相对于其后包涵体变性、复性等步骤的繁琐,目的蛋白含量的损失和天然活性的丧失,本实验选择低温表达HPV18 L1 蛋白是可行的。本研究建立了HPV18 L1 融合蛋白的纯化方法,酶切去除了GST 标签,获得了HPV18 L1 蛋白,是后续疫苗研发的基础。
[1]Khan R H,Rao K B C,Eshwari A N S,et al.Solubilization of recombinant ovine growth hormone with retention of nativelike secondary structure and its refolding from the inclusion bodies of Escherichia coli[J].Biotechnol Prog,1998,14(5):722-728.
[2]Chen X S,Gregory C,Stephen C H,et al.Papillomavirus capsid protein expression in Escherichia coli:purification and assembly of HPV11 and HPV16 L1[J].J Mol Biol,2001,307(1):173-182.
[3]Mattias R,Kimberly J H.Separation of copurifying Groel from glutathione-S-transferase fusion proteins[J].Protein Expr Purif,2000,20(1):45-47.
[4]Masayuki F,Lawrence S.Recombinant expression and purification of smad proteins[J].Protein Expr Purif,2000,20(3):507-513.
[5]Amnon H.Structural aspects of Groel function[J].Curr Opin Struct Biol,1998,8(1):93-100.
[6]Andreas B,Brian P S,Hanno E,et al.Isolation and biochemical characterization of highly purified escherichia coli molecular chaperone Cpn60(groel) by affinity chromatography and urea-induced monomerization[J].BBA Protein Struct Mol Enzymol,1995,1252(1):69-78.

