神经节苷脂对脑外伤大鼠大脑皮质和海马区GAP-43表达的影响
金 玲,易建国,王春风,江兴林*,李洪亮,曹湘玉
(湖南医药学院临床医学系,湖南 怀化418000)
脑性瘫痪(简称脑瘫)是各种原因所引起的脑损伤或发育缺陷所致的运动障碍及姿势异常的一种疾病,是继脊髓灰质炎基本被控制之后,儿童肢体残疾的主要疾病。 以往多从脑瘫的病因、病理学研究来探讨脑瘫的发病机制,尚未获理想的效果。 神经节苷脂(GM1,商品名“申捷”)是一种脑神经保护剂, 具有刺激中枢神经系统损伤后潜在的代偿机制,促进“ 神经重构”(包括神经细胞的生存、轴突和突触生长),在细胞的发育、分化、修复神经组织、神经元的可塑性等方面起着重要作用,国内尚未查到从分子生物水平研究GM1治疗脑性瘫痪大鼠康复机制的文献报道。 因此我们采用大鼠脑外伤模型,观察应用GM1后各时间点脑外伤大鼠大脑皮质和海马区神经细胞神经生长相关蛋白-43(growth associated protein 43,GAP-43)表达的变化,了解药物对大脑皮质和海马区神经细胞的保护作用,初步探讨药物干预对脑外伤大鼠受损神经功能修复的可能机制,为临床应用药物治疗脑瘫提供可靠的实验依据。 现将方法和结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 选取出生10 周并经适应性喂养3 d、体质量在200~250 g 的SD 大鼠200 只,来源于湖南斯莱克景达实验动物有限公司, 合格证书号:SCXK(湘)2011-0003。 适应性喂养的饲料及屏蔽环境实验设施由中南大学实验动物中心 (SPF 级)提供,在光/暗周期为12 h/12 h(光照时间7:00-9:00)的条件下饲养于笼中,自由获得饲料和饮水。
1.1.2 药物 神经节苷脂(GMl,商品名“申捷”,北京四环制药有限公司生产,生产批号:4010531,注射剂,2 mg/mL)。
1.1.3 主要仪器和试剂 芬兰352 型352017148 酶标分析仪,芬兰AC8 型洗板机。GAP-43 酶联免疫分析试剂盒,批号:2010207,购自北京永辉生物科技有限公司。
1.2 方法
1.2.1 动物分组 200 只大鼠随机分为假手术组60 只,GM1组和模型组各70 只。
1.2.2 动物造模 脑外伤造模方法按楚胜华等[1]运用特制的造模打击装置, 以自由落体撞击致使动物脑外伤模型。 大鼠手术与脑外伤造模前禁食8 h,实验时将大鼠俯卧位固定于脑立体定向仪上, 消毒头部皮肤,按0.35 g/kg 腹腔内注射10%水合氯醛进行麻醉,正中切开头皮后剥离骨膜,充分暴露右顶骨,用牙科钻在冠状缝后1.5 mm、 中线旁2.5 mm 处钻一直径5 mm 的骨窗,并保持硬膜完整。 假手术组:不施加砝码撞击即封闭头皮,未致脑外伤。 模型组和GM1组:用20 g 砝码于30 cm 高处坠落,撞击撞杆从而撞击硬膜,致右顶叶中度脑挫裂伤,最后封闭头皮。 术后苏醒再带回到原饲养处喂养,并按楚胜华的旷野试验等[1]行为学测评标准确定大鼠脑受损的行为学表现,实验完成后剩余脑外伤大鼠一律处死。
1.2.3 给药方法 假手术组、 模型组均按20 mL/(kg·d) 腹 腔 注 射 生 理 盐 水;GM1组 给 予 浓 度 为2 mg/mL 的GM1注射液按20 mL/(kg·d)腹腔注射,以上各组每天1 次,术前连续注射3 d。
1.2.4 标本采集 (1) 造模后在0、2、4、8、12、16、24 h 时间点,分别在各组中提出6 只大鼠,以颈动脉取血后处死大鼠;(2)采大脑皮质组织标本方法:剪断头颅,沿正中线切开头皮,剥开颅骨,暴露完整的大脑组织,撕开硬脑膜后,用弯镊取出大脑最外层顶叶皮质放入标记好的冰冻管, 经液氮速冻后,放入-80 ℃冰箱保存;(3) 采大脑海马组织标本方法:取脑并切除下丘脑,剪断前联合,切除小脑和脑干,沿大脑矢状裂将大脑半球纵行切开,剥离枕叶内侧丘脑及纹状体,暴露边缘系统,用小药匙轻轻剥离双侧海马组织, 放入冻存管, 经液氮速冻后,于-80 ℃保存;(4)所有的标本处理好后,分别称取各份标本2 g, 加入pH 7.4 的磷酸盐缓冲液2 mL中, 将标本充分研成匀浆,2 000 r/min 离心20 min,收集上清液,分装后冷冻备用。
1.3 检测指标
1.3.1 GAP-43 检测 按GAP-43 酶联免疫分析试剂盒操作使用说明进行测量。 即通过包被、加样、加酶标抗体、加底物液显色、终止反应,在酶标仪上于450 nm 波长处,以空白管调零测定吸光度值,通过标准曲线计算大鼠样品中GAP-43 浓度。
1.3.2 动物行为学检测 分别于术后第1~5 天时间点,由3 组随机各取6 只实验大鼠,在标本采集前进行运动功能计分检测,通过不自主动作、旷场试验、倾斜板试验、拒俘反应检测测试肢体肌力、随意运动和情感行为能力[2]。
1.4 统计学分析
2 结果
2.1 各组大鼠不同时间点大脑皮质区GAP-43 表达的比较
与假手术组 0~24 h 的GAP-43 表达比较,模型组明显高于假手术组, 差异有统计学意义 (P<0.01),但GM1组随着时间的增加而升高,至24 h 已达模型组水平;GM1组大鼠大脑皮质区8~24 h GAP-43 的表达明显高于假手术组, 差异有统计学意义(P<0.01)。 GM1组与模型组同时间点比较(P<0.01)。 结果见表1。
2.2 各组大鼠不同时间点大脑海马区GAP-43 表达的比较
与假手术组大鼠大脑海马区0~24 h 的GAP-43 表达,模型组各时间点均明显升高,差异有统计学意义 (P<0.01);GM1组大鼠大脑海马区GAP-43的表达与模型组比较,差异有统计学意义(P<0.01)。结果见表2。
表1 各组大鼠术后不同时间点大脑皮质区GAP-43 表达的比较 (n=6,±s,ng/L)

表1 各组大鼠术后不同时间点大脑皮质区GAP-43 表达的比较 (n=6,±s,ng/L)
注:与假手术组比较△△P<0.01;与模型组同时间点比较**P<0.01。 表2 同。
组 别假手术组模型组GM1 组0 h 2 525.4±179.9 3 539.6±267.4△△2 679.6±164.1**2 h 2 837.0±359.3 3 547.2±115.6△△2 703.2±115.6**4 h 2 730.9±256.6 3 262.5±306.4△△2 726.2±191.3**8 h 2 555.0±296.2 3 748.3±197.8△△2 747.5±270.0**△△12 h 2 744.5±256.9 3 935.2±102.3△△2 946.7±174.5**△△16 h 2 458.3±189.0 3 559.2±235.6△△3 045.6±208.4**△△24 h 2 867.8±361.2 3 132.8±109.9△△3 185.8±186.9△△
表2 各组大鼠术后不同时间点大脑海马区GAP-43 表达的比较 (n=6,±s,ng/L)

表2 各组大鼠术后不同时间点大脑海马区GAP-43 表达的比较 (n=6,±s,ng/L)
组 别假手术组模型组GM1 组0 h 2 643.7±361.6 3 188.6±206.7△△2 875.5±317.2**2 h 2 598.7±393.8 4 465.0±391.5△△2 795.1±289.3**4 h 2 471.8±275.7 3 958.8±366.8△△2 698.9±252.3**8 h 2 576.3±279.4 3 036.9±364.4△△2 611.5±280.9**12 h 2 849.4±277.5 3 571.8±110.9△△2 641.2±133.9**16 h 2 561.3±101.3 3 384.4±285.9△△2 663.4±189.9**24 h 2 744.4±322.4 3 644.6±308.8△△2 694.8±130.3**
2.3 各组大鼠不同时间点行为学检测评分比较
假手术组大鼠运动能力术后第1~5 天不同时间点都是较强的, 得分显著高于模型组和GM1组(P<0.01)。 GM1组大鼠手术后2~5 d 运动能力逐步增强,且明显高于模型组(P<0.05)。 结果见表3。
表3 各组大鼠术后不同时间点行为学评分的比较 (±s,分)
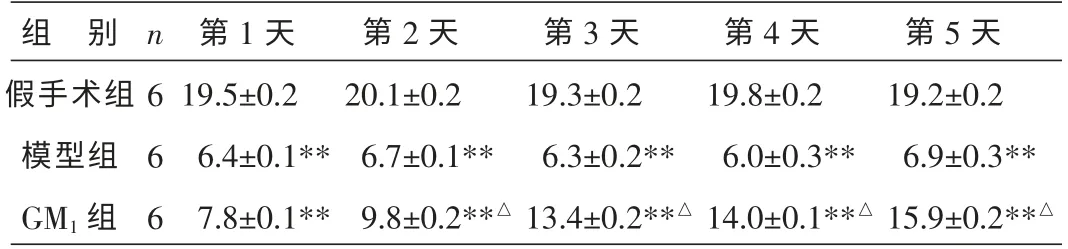
表3 各组大鼠术后不同时间点行为学评分的比较 (±s,分)
注:与假手术组同时间点比较**P<0.01;与模型组同时间点比较△P<0.05。
组 别假手术组模型组GM1 组n 6 6 6第1 天19.5±0.2 6.4±0.1**7.8±0.1**第2 天20.1±0.2 6.7±0.1**9.8±0.2**△第3 天19.3±0.2 6.3±0.2**13.4±0.2**△第4 天19.8±0.2 6.0±0.3**14.0±0.1**△第5 天19.2±0.2 6.9±0.3**15.9±0.2**△
3 讨论
GAP-43 是一种特异性胞膜磷酸蛋白, 参与轴突的生长、突触发育形成和神经再生,在神经再生时呈高表达状态,但随着损伤修复时间的延长而逐渐回落,直至再生完成。因此GAP-43 被很多学者认为是研究脑损伤修复的首选标志物之一[3]。 有研究证实,GAP-43 表达增加可以促进培养细胞和在体的轴突生长[4];Haynes 等[5]发现脑室周围白质软化(PVL) 大鼠坏死灶区域可以检测到GAP-43 的表达, 说明该处的组织坏死可以导致GAP-43 保护性的表达上调;Farina V 等[6]研究表明GAP-43 在应激效应后3 d 才出现表达高峰;林栋等[7]实验发现缺血缺氧大鼠治疗7 d 后取材,GAP-43 表达水平未有显著变化,说明取材时间点的不同会影响实验结果的分析。
参考以上文献,该实验设计充分考虑了脑外伤治疗中药物干预特点, 并结合不同时间的作用结果, 即在干预研究中动态地纳入时间因素分析,在不同疗法的多个时间点上观测指标的动态变化,从而客观地反映不同干预方法对研究对象的影响。 在实验过程中动用了200 只大鼠,手术脑外伤造模前3 d 开始给药GM1注射液和生理盐水,每天1 次,连续3 d。 运用GM1的目的既可增强神经营养因子活性,又可减轻造模时大鼠神经细胞变性、坏死和凋亡,希望能增加动物造模的成功系数。 因此,采用这些保护性措施,注射了GM1注射液的GM1组自然死亡的大鼠较少,模型组死亡的大鼠较多,这说明在脑损伤动物实验中,预防性的给药GM1可提高脑损伤大鼠造模的成功率,降低死亡率,本实验中各组死亡率比较已另有论文发表[8]。
实验结果表明:GM1组大鼠大脑皮质0~16 h 和海马区0~24 h GAP-43 的表达均低于模型组,有显著差异;行为学表现优于模型组。GM1组大鼠大脑皮质GAP-43 0~4 h 的表达与假手术组比, 差异无统计学意义,8~24 h 表达升高且明显高于假手术组,这说明造模前用药GM1对脑损伤起到了保护作用,故行为学表现优于模型组。 大鼠大脑海马区GAP-43 的表达0~24 h 均无明显上升,说明GM1对海马区无明显作用。GM1组大脑皮质GAP-43 8~16 h 表达逐步上升,大于假手术组,低于模型组,至24 h达到模型组水平,这说明GM1延缓了GAP-43 的表达高峰,这和Farina V 等[6]的观点即GAP-43 表达要在脑损伤后3 d 才出现表达高峰较为一致。
该研究结果证实:预防性使用GM1可以有效地促进实验性脑外伤大鼠大脑皮质GAP-43 的表达升高,降低脑损伤的程度,增强脑外伤动物行为学表现。 因此, 该研究提示是否能在临床上尽早使用GM1,最好在产妇住院生产前预防性使用GM1,从而有效阻断脑损伤的发生、发展,或者降低脑损伤患儿病死率和致残率。 该研究为脑损伤的预防以及临床治疗提供了新的思路和研究基础。
[1]楚胜华,陈二涛,冯东福,等.脑外伤后抑郁状态模型的建立及效果评价[J].中华急诊医学杂志,2012,21(7):718-724.
[2]王 哲,伍明辉,钟炳武,等.脑灵汤对阿尔茨海默病大鼠模型行为学及海马CA3 区小胶质细胞和IL-6 表达的影响[J].中南大学学报(医学版),2013,38(2):113-119.
[3]郭 敏,李 刚.突触可塑性相关蛋白的研究进展[J].神经药理学报,2013,3(6):57-64.
[4]刘 健,杨小玉,杨茂光,等.中枢神经损伤后GAP-43 蛋白对神经再生及轴突导向作用及其机制的研究进展[J]. 吉林大学学报(医学版),2013,39(1):180-183.
[5]Haynes R L,Billiards S S,Borenstein N S, et al. Diffuse axonal injury in periventricular leukomalacia as determined by apoptotic marker fractin [J]. Pediat Res,2008,63(6):656-661.
[6]Farina V,Gadau S,Lepore G, et a1. Growth-associated protein expression in the frontal and occipital cortices of callosotomized rats [J]. Funct Neuro,2004,19(3):181.
[7]林 栋,阙秀琴,张学君,等.针刺与运动疗法不同干预次序对缺血缺氧大鼠皮层GAP-43 表达的影响[J].时珍国医国药,2011,7(22):1 768-1 770.
[8]金 玲,黄民江,李洪亮,等.神经节苷脂对实验性颅脑外伤大鼠的保护作用及机制[J].中国康复医学杂志,2013,12(28):1 142-1 145.

图1 Masson 三色染色皮肤组织图(×200)

