癫疒间伴发抑郁大鼠模型建立及评价
杨 萍,李 亮*,孙美珍
(1.湖南省第二人民医院精神科,湖南 长沙410007;2.湖南中医药大学中医诊断研究所,湖南 长沙410208;3.山西医科大学附一医院神经内科,山西 太原030001)
癫疒间与抑郁共存被认为是一种常见的神经精神病学现象[1]。我们前期对锂-匹罗卡品癫疒间大鼠进行抑郁筛选,挑选出伴发抑郁的大鼠,作为癫疒间伴发抑郁(epilepsy with depression,EWD)复合模型进行进一步研究,成功率仅约25%,实验费用高而且资源颇为浪费[2]。 在此基础上我们改良了造模方法,将传统的“锂-匹罗卡品癫疒间造模”与“慢性温和应激刺激(chronic mild stress,CMS)抑郁造模”进行联合,制备EWD 复合模型,并对此模型的建立和有效性做了系统的评价。 现将方法和结果报道如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物和分组 成年雌性健康清洁级SD大鼠(动物使用合格证号43004700005442),体质量180~220 g, 由湖南中医药大学实验动物中心提供(动物质量合格证号SYXK(湘)2009-0001)。 标准饲料喂养,自由摄食饮水。 其间训练饮用蔗糖水,测定蔗糖水消耗和旷场试验基线值。 之后选择行为学评分相近大鼠,随机分为4 组:正常组8 只、癫疒间组11只、CMS 组9 只、癫疒间+CMS 组10 只。 癫疒间组采用锂-匹罗卡品进行慢性癫疒间造模,CMS 组采用CMS进行抑郁造模,癫疒间+CMS 组在进行慢性癫疒间造模后再予以CMS 进行联合造模以制备EWD 大鼠模型。 最终32 只大鼠纳入统计,每组8 只。
1.1.2 实验药物 匹罗卡品(美国Sigma 公司,批号P1650000);氯化锂(美国Sigma 公司,批号62480);5-HT1A 受体引物(武汉博士德公司合成)。
1.1.3 主要仪器 荧光定量PCR 仪(西安天隆科技有限公司,TL988)。
1.2 实验方法
1.2.1 癫疒间模型制备 将癫疒间组大鼠腹腔注射氯化锂3 mEq/kg,18 h 后再给予匹罗卡品30 mg/kg,在注射匹罗卡品前20 min 注射阿托品1 mg/kg 以拮抗外周胆碱能作用。 正常组注射30 mg/kg 生理盐水。 根据Racine 分级标准[3],造模后出现癫疒间持续状态40 min即给予地西泮4 mg/kg 和10%水合氯醛3 mL/kg,终止急性期癫疒间发作,Racine≥IV 级并存活者入组。 存活大鼠随后出现不同程度的慢性疒间性发作(如抽搐、点头等),表明造模成功。 造模持续4 周。
1.2.2 CMS 模型制备 将CMS 组大鼠按Willner方法[4]加以改进制备抑郁模型,选择以下9 种刺激每天随机采取一种,共安排2 周。 (1)禁食、禁水20 h;(2)禁水17 h;(3)倾斜鼠笼(45 ℃)17 h;(4)湿笼(100 g 锯屑垫料中加入200 mL 水)21 h;(5)持续光照17 h;(6)电击(30 V 电压)足底5 s;(7)4℃冰水游泳(水深15 cm,大鼠的后足尖刚能触及桶底)5 min;(8)夹尾1 min;(9)行为限制2 h。
1.2.3 EWD 模型制备 针对癫疒间+CMS 组大鼠,将以上两种造模方法进行联合。 首先进行癫疒间模型制备,造模4 周后进行CMS 模型制备。
1.3 检测方法
1.3.1 抑郁行为学检测 造模后第6 周进行。 (1)糖水消耗试验:造模前训练大鼠适应饮糖水,每笼同时放置2个水瓶,第一个24 h,两瓶均装有1 %蔗糖水,随后的24 h,一个瓶装1%蔗糖水,另一个瓶装纯水。禁水24 h 后,进行动物的基础糖水/纯水消耗试验。 同时给予每只大鼠事先定量好的两瓶水:1 瓶1%蔗糖水和1 瓶纯水。 1 h 后,取两瓶水称量。 计算动物的糖水消耗、糖水偏爱(糖水偏爱=糖水消耗/总液体消耗×100%)。 (2)旷场试验:由不透明材料制成的76 cm×76 cm×42 cm 正方形敞箱,底面等分为25个等边方格;晨7:30~12:00 在安静的房间内观察置于中心方格内的大鼠5 min 内垂直运动次数、水平运动次数。 彻底清洁敞箱后进行下一只大鼠的观察。
1.3.2 5-HT1A 受体mRNA 表达的检测 进行抑郁行为学检测后麻醉后处死动物,取海马齿状回。 用Triziol 法提取总RNA,用反转录酶将mRNA 反转录为cDNA。 构建聚合酶体系(5-HT1A 受体的上游引物为5’-GCACCAGCTTAGGAACTTCG-3’, 下游引物为5’-CAGAGGAAGGTGCTCTTTGG-3’, 扩增片段长度206 bp;β-actin 的上游引物为5’-GTCAGGTCATCACTATCGGCAAT-3’, 下游引物为5’-AGAGGTCTTTACGGATGTCAACGT-3’, 扩增片段长度210 bp);Taq 酶催化, 热循环:95 ℃预热5 min,40个循环(94 ℃20 s;退火20 s;72 ℃30 s)。 采用荧光实时定量PCR 法,将阈值循环数(Ct)值与不同浓度标准品的对数值拟合作图, 得出校正曲线。 Ct值为mRNA 丰度定量标准,Ct 值越高, 代表mRNA丰度越低。 △△Ct=(实验组目的基因Ct 值-实验组内参基因Ct 值)-(正常组目的基因Ct 值-正常组内参基因Ct 值)。 通过2-△△Ct法根据目的基因与内参物(β-actin)Ct 值的比较,得到目的基因相对于内参基因的表达量,对5-HT1A 受体mRNA 表达水平进行定量,以此进行统计学分析。
1.4 统计学分析
2 结果
2.1 造模结果
癫疒间组癫疒间造模成功9 只,造模第10 天癫疒间大发作死亡1 只;CMS 组造模第37 天死亡1 只;癫疒间+CMS 组造模第13 天癫疒间大发作死亡1 只,造模第42 天死亡1 只。癫疒间+CMS 组大鼠均出现不同程度癫疒间发作,且伴有体质量、食欲下降、兴趣丧失、活动减少。
2.2 大鼠抑郁行为学比较
与正常组比较,癫疒间组大鼠的抑郁行为学指标(糖水消耗、糖水偏爱、垂直及水平运动次数)没有统计学意义,CMS 组各指标降低, 差异有统计学意义(P<0.05),癫疒间+CMS 组则降低得更为明显,差异有统计学意义(P<0.01);与癫疒间组比较,癫疒间+CMS组各指标降低,差异有统计学意义(P<0.05);与CMS组比较,癫疒间+CMS 组的糖水偏爱程度降低,差异有统计学意义(P<0.05)。 结果见表1。
表1 各组大鼠抑郁行为学变化 (n=8,±s)

表1 各组大鼠抑郁行为学变化 (n=8,±s)
注:与正常组比较*P<0.05,☆☆P<0.01;与癫疒间组比较△P<0.05;与CMS 组比较◇P<0.05。
组 别正常组癫疒间组CMS 组癫疒间+CMS 组糖水消耗试验糖水消耗(mL) 糖水偏爱(%)13.61±2.6 83.6±7.6 10.9±3.9 75.1±15.3 8.5±0.3* 64.9±9.4*7.6±2.8☆☆△ 55.1±13.7☆☆△◇旷场试验垂直运动(次) 水平运动(次)21.6±2.1 58.2±13.1 17.4±4.4 49.2±17.5 5.3±1.6* 21.4±4.1*7.4±2.3☆☆△ 19.5±6.3☆☆△
2.3 大鼠5-HT1A 受体mRNA 表达比较
与正常组比较,癫疒间组、CMS 组、癫疒间+CMS 组大鼠的5-HT1A 受体mRNA 表达降低,差异有统计学意义(P<0.05),癫疒间+CMS 组降低的更为明显;与癫疒间组比较,癫疒间+CMS 组5-HT1A 受体mRNA 表达无统计学意义;与CMS 组比较,癫疒间+CMS 组5-HT1A 受体mRNA 表达降低, 差异有统计学意义(P<0.05)。 结果见表2、图1。 图1 为各造模大鼠5-HT1A 受体基因与内参基因溶解扩增曲线图, 曲线呈下降趋势,说明该指标检测特异性高。
表2 各组大鼠海马中5-HT1A 受体mRNA 表达比较(±s,n=8)
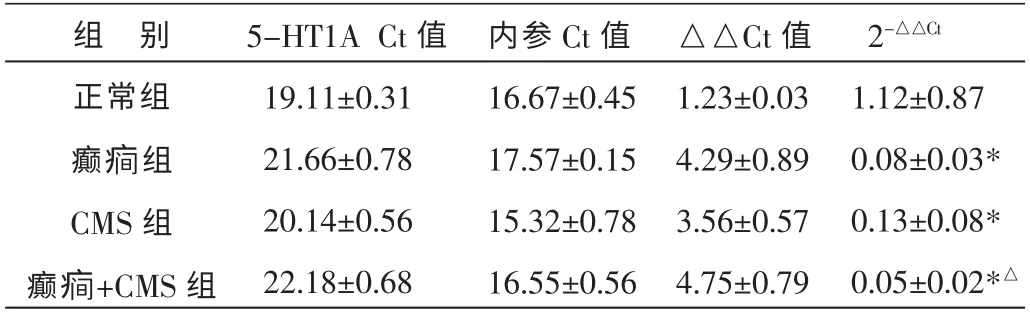
表2 各组大鼠海马中5-HT1A 受体mRNA 表达比较(±s,n=8)
注:与正常组比较*P<0.05;与CMS 组比较△P<0.05。
组 别正常组癫疒间组CMS 组癫疒间+CMS 组5-HT1A Ct 值19.11±0.31 21.66±0.78 20.14±0.56 22.18±0.68内参Ct 值16.67±0.45 17.57±0.15 15.32±0.78 16.55±0.56△△Ct 值1.23±0.03 4.29±0.89 3.56±0.57 4.75±0.79 2-△△Ct 1.12±0.87 0.08±0.03*0.13±0.08*0.05±0.02*△
图1 各造模大鼠5-HT1A 受体基因荧光变化曲线图
3 讨论
我国癫疒间的患病率在3.6‰~7.0‰[5],EWD 的发生率为23.1%,明显高于普通人群的抑郁发生率,且抑郁的终身患病率达到13%[6]。由此可见,癫疒间与抑郁共病现象非常普遍。
单纯针对癫疒间或者抑郁的科学研究非常多,动物模型的制备亦比较成熟。 如氯化锂-匹罗卡品诱导的癫疒间模型已被广泛用于动物科研, 因为锂-匹罗卡品诱导的癫疒间发作形式很接近人类慢性颞叶癫疒间特征,可反复出现癫疒间自发性发作, 与人类抑郁症中慢性、低水平的应激源促进抑郁症的发生及发展的机制更为接近[7];抑郁模型的制备方法则有很多,包括CMS 模型、孤养或分养模型、获得性无助和行为绝望、社会挫败模型、大鼠嗅球切除等[8]。其中CMS 模型是目前最为公认的经典模型之一,广泛应用于内源性抑郁障碍的病理生理机制和药物作用机制研究。然而,目前国内外文献对于WED 的研究则报导甚少。
在我们的前期研究中,首先利用锂-匹罗卡品制备癫疒间大鼠模型, 随后在此基础之上通过行为学检测进行抑郁筛选, 挑选出EWD 大鼠用于下一步研究,成功率低,费用高,效果不理想。 由此引发我们尝试制备EWD 大鼠模型的思考。 理想的EWD 大鼠模型要求既能兼顾EWD 的神经生物学机制,又能体现抑郁的核心临床症状,这是深入研究EWD 发生机制的前提和关键。该模型强调与人类EWD 存在以下相似点:(1)临床核心症状相似,包括持续体现兴趣减退和快感低下、 活动性明显减少等抑郁最基本核心临床症状学特征;(2)抗抑郁药效应。 EWD 的症状更接近原发性抑郁[9],如我们前期使用匹罗卡品癫疒间造模1月后有一部分大鼠出现运动能力下降, 兴趣丧失,快感缺乏,侵犯攻击能力下降的情况。 成熟的原发性抑郁模型制备方法能完全复制EWD 的抑郁症状,并为其模型建立提供相对确切的病因复制方法。EWD 模型亦应具备病理生理学效度,即体现疾病病理生理学特征,包括癫疒间临床基本病理生理特征、癫疒间社会心理应激和/或生物学因素及其他相关危险因素,包括癫疒间后不良生活事件如抽搐,社会支持缺失等应激因素。 研究发现社会应激可加重癫疒间小鼠的被动躲避缺陷, 提示可将实验性癫疒间和应激复合作为处理因素制备EWD 动物模型。
因此该研究将“锂-匹罗卡品”与“CMS”进行联合造模,最终发现癫疒间大鼠伴发抑郁的成功率可达到80%左右,远远高于前期研究中的25%。 在制模后6 周癫疒间组大鼠出现不同程度的癫疒间发作,但抑郁行为学与正常组相比无统计学意义,CMS 组出现兴趣减退,活动性减退等情况,而癫疒间+CMS 组大鼠除出现癫疒间发作外,还出现抑郁行为学变化,即大鼠糖水摄入量明显减少,表现出对食物奖赏刺激的低敏感性,类似于抑郁症患者的快感缺失。 大鼠旷场水平运动评分减少, 反映动物的活动度降低;垂直运动减少, 反映动物对新鲜环境的好奇程度降低,说明癫疒间+CMS 组动物表现出抑郁状态。
中枢单胺类神经递质系统功能紊乱仍是抑郁症生物学发病机制中最重要的假说, 研究显示,EWD 的发生与神经递质缺乏有关,特别是5-HT1A受体[10]。 5-HT1A 受体表达下降,则EWD 发病率上升。 本实验结果显示“锂-匹罗卡品” 联合“CMS”所制备出的EWD 大鼠模型组与正常组比较, 大鼠脑海马区5-HT1A 受体mRNA 水平下降,结合以上行为学上的改变,说明该动物模型能有效的模拟EWD的发病状态,提高造模成功率,大大降低实验费用,是EWD 比较理想的大鼠模型。
[1]彭伟峰,汪 昕.癫疒间与抑郁共病:从临床走向基础[J].世界临床药物,2012,33(1):13-16.
[2]Ping Yang,MeiZhen Sun,Liang Li,et a1. 8-hydroxy-dipropylaminotetralin promotes neural plasticity in epileptic rats with depression [J]. Neural Regeneration Research,2012,7(8):565-571.
[3]Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure [J]. Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[4]Willner P,Moreau JL,Nielsen CK,et al. Decreased hedonic responsiveness following chronic mild stress is not secondary to loss of body weight [J]. Physiol Behav,1996,60(1):129-134.
[5]周 永,刘 民,梁万年.癫疒间流行病学研究进展[J].中华流行病学杂志,2007,28(1):92-94.
[6]Fiest KM,Dykeman J,Patten SB,et al. Depression in epilepsy:A systematic review and meta-analysis [J]. Neurology,2013,80(6):590-599.
[7]onchar MP,Olney JW,Sherman WR. System cholinergic agents induce seizures and brain damage in lithium-treated rats[J].Science,1983,220(4 594):323-325.
[8]陈红霞,张黎明,薛摇瑞,等.大鼠嗅球切除抑郁症动物模型的改进与评价[J].中国药理学通报,2011,27(3):436-439.
[9]Pineda EA,Hensler JG,Sankar R,et al. Plasticity of presynaptic and postsynaptic serotonin 1A receptors in an animal model of epilepsy -associated depression [J]. Neuropsychopharmacology,2011,36(6):1 305-1 316.
[10]Theodore WH,Wiggs EA,Martinez AR,et al. Serotonin 1A receptors,depression,and memory in temporal lobe epilepsy[J].Epilepsia,2012,53(1):129-133.

