大承气汤对不完全性肠梗阻大鼠血清中IL-1和IL-6及回盲部形态学的影响
尹抗抗,闫云云,张文将,梁 媛,赵 梁,卢金冬,谭达全,4,邓冰湘*
(1.湖南中医药大学,湖南 长沙410208;2.湖南中医药大学2012 级硕士研究生,湖南 长沙410208;3.湖南中医药大学2011 级硕士研究生,湖南 长沙410208;4.湖南省中医药研究院,湖南 长沙410006)
肠梗阻是临床最常见的急腹症之一,受阻部位的肠道内容物阻塞于肠管内,造成肠管扩张,出现腹痛、腹胀、停止排气、呕吐等症状,且其诊断复杂、死亡率高,如何早期发现后对其进行有效、安全的治疗引起人们的重视[1]。 在肠梗阻中以不完全性肠梗阻较为易治疗且多见。 治疗不完全性肠梗阻主要目的是在不损伤肠道的基础上使肠道内容物顺利排出。 其中通里攻下法是治疗不完全性肠梗阻等引起的急腹症最常用的治法。 肠梗阻在中医学属于“肠结”的范畴[2]。 中医认为“不通则痛”是肠梗阻的发病机制,应采用通里攻下法进行治疗。 大承气汤是通里攻下法的代表方,临床上常用来治疗不完全性肠梗阻。 本实验用手术方法来造成大鼠不完全性肠梗阻模型,探讨不同剂量的大承气汤对不完全性肠梗阻大鼠模型血清中IL-1、IL-6 含量的影响。
1 材料与方法
1.1 材料
1.1.1 动物 健康SD 大鼠60 只,雌雄各半,体质量(225.6±22.3)g,均购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2011-0003。
1.1.2 试药 大承气汤组成: 酒大黄12 g, 厚朴24 g,枳实12 g,芒硝9 g,购自湖南中医药大学第一附属医院药剂科,先煎枳实、厚朴约25 min,再纳入大黄煎煮10 min,去渣,然后加入溶化芒硝[3]。
1.1.3 主要仪器 DNM-9602 酶标仪(北京普朗新技术有限公司);电子分析天平(梅特勒—托利多仪器有限公司);TDZ4-WS 低速自动平衡离心机(湘仪离心机仪器有限公司);切片机(美国 AO820 型)、显微镜(麦克奥迪公司生产)。
1.1.4 主要试剂 酶联免疫法(ELISA)试剂盒:由Bio-Swamp Life Science 试剂公司提供。
1.2 方法
1.2.1 动物分组 动物适应性饲养7 d, 实验时将60 只实验大鼠按随机数字表法分为6 组:空白对照组,模型对照组,假手术组,大承气汤高、中、低剂量组(以下简称高、中、低剂量组),每组10 只。
1.2.2 造模 将大鼠用10%水合氯醛(300 mg/kg)麻醉,备皮后碘伏消毒,酒精脱碘后于腹中线下1/3处开腹,暴露回盲部,用直径为3.2 mm 的中心静脉管与回肠肠管并排放置, 在距回盲部1 cm 处用圆针和丝线穿透肠系膜绕过肠管和中心静脉导管一并结扎,最后抽出中心静脉导管,造成不完全性肠梗阻,然后将腹壁逐层缝合[3]。 术后常规喂养,整个手法要轻柔以减轻对肠管的刺激,手术过程严格遵循无菌操作原则,术后继续常规喂养。 假手术组方法相同,只用针线穿透肠系膜而不结扎,空白对照组不做任何处理。
1.2.3 灌胃方法 各组均在手术造模前0.5 h 及造模后连续给药3 d,每天上午9 点开始进行灌胃。大承气汤高、中、低剂量组,根据人与大鼠的体表面积进行换算, 三种剂量呈等比数列4∶2∶1, 分别给予11.6、5.8、2.9g/(kg·d),空白对照组、假手术组、模型对照组给予相同剂量的生理盐水[4]。 术后要注意大鼠的保暖和伤口护理,伤口在每次灌胃后用碘伏进行消毒,并保持笼内垫料的干爽舒适,避免引起伤口感染。 实验中模型对照组、高剂量组、中剂量组各有一只大鼠死亡,可能是手术操作不当导致死亡。
1.3 检测指标
1.3.1 标本的采集和保存 造模后72 h 由腹主动脉取血置入真空采血管中,3 000 r/min 离心10 min,取血清置于-20 ℃冰箱保存。
1.3.2 血清中IL-1、IL-6 含量测定 采用ELISA方法检测血清中IL-1、IL-6 含量, 酶标仪读出的标准品以及样本的OD 值, 利用标准品的OD 值及其相对应的浓度,以OD 值为横坐标,浓度为纵坐标,绘制标准曲线,拟合回归方程,根据样本测得的OD值计算出浓度。
1.3.3 回盲部组织形态学评价 处死大鼠后即刻剪取回盲部组织,用生理盐水轻柔冲洗肠腔内容物后,无菌滤纸吸干水分,肉眼观察回盲部后立即浸泡于10%甲醛中,固定24 h 后石蜡包埋。 切片后按常规苏木精-伊红染色法(HE)染色。 观察其形态学改变,并参照Axaki Y[5]及Yulpinar MA[6]结肠损伤综合得出评分标准,观察各组的黏膜损伤、隐窝破坏、黏膜水肿、间质水肿、炎性细胞浸润损伤。 若无损伤得分为0,轻度损伤得分为1,中度损伤得分为2,重度损伤得分为3,将该组中不同观察组织损伤得分相加,得出综合损伤分数,即为该组的损伤得分。
1.4 统计学分析
应用SPSS 17.0 统计学软件进行分析, 实验结果所有数据均采用“±s”表示,多组间均数比较用单因素方差分析, 组间两两比较方差齐者用LSD 检验,方差不齐者用Dunnett’s T3 检验,非正态分布资料改用秩和检验, 以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血清中IL-1、IL-6 含量比较
与空白对照组比较, 模型对照组血清中IL-1、IL-6 含量显著升高,差异有统计学意义(P<0.01),说明造模成功;经药物干预后,各组血清中IL-1、IL-6含量不同程度下调,与模型对照组比较,差异均有统计学意义(P<0.01),以高剂量组最为显著,其次分别为中剂量组和低剂量组,说明具有一定的量效关系。 结果见表1。
2.2 各组大鼠回盲部肠黏膜形态直观变化
模型对照组大鼠回盲部肠腔扩张、充血、瘀血,蠕动减慢甚至消失,颜色变暗,肠壁偶有炎性黏液,证明回盲部损伤较为严重。 空白对照组和假手术组肉眼观察无明显变化。 各给药组损伤程度渐轻,大承气汤高、中剂量组与模型对照组比较,回盲部黏膜形态无明显变化。
2.3 各组大鼠回盲部肠黏膜的显微观察比较
HE 染色后发现空白对照组和假手术组回盲部结构无明显变化,黏膜结构正常。 模型对照组回盲部黏膜有大量渗出,上皮细胞肿胀,细胞界限不清,间质明显水肿,大量炎性细胞浸润偶有上皮细胞坏死、脱落。 大承气汤高、中、低剂量组与模型对照组比较,回盲部上皮细胞肿胀减轻,炎细胞浸润明显减少,无明显水肿、渗出,未发现上皮细胞坏死、脱落。其中高剂量组大鼠回盲部黏膜损伤最轻,如图1所示(见封三彩图)。
2.4 各组大鼠回盲部黏膜损伤程度评分比较
在显微镜下,对肠损伤进行观察,依据“1.3.3”的评分方法, 对各组回盲部黏膜损伤进行评分,计算各组均数及标准差。 结果显示:空白对照组、假手术组回盲部组织黏膜评分均为0 分;模型对照组回盲部黏膜损伤评分(12.01±1.21),而各药物组均有不同程度改善回盲部黏膜损伤的作用,与模型对照组比较,差异有显著统计学意义(P<0.01),以低剂量组最为明显,其次为中剂量组和高剂量组。 结果见表1。
表1 各组大鼠血清中IL-1、IL-6 水平及回盲部黏膜损伤程度比较 (±s)
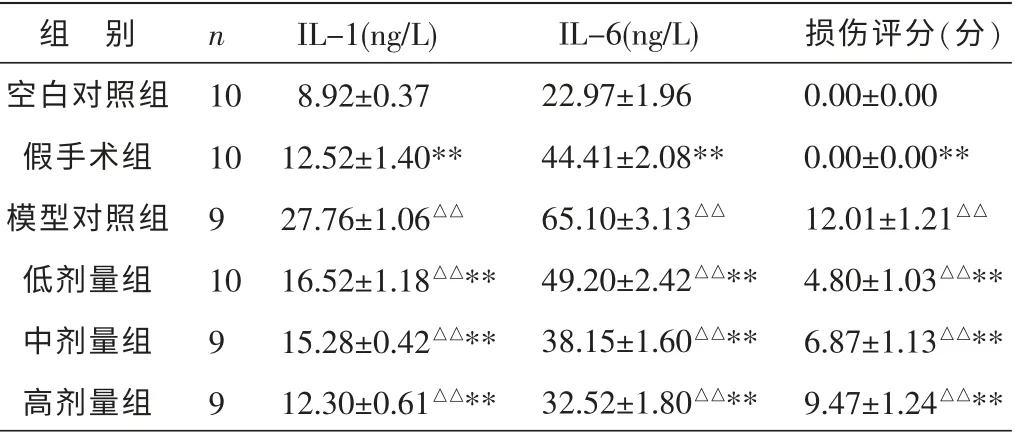
表1 各组大鼠血清中IL-1、IL-6 水平及回盲部黏膜损伤程度比较 (±s)
注:与空白对照组比较△△P<0.01;与模型对照组比较**P<0.01。
组 别空白对照组假手术组模型对照组低剂量组中剂量组高剂量组n 10 10 9 10 9 9 IL-1(ng/L)8.92±0.37 12.52±1.40**27.76±1.06△△16.52±1.18△△**15.28±0.42△△**12.30±0.61△△**IL-6(ng/L)22.97±1.96 44.41±2.08**65.10±3.13△△49.20±2.42△△**38.15±1.60△△**32.52±1.80△△**损伤评分(分)0.00±0.00 0.00±0.00**12.01±1.21△△4.80±1.03△△**6.87±1.13△△**9.47±1.24△△**
3 讨论
多项研究已经证明,在创伤及感染等应激情况下,肠黏膜屏障功能受到了削弱或损害,易致不完全性肠梗阻的发生,使肠道细菌、毒素迅速增加,并激发各种细胞因子和炎性介质的增多,形成瀑布样效应,引起严重的细胞损伤,最终可导致全身各器官的损害进而多器官功能衰竭而死亡[7]。 机体对各种外来损伤具有一定的抵抗力,其防御系统主要包括巨噬细胞及其产生的细胞因子,如IL-1、IL-6 等,当各种因子过度释放时,会导致细胞因子平衡被打破,引起全身的炎性损伤,过度的炎性损伤会导致休克、免疫抑制、凝血障碍等严重的反应甚至会危及生命。
IL-1 是炎症因子之一, 促进机体各种炎症因子的分泌,会导致微循环障碍;是一种致热原,大量产生会引起内分泌紊乱, 使体温升高引发发热和恶病质。IL-6 可诱导急性期炎性反应的产生,促进多种免疫细胞的分化和活化,血清或血浆中IL-6 的浓度可敏感地反映出组织损伤的程度[8]。 其主要特征是诱导急性蛋白反应,能够使机体发热、白细胞增多、血管通透性增加,使原有症状加重,全身反应更加明显,从而形成恶性循环[9]。 在不完全性肠梗阻中导致损伤作用的机制可能为:IL-1、IL-6 可引起血管过度扩张、血流瘀滞,导致组织器官低灌流;IL-1、IL-6 对组织器官有直接毒性作用, 可以灭活与能量代谢或抗氧化有关的酶,还可以直接损伤DNA,导致能量衰竭和细胞死亡。 IL-1、IL-6 可引起肠通透性增高,导致细菌移位和内毒素血症[10]。不完全性肠梗阻形成后各种有毒物质在体内堆积、 共同作用会导致胃肠黏膜屏障破坏,细菌、内毒素进入血液形成肠源性感染。内毒素引起体内IL-1、IL-6 等因子的分泌增加,导致内环境失衡更加严重,进一步加重肠道黏膜的破坏,产生各种炎症反应和发热反应。
本实验中模型对照组血清IL-1、IL-6 含量明显高于空白对照组和中、高剂量组(P<0.01),提示模型对照组刺激IL-1、IL-6 的释放大幅度增加, 大承气汤抑制体内IL-1、IL-6 的释放, 降低血清中IL-1、IL-6 含量,减轻其引起的器官毒性反应、肠管扩张、发热、凝血障碍等症状;减少血清中IL-1、IL-6 含量增加引起各种炎症细胞因子的产生、释放和肠源性炎性介质的吸收。 大承气汤高剂量组与中、低剂量组比较血清中IL-1、IL-6 含量均有明显降低 (P<0.01), 其高剂量组对减少血清中IL-1、IL-6 含量的作用明显优于中、低剂量组,达到减轻各种症状的治疗目的。 以上对比实验研究证明,临床上采用大承气汤治疗不完全性肠梗阻有非常好的应用前景,且大承气汤浓度对不完全性肠梗阻的治疗具有较大的影响作用,临床使用时应充分考虑到大承气汤的浓度,以达到其最佳疗效。
[1]徐文华.大承气汤直肠滴入治疗肠梗阻的疗效观察及护理[J].中国民族民间医药,2012,21(23):46.
[2]管小猛.肠梗阻诊断及中西医结合治疗进展[J].工企医刊,2007,20(3):55.
[3]谢明征,胡志祥,齐清会.大承气汤对MODS 大鼠小肠肌层的保护作用[J].中国中西医结合外科杂志,2012,8(18):366.
[4]闫 瑾.大承气汤颗粒对大鼠不完全肠梗阻小肠上皮细胞保护作用的研究[D].天津:天津医科大学,2005.
[5]Arak1Y, AndohA, TakizawaJ, et al. Clostridium butyricum,a probiotic derivative suppresses dextran sulfate sodium-induced experimental colitis in rats [J]. Int J Mol Med,2004,13(4):577-580.
[6]Gulpinar MA, Ozbeyli D, Arbak S, et al. Acute stress ameliorates colitis via central corticotropin-releasing factor and serotonin(5-HT)-3 receptors [J].Turk J Med Sci,2005,22(35):3-19.
[7]Deitch EA. Multiple.organ failurepathophysiology and potential future therapy [J]. Ann Sury,1992(216):217.
[8]Pape HC,Griensven M,Rice J, et al. Major sencondary surgery in blunt trauma patients an perioperative Cytokine liberation:determination of the clinicalrelevance of biochemical markers[J]. J Truama,2001,50(6):989.
[9]孙运萍. 大承气汤对重症急性胰腺炎细胞因子TNF-a、IL-6、IL-8、PAF 的影响[J].实用中西医结合临床,2009,9(1):3.
[10]冯立民,陈海龙,关凤林. 阳明腑实证时内毒素与炎症介质的变化及复方大承气汤的治疗作用[J]. 中国中西医结合外科杂志,2003,10(9):353.

