PRL-3与E-cad在非小细胞肺癌中的表达及临床意义
隋小芳,朱英丽,范巧菊,王凤玲
(佳木斯大学附属第一医院 老年病科,黑龙江 佳木斯 154003)
浸润转移是肺癌导致患者死亡的重要因素,PRL-3为酪氨酸蛋白磷酸酶,与多种恶性肿瘤如直肠癌[1]、胃癌[2]等的发生发展有明显的相关性,它能够影响肿瘤细胞的增殖、浸润及转移等,是近年来研究的热点之一。E-cad是细胞黏附分子家族中钙黏蛋白的一种亚型,在肿瘤的浸润转移中起到重要作用[3]。本实验通过利用SP 法检测50例手术切除的非小细胞肺癌(non-small cell lung cancer,NSCLC)标本及15例距癌旁5cm 的正常肺组织中PRL-3及E-cad的表达情况,来探讨上述二者与NSCLC临床分期、病理分级及淋巴结转移的相关性。
1 材料与方法
1.1 病例选择
收集2009-01~2010-12佳木斯大学附属第一医院病理科保存的NSCLC标本50例为实验组及15例距癌旁5cm的正常肺组织为对照组,标本均经福尔马林固定、石蜡包埋处理。按组织类型分有鳞状细胞癌29例,腺癌21例;病理分级中Ⅰ+Ⅱ级27例,Ⅲ级23例。有淋巴结转移28例,无转移22例;PTNM 的临床分期中Ⅰ+Ⅱ期24例,Ⅲ+Ⅳ期26例。
1.2 方法
1.2.1 主要试剂及检测方法
鼠抗人PRL-3 多克隆抗体(sc-130355)购自Santa Cruz公司;鼠抗人E-Cadherin单克隆抗体、S-P免疫组化广谱试剂盒(通用),DAB 显色剂等均来自福州迈新生物技术有限公司。应用SP方法分别检测PRL-3与E-cad在NSCLC中的表达情况。试验步骤根据S-P 试剂盒说明书进行,用癌旁正常组织作为阳性对照,用PBS作为一抗做阴性对照。
1.2.2 结果判断
PRL-3的染色结果根据孔梅[4]等人的评判标准,在肿瘤细胞胞浆内及胞膜上出现棕黄色颗粒为阳性表达,着色强度分为:无色(-)、浅黄色(+)、黄色及更深颜色(++),分别记为0分、1分、2分。阳性细胞数分级为:≤50%为0分、51%~75%为1分、>75%为2 分。两项得分相乘结果≥2分为阳性病例,余为阴性病例。
E-cad 染色结果根据熊家安[5]等人的评判标准,正常细胞中的E-cad主要定位于细胞膜,免疫组化染色示连续性分布的棕黄色颗粒状为阳性细胞,细胞膜不着色或单纯胞浆着色为阴性,切片中染色癌细胞≤25%为(+),26%~75%为(++),≥76%为(+++)。其中(++~+++)为高表达,(-~+)为低表达或异常表达。
1.3 统计学方法
采用SPSS17.0统计软件进行统计分析。采用χ2检验对计数资料作比较分析,相关分析采用Spearman相关分析,以α=0.05作为显著性检验水准。
2 结果
2.1 PRL-3及E-cad的表达
50例NSCLC 的免疫组化染色结果中,PRL-3阳性表达者为35例,阳性表达率为70.0%,而在15例的癌旁正常肺组织中无PRL-3 的阳性表达,两组间差异显著,(P<0.01)。50例NSCLC 中E-cad有31例 出 现 低 表 达(62%)、19例高表达,高表达率仅为38.0%;而在15例癌旁正常肺组织中E-cad 为100%高表达,两组间差异显著(P<0.01)。
2.2 PRL-3及E-cad与NSCLC临床病理特征
鳞癌中PRL-3 阳性表达有21例(72.4%),腺癌中PRL-3阳性表达有14例(66.7%),两组间差异不显著(P=0.66)。在Ⅰ+Ⅱ级NSCLC中PRL-3的阳性表达者有18例,表达率为66.7%,在Ⅲ级NSCLC 中PRL-3的阳性表达者有17例,表达率为73.9%,两组间差异不显著(P=0.058)。TNM 分期中在Ⅰ+Ⅱ期中PRL-3有13例高表达,表达率为54.2%,Ⅲ+Ⅳ期中有22例高表达,表达率为84.6%,两组间的阳性表达有明显的差异性(P<0.05)。PRL-3在有淋巴结转移组中有23例呈高表达,表达率为82.1%,无淋巴结转移组中有12例高表达,表达率为54.5%,两组间差异显著(P<0.05)。
E-cad与NSCLC在鳞癌和腺癌中低表达为65.5%和57.1%,两种组织学类型间差异不显著(P>0.05)。在Ⅰ~Ⅱ级中低表达率为44.4%,在Ⅲ级中低表达率为82.6%,两组间差异显著(P<0.01)。在Ⅰ+Ⅱ期中低表达率为41.7%,在Ⅲ+Ⅳ期中低表达为80.8%,两组间差异显著(P<0.01)。在有淋巴结转移中的低表达为78.6%,在无淋巴结转移中的低表达为40.9%,两组间差异有显著性,P<0.01。见表1,图1~4。
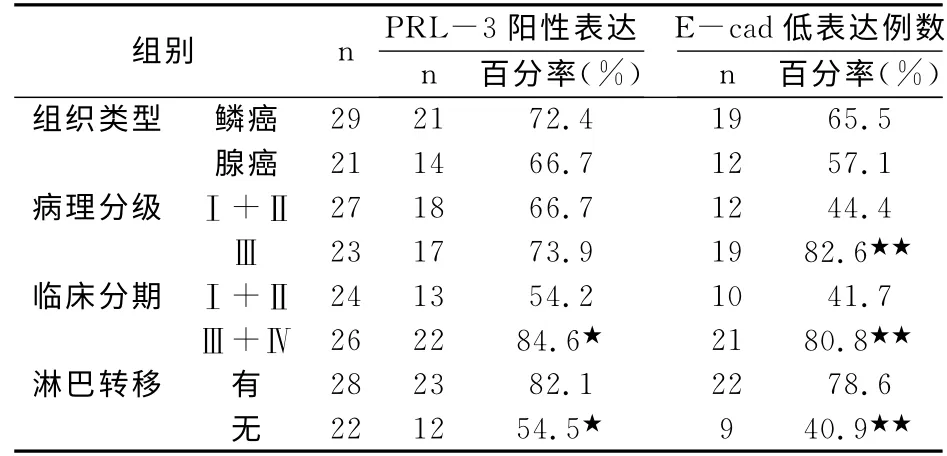
表1 PRL-3与E-cad的表达与临床病理特征的关系
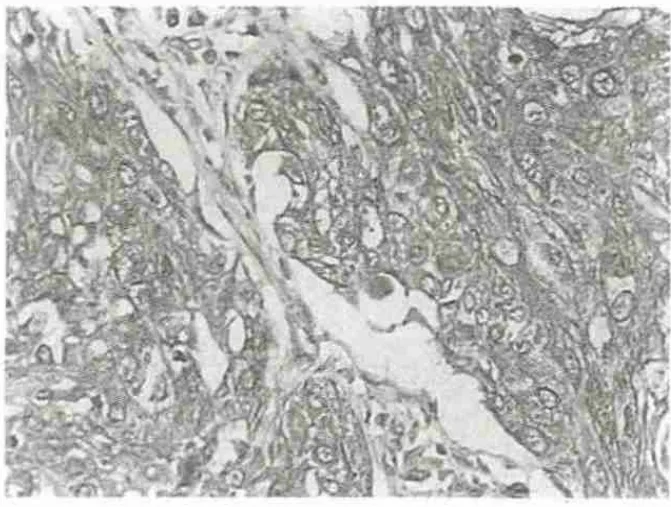
图1 PRL-3在鳞癌中的表达(×200)
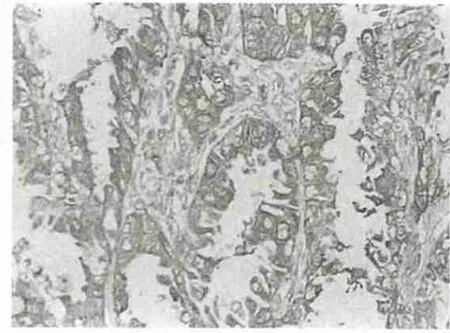
图2 PRL-3在腺癌中的表达(×200)
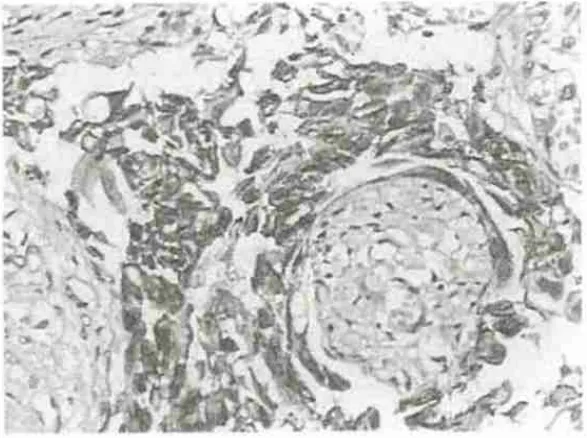
图3 E-cad在腺癌中的表达(×200)
图4 E-cad在鳞癌中的表达(×200)
2.3 PRL-3与E-cad之间的相互关系
在50例NSCLC中PRL-3阳性表达而E-cad低表达者27例,经Spearman相关分析表明,PRL-3与E-cad呈负相关关系(χ2=11.36,P<0.01,相关系数r=-0.48)。见表2。
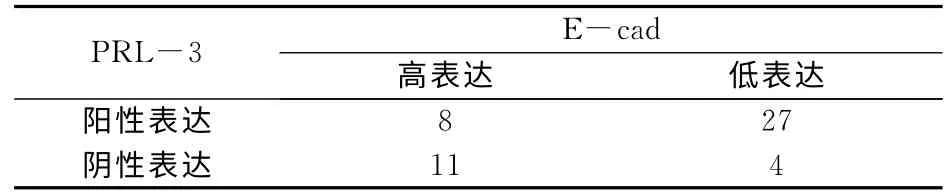
表2 PRL-3与E-cad表达之间的关系
3 讨论
PRL-3基因定位于人类第8号染色体q24.3上,许多试验表明,PRL-3对细胞的增殖分化以及肿瘤细胞的浸润转移有显著的相关性。有学者研究发现,转染了PRL-3基因后的B16细胞增殖数比对照组明显升高,且细胞由上皮型转变为纤维状,其细胞构型发生了改变[6]。张平[7]等人在研究PRL-3的表达与非小细胞肺癌的淋巴结转移相关性时就发现有淋巴结转移组表达率明显高于无转移组,说明PRL-3的过表达对肿瘤的浸润转移是有影响的。我们的试验分别从非小细胞肺癌的组织类型,病理分级,临床分期及淋巴结转移情况来分析PRL-3的表达情况,发现PRL-3的表达在不同的组织类型、病理分级中无显著差异性,但PRL-3的表达随着临床分期的增高以及出现淋巴结转移而明显增高,出现这样的现象提示PRL-3可能对NSCLC 的浸润转移有促进作用。
E-cadherin基因为钙黏蛋白中的一种亚型,与E-cad结合的连环蛋白中尤以β-catenin最为重要,它们共同形成E-cad/cat复合体,主要介导组织之间的相互黏附作用,约束细胞的迁移能力,保持组织细胞的结构完整性。有研究显示,在肺癌中E-cad的表达明显降低,其低表达与肿瘤的临床分期及淋巴结转移情况相关联[9]。通过我们的研究发现,E-cad的表达与NSCLC的病理分级,临床分期及淋巴结转移有关,而与肿瘤的组织分型不相关,说明E-cad的低表达或异常表达与肿瘤的发生发展是密切相关的。
在本次试验中,PRL-3在非小细胞肺癌中的阳性表达率达70.0%,而E-cad的低表达率为62.0%,通过我们的分析显示两者为负相关。有实验研究表明,过表达的PRL-3一方面能够使得肿瘤细胞增殖,另一方面能够诱导E-cad的表达下调。对于PRL-3 下调E-cad的作用机制,有人认为Snail转录抑制因子在此过程中起到重要的作用,过表达的PRL-3能使Snail转录抑制因子表达增多,而表达增多的Snail与E-cadherin基因启动子结合直接抑制E-cad的转录,使得E-cad的表达下调[10]。E-cad在肿瘤细胞中的低表达或异常表达,破坏了E-cad/cat复合体的结构完整性,使得组织细胞的黏附功能遭到破坏,最终导致肿瘤细胞的浸润转移,因此我们分析PRL-3与E-cad在肿瘤的生物学特性中具有相当重要的作用。联合检测两者在非小细胞肺癌中的表达情况具有重要的临床指导意义,为肺癌的治疗及预后判断提供相应的依据。
[1]Peng L,Ning J,Meng L,et al.The association of the expression level of protein tyrosine phosphatase PRL-3protein with liver metastasis and prognosis of patients with colorectal cancer[J].J Cancer Res Clin Oncol,2004,130(9):521-526
[2]Li Z,Zhan W,Wang Z,et al.Inhibition of PRL-3gene expression in gastric cancer cell line SGC7901via microRNA suppressed reduces peritoneal metastasis[J].Biochem Biophys Res Commun,2006,348(1):229-237
[3]Fatih C,Semra C,Christiaan K,et al.Disruption of tumor cell adhesion promotes angiogenic switch and progression to micrometastasis in RAF-Driven Murine Lung Cancer[J].Cancer Cell,2007,8(12):145-159
[4]孔梅,王莺,林宇静,等.PRL-3在癌症淋巴结转移中的表达及临床意义[J].中华全科医学,2010,8(12):1505-1506
[5]熊家安,熊敏,李智,等.上皮钙黏附分子在乳腺浸润性小叶癌和子宫癌中的表达[J].中华病理学杂志,2001,30(1):27-29
[6]Wu X,Zeng H,Zhang X,et al.Phosphatase of regenerating liver-3promotes motility and metastasis of mouse melanoma cells[J].Am J Pathol,2004,164(6):2039-2054
[7]张平,张志培,李香敏,等.非小细胞肺癌中PRL-3与RhoC 的表达及相关性意义[J].中国肺癌杂志,2010,13(6):598-601
[8]Berx G,Staes K,Van Hengel J,et al.Cloning and characterization of the humen in vasion supperssor gene E-cadherin(CAH1)[J].Genomics,1995,26(2):281-289
[9]Kase S,Sugio K,Yamazaki K,et al.Expression of E-cadherin and beta-catenin in human non-small cell lung cancer and the clinical significance[J].Clin Cancer Res,2000,6(12)∶4789-4796
[10]Yokoyama K,Kamata N,Hayashi E,et al.Reverse correlation of E-cadherin and snail expression in oral squamous cell carcinoma cells in vitro[J].Oral Oncol,2001,37:65-71

