扩散峰度成像在正常成人脑组织中的应用价值
郑慧鑫,张 辉,王效春,谭 艳,秦江波,张锁旺,张 磊,王 乐,吴晓峰
(1山西省中医院放射科,太原 030012;2山西医科大学第一临床医学院影像科;*通讯作者,E-mail:zhanghui-mr@163.com)
随着年龄的增长,脑组织结构会发生一些变化。然而在正常人老化过程中,脑内结构的变化与年龄的具体关系尚未清楚。扩散张量成像(diffusion tensor imaging,DTI)技术是假定水分子呈高斯分布情况下,反映成像体素内水分子扩散的变化,可以定量检测不同脑白质微观结构的变化。而扩散峰度成像(diffusion kurtosis imaging,DKI)是扩散成像的新技术,是反映非高斯水扩散特性的方法。本研究的目的是对健康成人脑组织进行DKI扫描,对其得到的平均峰值(mean kurtosis,MK)及部分各向异性值(fractional anisotropy,FA)值进行比较,从而探索它们之间差异。
1 资料与方法
1.1 一般资料
收集山西医科大学第一临床医学院正常成人76名,年龄20-81岁,平均(50.2±18.5)岁,男34名,女42名。所有患者均无神经系统症状及异常影像。按年龄分为3组:20-39岁为青年组(n=25);40-59岁为中年组(n=24);60岁及以上为老年组(n=27)。
1.2 检查方法
采用GE3.0T超导型磁共振成像仪。常规MR检查包括 T1WI轴位和矢状位、T2WI轴位以及T2WI-FLAIR轴位扫描。DKI采用平面回波(EPI)序列,扫描参数:TR:6 500 ms,TE:115 ms,FOV=24 cm,层厚:6.0 mm,30个扩散敏感梯度场,b值分别为 0,1 000 s/mm2,2 000 s/mm2。
1.3 数据处理
将图像传输至GE Advantage Workstation4.4工作站,应用Functool软件进行后处理,得到平均峰度(MK)、各向异性分数(FA)图像,分别于半卵圆中心、内囊前肢、内囊后肢,胼胝体膝部、胼胝体压部、丘脑、豆状核、尾状核头、额叶、顶叶、颞叶测量每个感兴趣区(ROI)的MK值与FA值。
1.4 统计学分析
应用SPSS15.0统计学软件包进行处理。各部位MK值与FA值均以±s进行表述;用单因素方差分析评价各部位脑组织不同年龄阶段MK值及FA值的差异,并使用LSD法进行两两比较。P<0.05认为差异有统计学意义。
2 结果
半卵圆中心、内囊后肢,胼胝体膝部、胼胝体压部、额叶、顶叶、颞叶、尾状核头的MK值及半卵圆中心、胼胝体膝部、内囊后肢、顶叶的FA值各组间差异有统计学意义(P<0.05,见表1,2)。青年组与中年组比较,半卵圆中心、胼胝体膝部、胼胝体压部、内囊后肢、额叶、颞叶、顶叶、尾状核头的MK值及半卵圆中心、胼胝体膝部、内囊前肢、内囊后肢、额叶、顶叶的FA值组间差异有统计学意义(P<0.05),青年组>中年组。青年组与老年组比较,各部位MK值及FA值组间差异均有统计学意义。中年组与老年组比较,各部位的MK值组间差异均有统计学意义,而在内囊前肢及额叶的FA值组间差异无统计学意义。
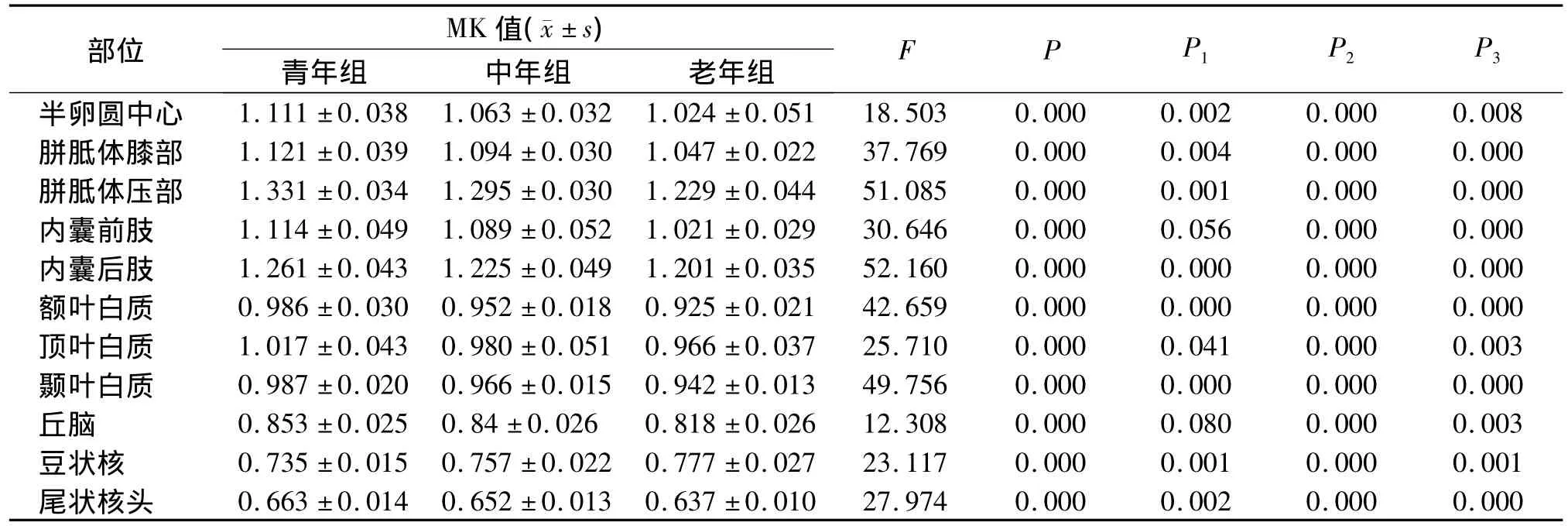
表1 各年龄组间正常成人脑不同部位MK值比较Table 1 Comparison of MK value of different regions of the brain among 76 normal subjects with different age groups
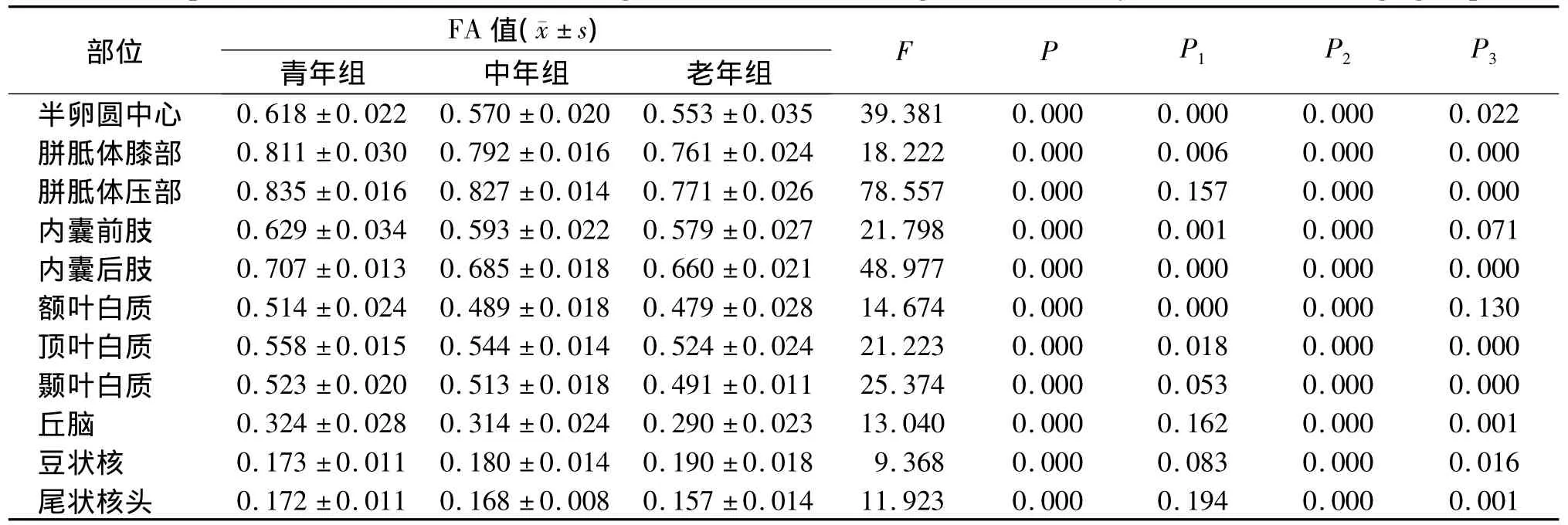
表2 各年龄组间正常成人脑不同部位FA值比较Table 2 Comparison of FA value of different regions of the brain among 76 normal subjects with different age groups
3 讨论
人类的大脑在发育和老化过程中,其结构和形态在变化,在青春期和成年初期白质体积在增大,而后随老化而减小[1]。有报道表明7-60岁年龄段,灰质的密度呈非线性下降,其下降速率因不同部位而定[2]。年龄相关性DTI指标的变化已经被广泛报道[3],随着时间的推移FA在白质束改变,符合上述组织微观结构的改变[4]。
DTI技术是表征水分子的运动假定在单室模型内,以自由、非受限的形式进行扩散,水分子扩散位移呈高斯分布。其中FA作为体素内一致性的测定指标,反映显微结构的完整性,也是各向异性的指标。但是,生物组织结构复杂,水分子的运动因细胞内外结构、游离与结合水的物理化学特性等差异而表现复杂,表征生物组织内的水分子扩散应基于多室模型,其扩散位移呈非高斯分布[5]。扩散峰度成像是新近出现的用来探查非高斯分布的水分子扩散特性的方法。可以量化真实水分子扩散与理想的高斯分布扩散的位移偏离大小,表征水分子扩散受限程度和扩散的不均质性,其MK是一个反映扩散受限程度的无量纲参数,更加敏感探测组织微观结构的改变,因此可能是疾病早期的标记,例如在灰白质年龄相关性变化[6]、注意力缺陷多动症[7]、多发硬化[8]、脑中风[9]、帕金森病[10]、精神分裂症[11]、脑胶质瘤级别判定[12]等方面均取得了一些初步结果,具有明显的临床应用前景。
随着年龄的增长,整个人脑组织会发生退化性改变。就不同部位的脑组织而言,退化程度不同。对于DTI在脑组织老化的研究已有广泛报道,如国外研究表明,FA值与年龄呈负相关,FA值随年龄增长明显下降[13]。关于随着年龄变化的幅度,据报道FA值下降的速率大约10年3%[14]。本研究结果表明,半卵圆中心、胼胝体膝部、内囊后肢、顶叶的FA值在不同年龄间差异有统计学意义(P<0.05),青年组>中年组>老年组。内囊前肢、胼胝体压部、丘脑、豆状核、尾状核头、额叶、颞叶部分组间FA值差异有统计学意义,这与以往的研究基本一致,表明随年龄增长FA值下降。
DKI是水扩散研究的新技术,目前国内外对DKI在正常人脑组织的研究报道较少。有文献[6]报道,关于年龄和MK相关性在直方图的分析;从青年人到老年人所有白质和灰质的峰值减少。Nilsson[15]等对健康成人大脑的正常老化过程定量测定研究发现,随年龄增长,胼胝体膝部、半卵圆中心、额叶白质、丘脑等MK值明显下降。本组研究表明,半卵圆中心、内囊后肢,胼胝体膝部、胼胝体压部、额叶、顶叶、颞叶、尾状核头的MK值各组间差异有统计学意义(P<0.05),青年组>中年组>老年组。内囊前肢、丘脑部分组间MK值差异有统计学意义,这与Nilsson研究结果基本相符。
本研究结果表明在青年组与中年组的胼胝体压部、颞叶、尾状核头及中年组与老年组的额叶、内囊前肢的MK值组间差异均有统计学意义,而FA值组间差异无统计学意义。说明DKI观察水分子在灰质内相对各向同性的扩散、脑白质内交叉和发散神经纤维的扩散优于当前DTI技术,另外与DTI相比,对图像处理过程中混杂效应的干扰不敏感,例如:脑室周围灰质的MK受脑脊液的影响小于FA。如在帕金森病的初步研究中[16]发现,患者基底节各主要核团(尾状核、壳核、苍白球)以及黑质的MK值明显高于正常对照组,患者黑质的FA值显著高于正常对照组,其他基底节核团的FA值在两组间没有显著差异。在胶质瘤研究中,Raab等[17]首先采用DKI技术研究34例胶质瘤(WHO 2级星形细胞瘤5例,WHO 3级星形细胞瘤13例,WHO 4级胶质母细胞瘤16例),发现在WHO 2级与WHO 3级星形细胞瘤之间以及WHO 3级星形细胞瘤与胶质母细胞瘤之间,其MK值的差异均有统计学意义,而FA值不能区分三组胶质瘤。因此与FA值比较,MK值更敏感,是水扩散研究从高斯水进入非高斯水领域,能够更加真实反应脑组织微观结构的变化。
总之,随着DKI被逐步用于临床研究,其价值有待于进一步发现、证实和完善,使其能够更加准确、真实地显示脑组织水分子的扩散运动,从而更好地反映出脑组织灰质与白质微观结构的改变[18],为脑组织病变的早期诊断、病程检测、评估疗效及预后提供重要依据。
[1]Lebel C,Walker L,Leemans A,etal.Microstructural maturation of the human brain from childhood to adulthood[J].Neuroimage,2008,40(3):1044-1055.
[2]Sowell ER,Thompson PM,Toga AW.Mapping changes in the human cortex throughout the span of life[J].Neuroscientist,2004,10(4):372-392.
[3]Camara E,Bodammer N,Rodriguez-Fornells A,etal.Age-related water diffusion changes in human brain:a voxelbased approach[J].Neuroimage,2007,34(4):1588-1599.
[4]Lebel C,Gee M,Camicioli R,etal.Diffusion tensor imaging of white matter tract evolution over the lifespan[J].Neuroimage,2011,60(1):340-352.
[5]Wu EX,Cheung MM.MR diffusion kurtosis imaging for neural tissue characterization[J].NMR Biomed,2010,23(7):836-848.
[6]Falangola MF,Jensen JH,Babb JS,etal.Age-related non-Gaussian diffusion patterns in the prefrontal brain[J].J Magn Reson Imaging,2008,28(6):1345-1350.
[7]Helpern JA,Adisetiyo V,Falangola MF,etal.Preliminary evidence of altered gray and white matter microstructural development in the frontal lobe of adolescents with attention-deficit hyperactivity disorder:a diffusional kurtosis imaging study[J].J Magn Reson Imaging,2012,36(2):508.
[8]Yoshida M,Hori M,Yokoyama K,etal.Diffusional kurtosis imaging of normal-appearing white matter in multiple sclerosis:preliminary clinical experience[J].Jpn JRadiol,2013,31(1):50-55.
[9]Hui ES,Fieremans E,Jensen JH,etal.Stroke assessment with diffusional kurtosis imaging[J].Stroke,2012,43(11):2968-2973.
[10]Giannelli M,Toschi N,Passamonti L,etal.Diffusion kurtosis and diffusion-tensor MR imaging in parkinson disease[J].Radiology,2012,265(2):645-646.
[11]Jensen JH,Helpern JA.MRIquantification of non-Gaussian water diffusion by kurtosis analysis[J].NMR Biomed,2010,23(7):698-710.
[12]Van Cauter S,Veraart J,Sijbers J,etal.Gliomas:diffusion kurtosis MR imaging in grading[J].Radiology,2012,263(2):492-501.
[13]SullIvan EV,Adalstcinsson E,Hedehus M,etal.Equivalent disruption of regional white matter microstructure in ageing healthy men and women[J].Neuroreport,2001,12(1):99-104.
[14]Grieve SM,Williams LM,Paul RH,etal.Cognitive aging,executive function,and fractional anisotropy:a diffusion tensor MR imaging study[J].AJNR,2007,28(2):226-235.
[15]Nilsson M,Wirestam R,Stahlberg F,etal.Regional values of diffusional kurtosis estimates in the healthy brain[J].JMagn Reson Imaging,2013,37(3):610-618.
[16]Wang JJ,Lin WY,Lu CS,etal.Parkinson disease:diagnostic utility of diffusion kurtosis imaging[J].Radioligy,2011,26(1):210-217.
[17]Raab P,Hattingen E,Franz K,etal.Cerebral gliomas:diffusional kurtosis imaging analysis of microstructural differences[J].Radiology,2010,254(3):876-881.
[18]Cheung MM,Hui ES,Chan KC,etal.Does diffusion kurtosis imaging lead to better neural tissue characterization?A rodent brain maturation study[J].Neuroimagen,2009,45(2):386-392.

