帕金森病患者血尿酸的改变及其与抑郁、焦虑的相关性
刘 娜
(新疆维吾尔自治区伊犁州奎屯医院神经内科,新疆伊犁,833200)
帕金森病又称震颤麻痹,能严重影响患者的活动能力,是一种中枢神经系统慢性、进行性、退行性疾病[1]。其发病机制尚不十分明确,但目前认为与环境因素、遗传及老龄化密切相关。中国是个老年人口大国,帕金森病患者的数量在不断增多,严重威胁着老年人群的健康。尿酸是人体正常新陈代谢的产物,主要来自于嘌呤核苷酸的代谢。除此之外,血尿酸是一种内源性抗氧化剂,自由基清除剂及铁鳌合剂[2]。近年来有研究发现,血尿酸水平与帕金森的发生、发展密切相关。本研究探讨帕金森病患者血尿酸水平的改变其及与抑郁、焦虑的相关性,现报告如下。
1 资料与方法
1.1 一般资料
分析2011年1月—2014年1月在本院接受治疗的45例帕金森病患者的临床资料,所有患者均明确诊断为原发性帕金森病;患者无合并其他功能性或器质性神经、精神系统疾病;患者无合并自身免疫性疾病;患者无合并恶性肿瘤等终末期疾病;患者无合并严重肝肾功能障碍;患者临床资料完整。将帕金森病患者设为观察组,另选取30例健康体检者设为对照组。2组受试者在性别比例、年龄、体质指数(BMI)、血红蛋白(Hb)、吸烟及饮酒史上比较差异均无统计学意义(P>0.05)。观察组患者血尿酸水平显著低于对照组,差异有统计学意义(t=6.007,P <0.001)。见表1。

表1 2组受试者一般资料的比较
1.2 定义及标准
帕金森病的诊断标准依据《原发性帕金森病的诊断标准(2005年)》[3]。帕金森病的疾病严重程度采用Hoehn Yahr分级(H-Y分级),共为Ⅰ~Ⅴ级,级别越高代表疾病程度越严重[4]。患者的焦虑症状评估采用汉密尔顿焦虑量表(HAMA),该量表评分范围为0~56分,分值越大代表焦虑程度越重[5]。汉密尔顿抑郁量表(HAMD),该量表评分范围为0~78分,分值越大代表抑郁程度越重[6]。
1.3 观察指标
比较2组一般临床资料,包括性别、年龄、体质指数、血红蛋白、血尿酸、吸烟及饮酒史;比较不同H-Y分级患者的血尿酸水平;分析观察组患者血尿酸水平与焦虑、抑郁程度的相关性。
1.4 统计学方法
采用SPSS 19.0软件进行统计分析。计量资料以均数±标准差表示,比较采用t检验。率的比较使用卡方(χ2)检验。相关性分析采用Pearson相关性检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同H-Y分级患者血尿酸水平的比较
随着H-Y分级的增加,观察组患者血尿酸水平呈现下降趋势,差异有统计学意义(F=4.368,P=0.019)。见表 2。
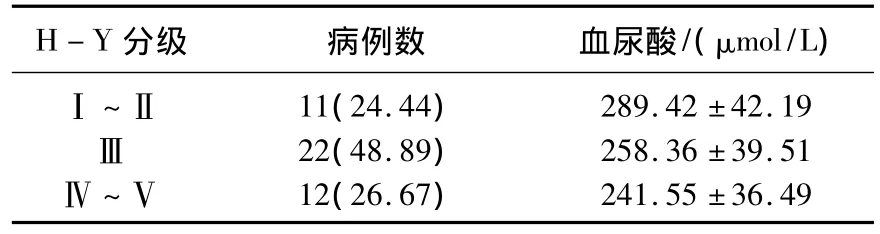
表2 不同H-Y分级患者血尿酸水平的比较
2.2 血尿酸水平与焦虑、抑郁程度的相关性分析
观察组 MAHA 评分为(20.19±4.29),相关性分析显示,观察组患者血尿酸与MAHA呈现显著负相关(r= -0.465,P=0.001);观察组HAMD 评分为(23.41±4.07),相关性分析显示,观察组患者血尿酸与MAHA呈现显著负相关(r= -0.520,P <0.001)。
3 讨论
随着帕金森病患者数量的不断增多,相关研究在不断进步,但该病的具体发病机制尚不十分清楚[7]。目前认为氧化应激与帕金森病的发生与发展有一定关联。多巴胺可在单胺氧化酶系的氧化下产生醌类、过氧化氢及活性氧自由基等一系列活性物质。正常人体具有清除这些自由基的能力,例如生理性存在的谷胱甘肽过氧化氢酶、谷胱甘肽及超氧化物歧化酶等[8-9]。这些物质可以有效清除脑组织中产生的活性自由基。但帕金森病患者脑组织中脂质过氧化水平明显增高,自由基量增加,DNA氧化受损,说明帕金森病患者存在着氧化与抗氧化失衡的内稳态失调[10-11]。过量堆积的自由基可以破坏神经组织,这可能是帕金森病发病中的重要环节。尿酸是机体嘌呤核苷酸的代谢终产物,其经过肝脏的代谢形成尿囊素,大约70%可经由肾脏排出体外[12]。尿酸是机体的天然抗氧化剂,其不仅可以有效清除活性氧、超氧化物等,还可防止超氧化物歧化酶的降解,抑制三价铁所导致的氧化损伤[13]。有研究[14]显示,尿酸可以保护体外培养细胞免受高浓度活性氧所致的细胞凋亡,因而血尿酸水平可以一定程度反映人体氧化与抗氧化间的平衡关系。本研究结果显示,与对照组相比,观察组血尿酸水平显著降低,这与国内外学者观点一致[15-17]。进一步分析血尿酸水平与帕金森病严重程度的关系,发现随着疾病程度的加重,患者血尿酸水平呈现下降趋势。血尿酸水平与焦虑、抑郁程度的相关性分析发现,血尿酸水平与MAHA评分及HAMD评分呈现显著负相关,提示血尿酸还可一定程度反映患者的焦虑与抑郁的情感症状。
综上所述,血尿酸水平在帕金森病患者外周血中下降,且与疾病严重程度反向平行,与焦虑及抑郁症状呈现负相关。血尿酸有望成为评估帕金森病患者情感症状的血液学指标。
[1]Zhang H N,Guo J F,He D,et al.Lower serum UA levels in Parkinson's disease patients in the Chinese population[J].Neurosci Lett,2012,514(2):152.
[2]Jesus S,Perez I,Caceres- Redondo MT,et al.Low serum uric acid concentration in Parkinson's disease in southern Spain[J].Eur J Neurol,2013,20(1):208.
[3]蒋雨平,王坚,丁正同,等.原发性帕金森病的诊断标准(2005年)[J].中国临床神经科学,2006,14(1):40.
[4]周建忠,吴坚,盛世英,等.Hoehn-Yahr分级1级的帕金森病患者自主神经功能的研究[J].临床神经病学杂志,2013,26(1):69.
[5]任肖玉,周明珠,干静,等.帕金森病患者生活质量的前瞻性研究[J].中华老年医学杂志,2013,32(4):353.
[6]龚艳,熊康平,毛成洁,等.帕金森病患者认知障碍的特点及其对睡眠的影响[J].中华医学杂志,2013,93(33):2637.
[7]Chahine L M,Stern M B,Chen-Plotkin A.Blood-based biomarkers for Parkinson's disease[J].Parkinsonism Relat Disord,2014,20(Suppl 1):S99.
[8]孙刚顺.早、中、晚期帕金森病患者血清脑源性神经营养因子的比较[J].实用临床医药杂志,2011,15(9):110.
[9]冯涛,刘萍,张璇,等.早期帕金森病临床特征异质性的聚类分析研究[J].中国实用内科杂志,2010,30(7):611.
[10]李嘉姝,任艳.帕金森病非运动症状的表现及处理[J].中国实用内科杂志,2010,30(2):187.
[11]李芳菲,冯涛.2013年欧洲神经病学联盟帕金森病诊断指南解读[J].中国实用内科杂志,2013,33(11):862.
[12]白抚生,尤林,谢欣,等.普拉克索对老年帕金森病伴抑郁的疗效及机制研究[J].中国实用内科杂志,2014,34(2):201.
[13]Constantinescu R,Zetterberg H.Urate as a marker of development and progression in Parkinson's disease[J].Drugs Today(Barc),2011,47(5):369.
[14]Paganoni S,Zhang M,Quiroz Z A,et al.Uric acid levels predict survival in men with amyotrophic lateral sclerosis[J].J Neurol,2012,259(9):1923.
[15]李建英,肖海兵,杨春水,等.帕金森患者血尿酸水平及其与认知功能的关系研究[J].重庆医学,2013,42(8):884.
[16]王念,陈顺中,常华军,等.血尿酸水平在老年帕金森病患者中的临床诊疗价值[J].中国老年学杂志,2013,33(24):6263.
[17]Pan M,Gao H,Long L,et al.Serum uric acid in patients with Parkinson's disease and vascular parkinsonism:a crosssectional study[J].Neuroimmunomodulation,2013,20(1):19.

