地佐辛复合舒芬太尼用于老年胃肠道肿瘤根治术患者术后静脉自控镇痛的临床效果
刘泽文,严国胜,刘会长
(湖北省鄂州市中心医院麻醉手术科,湖北鄂州,436000)
胃肠道肿瘤根治术术后疼痛属于中度到重度的急性疼痛,疼痛剧烈,给手术患者带来巨大的身心创伤和痛苦,同时老年患者由于各种器官退行性改变导致耐受力下降,静脉自控镇痛(PCIA)后易发生过度镇静和呼吸抑制,因此良好的术后镇痛具有重要意义。地佐辛属阿片受体激动-拮抗药,主要通过激动κ受体产生镇痛作用,镇痛效果强且不良反应较少[1]。本研究将地佐辛复合舒芬太尼应用于老年胃肠道肿瘤根治术后静脉自控镇痛,观察其镇痛效应和不良反应,现报告如下。
1 资料与方法
1.1 一般资料
选择2012年6月—2013年5月本院行胃肠道恶性肿瘤根治术患者60例。年龄65~77岁,体质量45~80 kg,性别不限,ASAⅠ~Ⅱ级。患者神志清楚,经过短暂培训可以理解视觉模拟评分(VAS评分)。无阿片类药物成瘾或过敏史。病例排除标准:严重心肺疾病(心功能Ⅲ级及Ⅲ级以上者;吸空气SpO2<95%者)、肝肾功能严重异常(GPT>正常值3倍或肌酐高于正常)、异常出血史及凝血功能障碍者均排除在外。60例患者随机分为地佐辛复合舒芬太尼组(SD组)和舒芬太尼组(S组),每组30例。
1.2 麻醉方法
患者予以充分术前准备,术前30 min常规肌注阿托品0.01 mg/kg、苯巴比妥钠2 mg/kg。入室后开放静脉,用PHILIP MP50监护仪持续监测BP、SpO2、ECG、PetCO2。 麻 醉 诱 导:依 次 静注咪达唑仑0.05 mg/kg,舒芬太尼0.2~0.3μg/kg,依托咪酯0.2 ~0.3 mg/kg,顺式阿曲库胺0.15 mg/kg快速诱导后气管内插管,插管成功后接 drager麻醉机行机控呼吸(IPPV),潮气量8~12mg/kg,频率12次/min,吸呼比1∶2,PetCO235~45 mmHg。术中静脉持续泵入丙泊酚4~6 mg/(kg·h)和瑞芬太尼0.1~0.25μg/(kg·min)维持麻醉,间断静推顺式阿曲库胺2.5 mg保证术中肌松要求,手术结束前10 min停止丙泊酚和瑞芬太尼,拔管前酌情拮抗肌松药作用(给予新斯的明0.02 mg/kg和阿托品0.01 mg/kg拮抗残余肌松剂)。所有患者手术结束前30 min均静脉滴注昂丹司琼4 mg预防恶心呕吐。术后镇痛:术前经患者签署知情同意书,并讲解PCIA泵使用方法,采用机械镇痛泵(扬州华东器械有限责任公司)。PCIA设置:背景输液2 mL/h,自控剂量每次0.5 mL,锁定时间15 min,术后由专人管理和访视,并由患者完成疼痛评分。药物配方:佐辛复合舒芬太尼组(SD组):0.3 mg/kg地佐辛 +1.0μg/kg舒芬太尼 +8 mg昂丹司琼溶于 100mL等渗生理盐水中;舒芬太尼组(S组):2.0μg/kg舒芬太尼 +8mg昂丹司琼溶于100 mL等渗生理盐水中。所有患者术后清醒拔管后经静脉注入各自组镇痛泵中的镇痛液负荷量3 mL后接PCIA镇痛泵开始术后镇痛。
1.3 观察指标
观察指标有:① 生命体征:持续监测HR、RR、BP、SpO2、ECG;② 镇痛效果评估:记录术后4、8、16、24、48h的 VAS 评分(0 ~10 分,0 分为无痛,10分为无法忍受的剧痛),包括安静和90°翻身运动时;③ 镇静效果评估:采用Ramsay评分法评估镇静程度。1分为不安静、烦躁;2分为安静合作;3分为嗜睡,能听从指令;4分为睡眠状态,可唤醒;5分为呼吸反应迟钝;6分为深睡状态,呼吸不醒。其中2~4分为镇静满意,5~6分为镇静过度;④ 不良反应:观察镇痛期间恶心、呕吐、头晕、寒战、尿潴留和呼吸抑制等不良反应发生情况;⑤患者术后镇痛评价和总体满意度评价:1分为满意,2分为可接受,3分为不满意。
1.4 统计学分析
所有数据使用SPSS 12.0统计软件分析包进行处理,计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结果
2组患者在年龄、性别比例、体质量、ASA分级等一般资料上均无显著差异(P>0.05)。2组患者术后安静状态下VAS评分均随时间延长而明显降低,但差异无统计学意义(P>0.05);术后4、8、12、24、48h 时翻身运动时 VAS 评分 DS组明显低于S组(P<0.05);术后各时点Ramsay镇静评分差异无统计学意义(P>0.05)。见表1。
2组患者镇痛期间恶心、呕吐、头晕的发生率S组高于DS组,差异有统计学意义(P<0.05);寒战的发生率S组明显高于DS组,差异有统计学意义(P<0.01);而尿潴留、呼吸抑制等不良反应发生率,差异无统计学意义(P>0.05)。见表2。
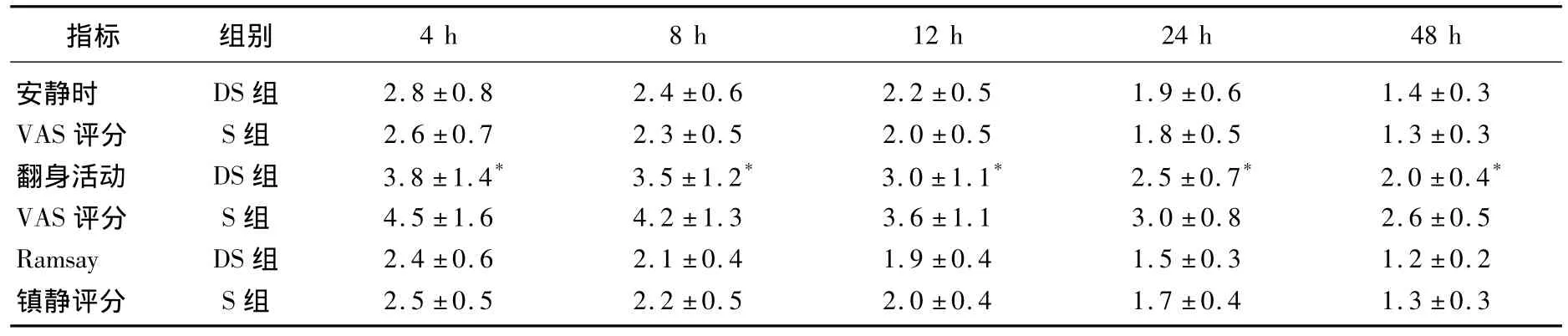
表1 2组患者术后各时点安静和翻身活动时VAS评分、Ramsay评分比较
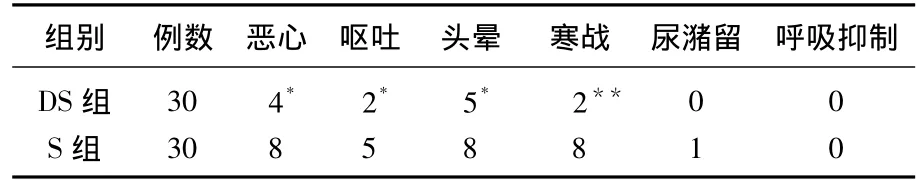
表2 PICA期间不良反应比较
镇痛满意度评价方面,DS组达满意者为26例(86.7%),S组为20例(66.7%);总体满意度评价DS组达满意DS组为24例(80%),S组为18例(60%),DS组均明显高于S组,差异有统计学意义(P<0.05)。见表3。

表3 术后镇痛满意度评价和总体满意度评价
3 讨论
胃肠道肿瘤根治手术切口大,且腹部手术伤口常常影响术后呼吸运动,造成患者呼吸受限和肺部感染概率增加。老年患者由于各脏器代偿和储备能力下降,加上本身对镇痛药物比较敏感和代谢缓慢[2],由此出现的不良作用较多。因此,安全有效的术后镇痛不仅可以减轻老年患者术后痛苦,减少机体应激反应,提高老年患者围术期防止并发症发生的能力,同时有利于早期下床活动,促进术后恢复。目前,临床上针对该类手术术后运用较多的镇痛方式主要为患者静脉自控镇痛(PCIA)。理想的PCIA所选用镇痛药应该具备起效迅速、时间中等、镇痛作用没有封顶效应,且不引起恶心呕吐、呼吸抑制、瘙痒及影响胃肠功能运动等特点[3],阿片类药物是常用的术后镇痛药物,但其镇痛作用与不良作用均为受体依赖性,若达到安静镇痛,则运动时镇痛作用不够;若达到较好的运动镇痛效果,则平静时可产生恶心、呕吐和呼吸抑制等不良反应[4]。
舒芬太尼是芬太尼的N24噻吩基衍生物,是一种强效的阿片类镇痛药,同时也是一种特异性μ-阿片受体高度选择性激动剂,其镇痛效价是芬太尼的5~10倍[5],并且有起效快、镇痛作用强、持续时间久、呼吸抑制短而弱、无组胺释放等优点,非常适合于术后镇痛[6]。但随着剂量增加,其中枢性副作用如恶心呕吐、呼吸抑制、瘙痒、头晕的发生率和程度也相应增加,易产生药物耐受和依赖性,这增加了患者术后不适感和危险因素,应尽量减少剂量和避免长期使用。地佐辛属阿片受体激动-拮抗药,主要通过激动κ受体产生脊髓镇痛作用,镇痛起效快、作用时间长,具有镇痛效果强,安全性和耐受性好、副作用轻微等特点[7]。同时对μ受体具有激动和拮抗双重作用,可以减少恶心、呕吐和呼吸抑制等不良反应的发生,且地佐辛对δ阿片受体活性极弱,不产生烦躁焦虑感,呼吸抑制和成瘾性的发生率低[8]。
本研究将地佐辛复合舒芬太尼用于老年胃肠道肿瘤根治术后镇痛,结果显示2组患者各时点的Ramsay评分和安静时的VAS评分比较无明显差异(P>0.05);翻身运动时SD组各时点VAS评分均低于S组(P<0.05),说明2组PICA期间患者处于安静合作或嗜睡状态,对神志意识影响不大,不影响术后与患者交流和病情判断。与传统强阿片镇痛药舒芬太尼相比,SD组在对患者术后安静时镇痛效果相似,但对90°翻身运动时的镇痛效果要更加显著。由于地佐辛对u受体有激动和拮抗双重作用,可使胃肠平滑肌松弛和降低胃肠道反应的发生,对u受体兴奋引起的恶心呕吐有抑制作用[9],且对呼吸抑制作用小。本研究中地佐辛联合舒芬太尼组引起患者恶心、呕吐、头晕等不良反应的发生率明显低于舒芬太尼组(P<0.05),也印证了这一点,其原因也可能与选择多模式镇痛方式下产生相同镇痛效果所需舒芬太尼的剂量较小有一定关系。另外,联合用药组术后寒战概率明显低于舒芬太尼组(P<0.01),国外也有相关研究[10]证明了手术结束前给予激动拮抗药可有效地预防术后寒战的发生。
由此可见,地佐辛联合舒芬太尼应用在κ受体分布较多的胃肠道肿瘤根治术术后镇痛,不仅可以产生协同作用,增强镇痛效能,而且可以减少各自的不良反应,起到满意的镇静、镇痛作用,提高患者的满意度,是老年胃肠道肿瘤患者术后静脉自控镇痛的理想药物选择,与单用舒芬太尼镇痛比较具有明显的优势,值得临床上推广应用。
[1]段砺瑕,李晓玲.地佐辛注射液的药理作用及临床应用[J].中国新药杂志,2004,13(9):851.
[2]Miller RD著.米勒麻醉学[M].曾因明,邓小明,译.北京:北京医科大学出版社,2006:2441.
[3]马兰.舒芬太尼用于术后静脉自控镇痛的临床效果[J].临床麻醉学杂志,2006,22:452.
[4]Yue H J,Guilleminault C.Opioid medication and sleep-dis-ordered breathing[J].Med C1in North Am,2010,94(3):435.
[5]Abonen J,Olkkola K T,Hynynen M,et al.Comparison of alfentanil,fentanyl and sufentanil for total intravenous anaesthesia with Propofol in patients undergoing coronary artery bypass surgery[J].Br Anaesth,2000,85:533.
[6]Thomson I R,Harding G,Hudson R J A.comparison of fentanyl sufentanil in patients undergoing coronary artery bypass graft surgery[J].J Cardiothorac Vasc Anesth,2000,14:652.
[7]Strain E C,Preston K L,Liebson I A,et al.Opioid antagonist effects of dezocine in humans[J].Clin Pharmacol Thcro,1996,60(2):206.
[8]0'Brien J J,Benfield P.Dezocine.A preliminary review of its pharmacodynamic and pharmacokinetic properties and therapeutic efficacy[J].Drugs,1989,38(2):226.
[9]Fischer B D,Dykstra L A.Interactions between an N-methly-D-asparte antagonist and low-efficacy opioid receptor agonists in assays of schedule-controlled responding and thermal nociception[J].J PharmacolExp Ther,2006,318:1300.
[10]Komatsu R,Turan A M,Orhan-Sungur M,et al.Remifentanil for general anaesthesia:a systematic review[J].Anaesthesia,2007,62(12):1266.

