谷氨酰胺对大鼠肠缺血再灌注损伤的作用
王爱丽, 牛 琼, 刘成霞, 贾兴芳, 连海峰
缺血再灌注(ischemia-reperfusion,I/R)损伤是各种原因导致组织器官缺血时,引起细胞代谢障碍和组织结构出现破坏,当血供恢复时,组织及细胞损伤反而出现加重的现象。小肠是缺血再灌注损伤最常累及的器官,肠绞窄、小肠移植和肠系膜血管缺血性疾病等情况均会引起小肠的缺血性损伤。肠道黏屏障是防止肠道内有害物质和病原体进人机体内环境,并维持机体内环境稳定的一道重要屏障,主要由机械屏障、免疫屏障、化学屏障和生物屏障四部分组成。在肠缺血再灌注损伤过程中,小肠局部微血管通透性增加、肠黏膜屏障功能受损,从而导致肠道细菌和毒素的移位,严重时可引发全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)[1]和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。文献报道,在过去的几十年中,医院肠缺血发生率持续增加,急性肠缺血再灌注损伤病死率维持在一个较高的水平,大约在60% ~80%[2]。谷氨酰胺(glutamine,Gln)是肠上皮细胞重要的营养物质,在肠道严重损伤的情况下可以增加小肠吸收面积,增加肠黏膜的细胞构成,减少内毒素升高[3]。本课题组前期的研究表明,谷氨酰胺对体外缺氧再灌注损伤的肠上皮细胞具有保护作用[4]。本研究拟利用大鼠建立肠缺血再灌注损伤模型,探讨谷氨酰胺对肠缺血再灌注损伤大鼠的保护作用及其机制。
材料和方法
1 药物和试剂
谷氨酰胺粉末,纯度99%,购自Sigma;D-乳酸试剂盒购于慧嘉生物有限公司;内毒素试剂盒购于厦门鲎试剂实验厂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)检测试剂盒购于南京建成有限公司。
2 动物和分组
清洁级健康成年雄性Wistar大鼠(n=30),体重220~250 g,由山东大学实验动物中心提供,批号为SOXXK(鲁)20090001。
动物随机分为假手术(sham)组、I/R组和Gln组,每组10只。Gln组于造模前7 d开始给予1 g·kg-1·d-1谷氨酰胺连续灌胃,sham和I/R组分别于造模前给予同等剂量生理盐水灌胃。所有大鼠术前禁食12 h,自由饮水,10%水合氯醛腹腔注射(3 mL/kg)麻醉。Sham组取腹正中切口,长约3.0 cm,用温盐水纱布将肠管推向左侧腹腔,暴露右肾内上方的肠系膜根部,找到肠系膜上动脉(superior mesenteric artery,SMA),分离 SMA后不阻断。I/R组则显露SMA,用无创血管夹阻断其系膜血管30 min,造成肠缺血模型,松夹再灌注24 h。Gln组显露SMA,余操作同I/R组。操作过程中所有大鼠腹腔注入37℃生理盐水0.5 mL/kg,以保持血流动力学稳定。实验结束后关腹。
I/R 24 h后再次麻醉剖腹,立即从腹主动脉采集血标本,行全血4℃、3 000 r/min离心 20 min后分装血清,-80℃冰箱保存备用。剪取距回盲部约10 cm处4.0 cm长回肠标本,迅速用冷生理盐水溶液冲洗,清除黏液、污物等肠腔内容物后,用滤纸吸干,立即投入装有10%甲醛溶液中固定,以备HE染色行组织病理学检测。
3 方法
3.1 肠黏膜绒毛组织病理变化的光镜观察 取距回盲部10 cm处4 cm肠段,用10%中性甲醛液固定,常规石蜡包埋,切片(厚5 μm),HE染色。光镜下观察肠黏膜绒毛结构变化并进行Chiu′s评分。评分标准见表1。

表1 肠道损伤Chiu氏6级评分Table 1.Chiu′s scoring for evaluating intestinal injury
3.2 透射电镜观察细胞间机械屏障的变化 取距回盲部10 cm处4 cm肠段,2.5%戊二醛固定24 h以上;2%锇酸固定2 h;丙酮梯度脱水;环氧树脂混合液37℃浸泡24 h;纯丙酮+包埋液(2∶1)室温3~4 h、纯丙酮+包埋液(1∶2)室温过夜、纯包埋液37℃ 2~3 h包埋,固化后,3%醋酸铀-枸橼酸铅双染色修块、定位后制出超薄切片;透射电镜观察、照相。
3.3 血清SOD和MDA的检测 采用硫代巴比妥酸法测定血清中MDA的含量;采用黄嘌呤氧化酶法测定SOD活性。试剂均采用南京建成生物工程研究所的试剂盒。操作步骤严格按照说明书进行。仪器采用上海产721型分光光度计,测定对照管及测定管的吸光度值,通过公式计算求出被测样品的SOD活性及MDA水平。
3.4 大鼠血清内毒素的测定 应用ELISA试剂盒,将已知内毒素浓度的标准品、未知浓度的样品加入微孔酶标板内进行检测。先将内毒素和生物素标记的抗体同时温育。洗涤后,加入亲和素标记过的辣根过氧化物酶。再经温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,与酶结合物同时作用,产生颜色。颜色的深浅和样品中内毒素的浓度呈比例关系。于545 nm波长处读取吸光度值,建立标准曲线,测得样品中内毒素的浓度。
3.5 大鼠血清中D-乳酸含量的测定 采用慧嘉生物公司D-乳酸酶联免疫分析试剂盒,应用双抗体夹心法测定血清中大鼠D-乳酸的水平。用酶标仪在450 nm波长下测定吸光度(A),通过标准曲线计算样品中大鼠D-乳酸的浓度。
4 统计学处理
数据用均数±标准差(mean±SD)表示。进行正态性检验和方差齐性检验。对符合正态分布和方差齐性的资料进行单因素方差分析,组间比较采用LSD-t检验。输入SPSS 17.0统计软件处理,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠肠黏膜绒毛组织的病理变化
假手术对照组绒毛排列整齐,无水肿。腺体正常,上皮下间隙无扩大,固有层无水肿;缺血再灌注组主要表现为肠黏膜上皮缺失,伴腺体水肿,排列紊乱,固有层崩解,部分绒毛顶端出血;谷氨酰胺预处理组表现为肠黏膜绒毛上皮下间隙扩大,但不明显,绒毛轻度水肿,腺体形态大致正常,固有层轻度水肿,见图1。再灌注24 h的损伤程度(Chiu′s评分),sham组:0.29±0.46;I/R组:4.10±0.50;Gln组:2.50±0.64。I/R组与sham组相比,差异有统计学意义(P<0.05);Gln组与I/R组相比,差异有统计学意义(P<0.05);Gln组与sham组相比,差异无统计学意义(P>0.05)。
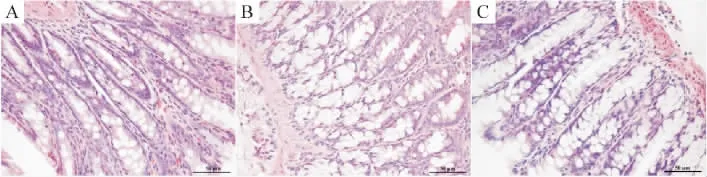
Figure 1.Pathological changes of the rat intestinal mucosa observed by HE staining(×400).A:sham group;B:I/R group;C:Gln group.Scale bar=50 μm.图1 各组大鼠肠黏膜绒毛组织的HE染色结果
2 透射电镜观察肠黏膜绒毛组织的病理变化
假手术对照组电镜下肠黏膜上皮排列规则、紧密,多位斜切,上皮细胞呈高柱状,上皮细胞表面微绒毛丰富,排列规则,细胞间靠腔面为紧密连接,下方为桥粒结构,紧密连接比较长,结构清晰,连接缝隙小,近游离面细胞器丰富,有大量线粒体分布,细胞侧面连接复合体结构完整;缺血再灌注组电镜下肠黏膜上皮细胞表面微绒毛较稀疏,排列欠规则,少数细胞微绒毛倒伏,细胞侧面的连接复合体完整,细胞间靠腔面为紧密连接,下方为桥粒结构,紧密连接较正常组稍变短,桥粒结构良好,细胞内线粒体基本正常,粗面内质网脱颗粒,内质网肿胀;谷氨酰胺治疗组电镜下肠黏膜上皮细胞表面微绒毛密集、排列规则,紧密连接较长,结构清晰,连接缝隙小,桥粒结构丰富,细胞间的连接复合体完整,细胞器形态基本正常,见图2。

Figure 2.Pathological changes of the rat intestinal mucosa observed under transmission electron microscope(×10 000).A:sham group;B:I/R group;C:Gln group.Scale bar=1 μm.图2 透射电镜观察
3 谷氨酰胺对肠缺血再灌注损伤大鼠血清中D-乳酸和内毒素水平的影响
缺血再灌注组与假手术组相比,血清中D-乳酸和内毒素含量明显升高(P<0.05);谷氨酰胺治疗组与缺血再灌注损伤组相比,血清中D-乳酸和内毒素含量显著降低(P<0.05),见表2。
4 谷氨酰胺对肠缺血再灌注损伤大鼠血清SOD和MDA水平的影响

表2 各组大鼠血清中内毒素及D-乳酸的含量Table 2.The serum levels of endotoxin and D-lactic acid in the rats with different treatments(Mean±SD.n=10)
缺血再灌注损伤组与假手术组比较,SOD活性显著降低,MDA水平显著增高(P<0.05),谷氨酰胺治疗组与缺血再灌注损伤组相比较,血清SOD活性高于缺血再灌注损伤组,MDA水平低于缺血再灌注组,见表3。

表3 各组大鼠血清SOD活性及MDA含量Table 3.Changes of SOD and MDA levels in the rats with different treatments(Mean±SD.n=10)
讨 论
缺血再灌注损伤是创伤、严重感染及休克等疾病共同存在的病理生理过程。小肠是对缺血再灌注损伤最敏感的器官之一,在肠绞窄、小肠移植和肠系膜血管缺血性疾病等情况下,均会引起小肠的缺血性损伤,在组织恢复血供时,再灌注损伤会加重对小肠的损伤。同时,小肠是机体最大的细菌库,缺血再灌注损伤消化道,削弱小肠的生理屏障功能,肠道黏膜屏障功能损伤的主要病理改变是肠黏膜通透性增加,从而导致内毒素血症、肠内细菌移位,引起大量炎症因子的释放,诱导全身炎症反应综合症和多器官功能不全综合症的发生[1,5]。
内毒素是G-菌细胞壁的脂多糖成分,是炎症反应的主要触发因素[6]。正常情况下,机体肠腔内含大量细菌和内毒素。由于肠道屏障功能完整,细菌和内毒素难以进入血循环,当肠道屏障功能障碍时,内毒素穿过肠黏膜,进入血液循环,形成内毒素血症。D-乳酸是细菌发酵的代谢产物,由肠道多种细菌产生,当肠道发生急性缺血等损伤致肠黏膜绒毛顶端上皮脱落,细胞旁路径增加而致肠黏膜通透性增加时,肠道中细菌产生的大量D-乳酸通过受损黏膜入血,人体内缺乏D-乳酸脱氢酶,且其它替代途径代谢缓慢,故监测血中乳酸水平可反映肠黏膜损害程度和通透性变化[7]。
近来人们对肠缺血再灌注损伤的氧化应激机制有了更深入的认识[8-9]。小肠绒毛富含活性氧簇相关的酶,缺血再灌注激活了腺嘌呤-次黄嘌呤代谢途径,使氧自由基的产生异常增加。生物膜主要由脂质、蛋白质和糖类组成,脂质以磷脂为主,磷脂的主要成分是多聚不饱和脂肪酸,其中有多个弱键和不饱和键,氧自由基对其有很高的亲和力,过多的氧自由基可激发链式脂质过氧化反应,造成细胞膜性结构中脂类过氧化,抑制线粒体酶活性,使细胞膜、溶酶体膜通透性增加,导致细胞膨胀破裂,破坏肠黏膜结构和功能,导致肠黏膜通透性增高。当此反应链遇到谷胱甘肽、维生素E和维生素C等抗氧化物时损伤效应后就会终止。MDA是肠缺血再灌注损伤病理过程中一种代表性脂质过氧化物,其含量可直接反映机体内脂质过氧化的程度。SOD是体内清除氧自由基的最主要物质,其活力的高低反映了机体清除氧自由基的能力[10-12]。
谷氨酰胺是肠上皮细胞、淋巴细胞和巨噬细胞最重要和最易利用的能源燃料[13],是抗氧化防御系统中重要物质谷胱甘肽和核苷酸等合成的前体。Wu等[14]研究表明,谷氨酰胺处理对肠缺血再灌注损伤肠黏膜具有保护作用,可以降低肠缺血再灌注过程中内毒素的升高[15],降低细菌移位,减轻缺血再灌注损伤。但是,谷氨酰胺对肠黏膜的保护作用是否与抗氧化应激有关尚未明确。因此我们利用大鼠建立肠缺血再灌注损伤模型,探讨谷氨酰胺对大鼠肠缺血再灌注损伤的作用及其机制。
本研究参照文献[16]的方法制备小鼠肠缺血再灌注损伤模型,结果I/R组大鼠肠上皮细胞脱落,腺体明显损伤,上皮下间隙增大,固有层水肿、充血、出血,提示大鼠肠缺血再灌注损伤模型制备成功。正常情况下肠黏膜具有完善的机械屏障,机械屏障由肠黏膜表面黏液、微绒毛、上皮细胞及其间的紧密连接以及黏膜的特殊结构组成[17]。我们通过电镜下观察肠黏膜的超微结构发现,与缺血组相比,模型组及谷氨酰胺组电镜下肠黏膜上皮排列明显规则、紧密,上皮细胞表面微绒毛丰富,排列较规则,细胞间腔面紧密连接明显较长,结构清晰。我们通过测定肠缺血再灌注损伤大鼠肠道细菌代谢产物D-乳酸及血浆内毒素水平来了解其肠道屏障功能及肠通透性的变化。结果显示,肠缺血再灌注损伤组大鼠肠黏膜屏障受损,血浆D-乳酸、内毒素水平较假手术组均明显升高(P<0.05),提示大鼠在肠缺血再灌注状态下,肠黏膜屏障功能障碍、肠通透性升高,并出现内毒素血症。而谷氨酰胺处理组血浆D-乳酸、内毒素水平较对照组显著降低(P<0.05),保护肠黏膜免受损伤,降低内毒素血症的发生及细菌移位。与缺血再灌注损伤组相比,谷氨酰胺处理组MDA水平显著降低,SOD活性显著升高(P<0.05),提示谷氨酰胺可以抑制脂质过氧化反应,提高机体清除氧自由基的能力。由此可见,谷氨酰胺处理可以减低缺血再灌注损伤,该保护作用可能是通过清除氧自由基及提高组织抗氧化酶活力,减轻脂质过氧化而实现的。但谷氨酰胺使用方法、剂量以及协同效应等还需要进一步的探索研究,以彻底分析谷氨酰胺对肠缺血再灌注损伤的作用机制,从而为临床工作提供指导。
[1] Guan Y,Worrell RT,Pritts TA,et al.Intestinal ischemia reperfusion injury:reversible and irreversible damage imaged in vivo[J].Am J Physiol Gastrointest Liver Physiol,2009,297(1):G187-G196.
[2] Acosta S.Epidemiology of mesenteric vascular disease:clinical implications[J].Semin Vasc Surg,2010,23(1):4-8.
[3] Demirkan A,Savas B,Melli M,et al.Endotoxin level in ischemia-reperfusion injury in rats:effect of glutamine pretreatment on endotoxin levels and gut morphology[J].Nutrition,2010,26(1):106-111.
[4] 潘 璠,刘成霞.谷氨酰胺对体外肠上皮细胞缺血再灌注损伤后occludin蛋白表达的影响[J].中华临床医师杂志,2012,6(10):2624-2627.
[5] Vollmar B,Menger MD.Intestinal ischemia/reperfusion:microcirculatory pathology and functional consequences[J].Langenbecks Arch Surg,2011,396(1):13-29.
[6] Vieira AT,Pinho V,Lepsch LB,et al.Mechanisms of the anti-inflammatory effects of the natural secesteroids physalins in a model of intestinal ischaemia and reperfusion injury[J].Br J Phannacol,2005,146(2):244-251.
[7] Vatistas NJ,Nieto JE,van Hoogmoed L,et al.Use of an isolated intestinal circuit to evaluate the effect of ischemia and reperfusion onmucosal permeability of the equine jejunum[J].Vet Surg,2003,32(1):52-61.
[8] Ozkan OV,Yuzbasioglu MF,Ciralik H,et al.Resveratrol,a natural antioxidant,attenuates intestinal ischemia/reperfusion injury in rats[J].Tohoku J Exp Med,2009,218(3):251-258.
[9] 叶志强,戴海涛,卫洪波.乳果糖预处理减轻大鼠肠缺血再灌注损伤的机制研究[J].中国病理生理杂志,2013,29(5):918-922.
[10] Ban K,Kozar RA.Enteral glutamine:a novel mediator of PPAR gamma in the postiachemic gut[J].Leukoc Biol,2008,84(3):595-599.
[11]吴 露,黄小平,张秋雁.人参皂苷Rg1对小鼠脑缺血再灌注后脑组织损伤及Nrf2/HO-1途径的影响[J].中国病理生理杂志,2013,29(11):2066-2071.
[12]赵润英,郝 伟,魏 巍.阿魏酸川芎嗪对缺血再灌注大鼠心肌细胞凋亡及凋亡相关蛋白表达的影响[J].中国病理生理杂志,2013,29(12):2139-2143.
[13]Oliveira GP,Oliveira MB,Santos RS,et al.Intravenous glutamine decreases lung and distal organ injury in an experimental model of abdominal sepsis[J].Crit Care,2009,13(3):R74.
[14]Wu GH,Wang H,Zhang YW,et al.Glutamine supplemented parenteral nutrition prevents intestinal ischemiareperfusion injury in rats[J].World J Gastroenterol,2004,10(17):2592-2594.
[15]Liu H,Wei X,Chen L,et al.Tetramethylpyrazine analogue CXC195 protects against cerebral ischemia/reperfusion injury in the rat by an antioxidant action via inhibition of NADPH oxidase and iNOS expression[J].Pharmacology,2013,92(3-4):198-206.
[16] Kazantzidou D,Tsalis K,Vnsiliadis K,et al.Alanineglutamine dipeptide pretreatment protects rat renal function from small intestine ischemia-repedusion injury[J].Minena Chir,2010,65(5):515-525.
[17]Kiyono H,Kweon MN,Hiroi T,et al.The mucosal immune system:from specialized immune defense to inflammation and allergy[J].Acta Odontol Scand,2001,59(3):145-153.

