硫化氢抑制大鼠急性心肌缺血引起的细胞炎症反应*
谢英花, 马燕山, 张 楠, 张建新△
我国每年心血管疾病占总死亡原因的41%[1]。其中缺血性心脏病可引发自由基损伤、钙超载、炎症瀑布反应等,进而诱发心绞痛,甚至心肌梗死[2]。此类心脏病防治的重点是如何解除或减轻缺血性损伤。随着研究的深入,发现炎症损伤在缺血性心肌病的发生、发展中起关键作用[3-4]。研究表明H2S在心肌缺血/再灌注模型中发挥抗炎作用[5-6]。但其对离体急性心肌缺血损伤的影响与炎症反应之间的关系,目前尚不明确。本研究采用离体大鼠急性缺血损伤模型,观察H2S对急性缺血时心肌细胞产生的炎症细胞因子的影响,探讨H2S的心肌保护作用机制。
材料和方法
1 材料
1.1 仪器、药品与试剂 NaHS购自Sigma;Prime-Script RT Reagent(Prefect Real Time)、SYBR Premix Ex TaqTM(Prefect Real Time)、RNAiso Plus Reagent、EASY Dilution(for Real Time PCR)和DL2000 DNA Marker均购自TaKaRa;BCA法蛋白定量试剂盒、预染蛋白marker均购自上海捷瑞生物工程有限公司;鼠NF-κB p65和β-actin多克隆抗体购自Santa Cruz。八道生理记录仪PowerLab/8S(AD Instrument);PCR Thermal Cycler Dice和PCR Thermal Cycler Dice Real Time System(TaKaRa);凝胶成像系统(UVP)。
1.2 动物及分组 SPF级♂SD大鼠40只,体重(270±20)g,由河北省实验动物中心提供,随机分为5组,每组8只,分别为:假手术组(sham)、缺血组(ischemia)以 及 NaHS 5 μmol/L、10 μmol/L 和20 μmol/L剂量组。假手术组冠状动脉左前降支只穿线但不结扎。缺血组建立缺血模型。NaHS各剂量组亦制备缺血模型,缺血2 h时更换为5 μmol/L、10 μmol/L和20 μmol/L NaHS灌流液。假手术组和缺血组用正常灌流液灌流。
2 方法
2.1 离体大鼠急性心肌缺血损伤模型的制备 大鼠腹腔注射10%水合氯醛350 mg/kg麻醉后,迅速开胸,取出心脏,置于盛有混合气饱和预冷K-H液的平皿中,清洗残留血液,经主动脉逆行插管,悬挂于Langendorff灌注装置,使用95%O2+5%CO2混合气饱和的K-H液恒压灌注,循环恒温水浴维持灌注系统温度在(37±0.5)℃。离体心脏经Langendorff模型平衡灌注20 min后,结扎冠状动脉左前降支,造成心肌急性缺血。结扎成功后每分钟冠脉流量下降30%左右,心肌收缩力下降至原来1/3~1/2,心脏缺血区表面发白。继续灌流4 h。
2.2 心功能测定 记录各组缺血末 ±dp/dtmax、左室舒张压(left ventricular diastolic pressure,LVDP)和冠脉流量(coronary flow,CF)等心功能指标。
2.3 实时荧光定量PCR测定心肌组织中TNF-α、IL-1β、IL-6、IL-10和ICAM-1 mRNA的表达 各组实验结束后摘取心脏,用冰生理盐水冲洗干净,无菌环境下取部分左心室前壁组织,迅速放入超低温冰箱中,留待进行实时荧光定量PCR测定。
将冷冻组织100 mg在预冷好的研钵中研磨至粉状。用RNAiso Plus 2 mL完全覆盖样品。室温静置。使之完全融化,后研磨直至得到透明裂解液。转移匀浆液,室温下静置5 min。4℃、13 000 r/min离心5 min后,将上清转移至新的1.5 mL离心管。按0.2 mL/1 mL的比例加入CHCl3,并振摇使之混匀。接着室温静置5 min,4℃、1 350 r/min离心15 min后,取 500μL上清,加入等体积的(CH3)2CHOH,混匀。室温静置10 min,4℃、13 000 r/min离心10 min。弃去上清液。用-20℃预冷的75%的乙醇1 mL清洗沉淀。后4℃、13 500 r/min离心5 min处理。弃去上清液,室温放置干燥。沉淀用RNase Free dH2O 40 μL溶解,在-80℃冰箱中保存,备用。
配制RT反应液(配制在冰上进行)进行逆转录反应,可有效地将全长mRNA反转录成cDNA。配制real-time PCR反应液(配制在冰上进行)。GAPDH引物序列正义链 5′-ATGATTCTACCCACGGCAAG-3′,反义链 5′-CTGGAAGATGGTGATGGGTT-3′;IL-6 引物序列 正 义 链 5′-TAGTCCTTCCTACCCCAACTTCC-3′,反义链 5′-TTGGTCCTTAGCCACTCCTTC-3′;IL-1β 引物序列正义链 5′-GACCTGTTCTTTGAGGCTGACA-3′,反义链 5′-CTCATTGGACAGCCCAAGTC-3′;TNF-α 引物序列正义链 5′-CCCAGACCCTCACACTCAGAT-3′,反义链 5′-TTGTCCCTTGAAGAGAACCTG-3′;ICAM-1引物序列正义链5′-CCCCACCTACATACATTCCTAC-3′,反 义 链 5′-ACATTTTCTCCCAGGCATTC-3′;IL-10引物序列正义链 5′-CAGACCCACATGCTCCGAGA-3′,反义链 5′-CAAGGCTTGGCAACCCAAGTA-3′。引物均由上海捷瑞生物工程有限公司合成。反应条件:95℃ 10 s;95℃ 5 s,60℃ 20 s,40个循环。
Real-time PCR定量分析数据由计算机收集,绘制动力学曲线,测定每个样品的Ct值,用2-ΔΔCt方法分析各组 TNF-α、IL-1β、IL-6、IL-10 和 ICAM-1 mRNA表达的差异。
2.4 Western blotting半定量测定心肌组织NF-κB的表达 实验结束后摘取心脏,剪取左心室前壁部分组织,迅速放入超低温冰箱中保存,留待进行Western blotting检测。将裂解的心肌组织离心得沉淀,加核蛋白提取液,研磨,离心,上清液与点样缓冲液热变性,做聚丙烯酰胺凝胶电泳,转膜,用TBST洗涤,5%脱脂奶粉封闭,加稀释的NF-κB p65Ⅰ抗,再加相应的Ⅱ抗,ECL显色,扫描条带,转换为数字图像,ImageJ图像分析软件半定量分析蛋白条带。
3 统计学处理
数据以均数±标准差(mean±SD)表示,通过SPSS 13.0统计软件进行多组间单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
结 果
1 离体心肌组织心功能的变化
各组缺血末±dp/dtmax、LVDP、CF等心功能指标见表1。结果表明,ischemia组心脏的 LVDP、±dp/dtmax和 CF均呈明显下降(与 sham组相比,P<0.01)。NaHS 5 μmol/L、10 μmol/L 和 20 μmol/L 组心脏的上述指标均明显高于ischemia组(P<0.05或P<0.01),说明H2S改善了离体急性缺血心肌功能。

表1 H2S对心功能的影响Table 1.The effect of H2S on the cardiac functions in the rat hearts after ischemia(Mean±SD.n=8)
2 H2S 对离体心肌组织中 TNF-α、ICAM-1、IL-1β、IL-10和IL-6 mRNA表达的影响
Ischemia 组离体心肌组织中 IL-1β、TNF-α、ICAM-1和IL-6 mRNA表达明显增强,IL-10 mRNA的表达明显降低(与sham组相比,P<0.01);与ischemia组相比,各 NaHS剂量组离体心肌组织中 IL-1β、TNF-α、ICAM-1和IL-6 mRNA表达显著降低,10 μmol/L和20 μmol/L NaHS组离体心肌组织中IL-10 mRNA表达显著升高(P<0.05或P<0.01),见图1、2。
3 H2S对离体心肌组织中NF-κB表达的影响
Sham组离体心肌组织中仅有很少量NF-κB的表达;ischemia组离体心肌组织中NF-κB的表达明显升高(与sham组相比,P<0.01);与ischemia组相比,10 μmol/L 和 20 μmol/L NaHS 组离体心肌组织中NF-κB的表达显著下降(P<0.05或P<0.01),见图3。
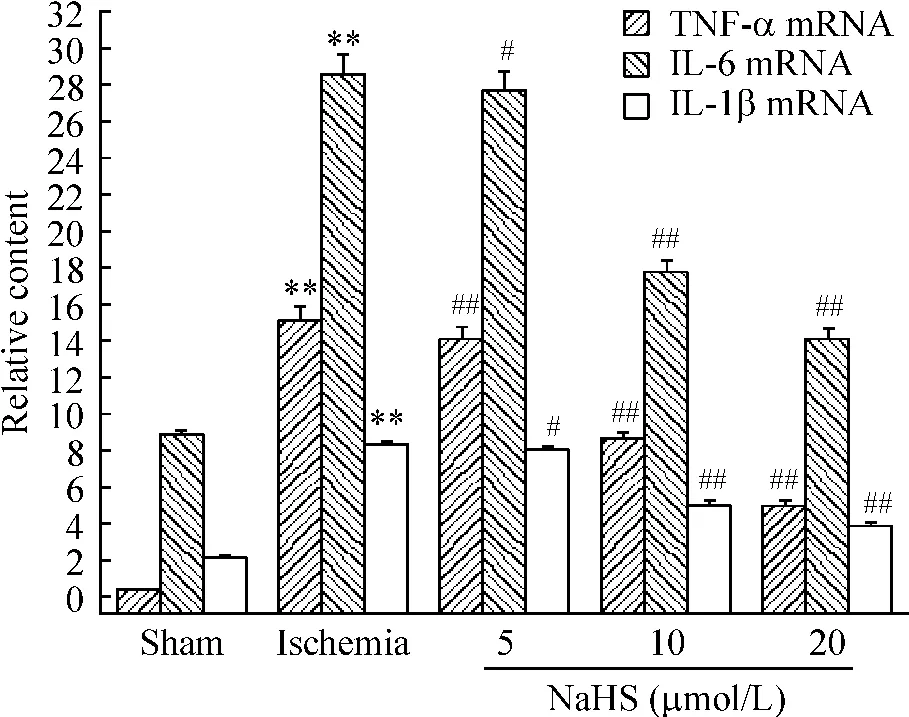
Figure 1.Effects of H2S on the mRNA expression of TNF-α,IL-6 and IL-1β in rat myocardial tissues.**P <0.01 vs sham;#P <0.05,##P <0.01 vs ischemia.图1 H2S对离体心肌组织中TNF-α、IL-1β和IL-6 mRNA表达的影响

Figure 2.Effects of H2S on the mRNA expression of ICAM-1 and IL-10 in rat myocardial tissues. **P <0.01 vs sham;#P<0.05,##P<0.01 vs ischemia.图2 H2S对离体心肌组织中ICAM-1和IL-10 mRNA表达的影响
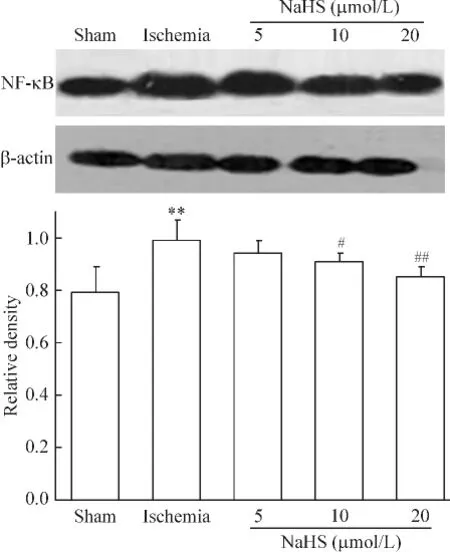
Figure 3.The effect of H2S on the protein level of NF-κB in rat myocardial tissues detected by Western blotting.**P <0.01 vs sham;#P<0.05,##P<0.01 vs ischemia.图3 H2S对离体心肌组织中NF-κB表达的影响
讨 论
本研究采用Langendorff离体灌流心脏和结扎左冠状动脉前降支,成功复制大鼠急性心肌缺血损伤模型。实验发现急性缺血后,心肌收缩力减弱,心功能降低。NF-κB出现明显移位,核NF-κB表达量明显增加,并伴随心肌组织中 IL-1β、TNF-α、ICAM-1和IL-6 mRNA表达增强,IL-10 mRNA表达明显降低。而H2S能明显对抗心肌缺血所致的LVDP降低,增加LVDP、±dp/dtmax及冠脉流量,抑制炎症细胞因子释放,保护急性缺血心肌。
心肌急性缺血初期仅有部分心肌细胞坏死,但随着大量炎症细胞浸润到心肌组织梗死区,心肌细胞坏死和凋亡的范围逐步扩大,形成较大面积心肌梗死,加速心功能恶化。炎症反应是导致心肌梗死后心脏病理学损伤的重要原因[7-8]。因此调控心肌梗死后炎症反应,恢复细胞因子网络平衡,是减轻心肌梗死后心脏损伤的关键[9-10]。
NF-κB是一种活跃的核转录因子,参与调控多种炎症递质及细胞因子基因的表达,在细胞因子网络失衡中起关键作用。研究表明心肌梗死后缺氧、氧化应激等活化信号能够激活NF-κB,并转位进入细胞核,进而诱导黏附分子家族的ICAM-1,前炎症因子 TNF-α、IL-1β、IL-6 等的表达上调[9],导致心肌炎症反应,引起心肌缺血损伤。而若能抑制NF-κB的活化和表达,可抑制炎症反应,促进心脏修复[11]。IL-lβ是IL-1的亚型之一,发生心肌缺血时,对心肌细胞具有直接的毒性作用,并能促进内皮细胞与中性粒细胞黏附[12]。IL-6是炎症反应中的核心调节因子,可广泛作用于多个系统。ICAM-1表达升高会增加中性粒细胞浸润、黏附,并可进一步恶化,加重心肌组织细胞损伤[13]。TNF-α是重要的初级炎症因子,在应激状态下,可在心肌大量表达[12]。而IL-10为多功能、多细胞源性的炎症抑制因子。若其产生受到抑制,促炎细胞因子将失去负反馈抑制作用,使炎症不断进展和恶化[14]。NF-κB的激活在炎症细胞因子表达中起着关键作用,而且两者相互促进,所以调节NF-κB的活性将有利于改善炎症反应,抑制心室的重构[15]。
[1] Hu SS,Kong LZ,Gao RL,et al.Outline of the report on cardiovascular disease in China,2010[J].Biomed Environ Sci,2012,25(3):251-256.
[2] 牟艳玲,王福文,张 强,等.甲胺鸢尾素对冠脉结扎致急性心肌缺血大鼠心功能的影响[J].中国药学杂志,2014,49(2):126-128.
[3] 秦华迪,秦春常,张海涛,等.齐留通对大鼠心肌缺血再灌注炎症损伤的抑制作用观察[J].解放军医学杂志,2014,39(3):192-196.
[4] Klingenberg R,Luscher TF.Inflammation in coronary artery disease and acute myocardial infarction:is the stage set for novel therapies?[J].Curr Pharm Des,2012,18(28):4358-4369.
[5] Sivarajah A,Collino M,Yasin M,et al.Anti-apoptotic and anti-inflammatory effects of hydrogen sulfide in a rat model of regional myocardial I/R[J].Shock,2009,31(3):267-274.
[6] Sodha NR,Clements RT,Feng J,et al.Hydrogen sulfide therapy attenuates the inflammatory response in a porcine model of myocardial ischemia/reperfusion injury[J].J Thorac Cardiovasc Surg,2009,138(4):977-984.
[7] 贺忠梅,张红霞,杨 敏,等.小鼠心肌梗死后补体系统激活与炎症反应的相关性研究[J].心肺血管病杂志,2014,33(1):98-102.
[8] Evora PR,Nather J,Tubino PV,et al.Curbing inflammation in the ischemic heart disease[J].Int J Inflam,2013,2013:183061.
[9] 樊 艳,王建军,魏 峰,等.脂肪间充质干细胞移植对心肌梗死后炎症反应及心室重构的影响[J].中国组织工程研究,2014,18(6):900-905.
[10] Hofmann U,Frantz S.How can we cure a heart“in flame”?A translational view on inflammation in heart failure[J].Basic Res Cardiol,2013,108:356.
[11]殷 然,王梦洪,郑泽琪,等.肝X受体抑制乳鼠心肌细胞缺氧/复氧损伤[J].中国病理生理杂志,2011,27(9):1671-1675.
[12]郭庆军,王桂敏,张秀秀.淫羊藿苷预处理对心肌缺血再灌注损伤炎症反应的影响[J].中国病理生理杂志,2013,29(11):2034-2038.
[13]司良毅,陈运贞,何国祥,等.细胞间黏附分子-1表达水平对心肌再灌注损伤的影响及N-乙酰半胱氨酸的保护作用[J].中华心血管病杂志,2000,28(1):65-68.
[14]Hohensinner PJ,Niessner A,Huber K,et al.Inflammation and cardiac outcome[J].Curr Opin Infect Dis,2011,24(3):259-264.
[15]卢 琳,贾如意.急性心肌梗死后心衰大鼠核因子-κB与炎性细胞因子的相关性研究[J].心脏杂志,2011,23(3):309-312.

