骨髓间充质干细胞对重症哮喘患儿外周血Th17/Treg的免疫调节作用*
黄雪琼, 檀卫平, 吴葆菁, 蓝 丹, 吴海飞, 麦贤弟
哮喘是儿童常见的气道慢性炎症性疾病。以吸入性糖皮质激素或联合β2受体激动剂的传统手段能较好控制大多数轻中度哮喘患者。而对于部分重症患者,规范抗哮喘治疗仍难以达到良好疗效,其急诊就诊率和住院率分别为轻、中度哮喘患者的15倍和20倍,是增加哮喘治疗费用的重要原因之一[1]。辅助性T细胞17(T helper 17 cells,Th17)/调节性T细胞(regulatory T cells,Treg)失衡被证实在重度哮喘发病过程中起重要作用[2-3]。骨髓间充质干细胞(mesenchymal stem cells,MSCs)作为多能干细胞,具有多向分化性、高度增殖性、低免疫原性及免疫调节活性,成为近年来肺部疾病细胞治疗的研究热点[4]。本研究通过建立MSCs与重症哮喘患儿外周血T淋巴细胞体外共培养体系,探讨MSCs对Th17和Treg细胞的免疫调节作用,从而为以MSCs为基础的哮喘防治提供实验依据。
材料和方法
1 研究对象
入选病例为2012年10月~2013年10月在中山大学孙逸仙纪念医院儿科哮喘专科门诊急性发作期重度哮喘儿童20例,诊断标准均符合2008年中华医学会儿科学分会呼吸学组修订的《儿童支气管哮喘诊断与防治指南》中儿童支气管哮喘诊断标准[5]。样本采集均取得患儿家属或法定监护人的同意(签署知情同意书并取得伦理委员会的同意)。
2 试剂及仪器设备
白细胞介素17(interleukin-17,IL-17)和肿瘤转化生长因子 β(transforming growth factor β,TGF β)ELISA试剂盒,购自武汉华美科技有限公司;Trizol试剂盒购自TaKaRa;ABI MultiScribeTMReverse Transcriptase试剂盒和Power SYBR Green PCR Master Mix试剂盒均购自ABI;所有引物均由生工生物工程有限公司合成。ABI Cycler PCR仪;ABI Step One RT-PCR仪。
3 主要方法
3.1 骨髓MSCs的分离、培养及鉴定 肝素抗凝的健康成人骨髓10 mL,用等体积含15% 胎牛血清(fetal calf serum,FCS)的L-DMEM培养液稀释吹打混匀,接种于25 cm2塑料培养瓶内,置于37℃、5%CO2饱和湿度培养箱培养。第3~5天首次换液,此后每3 d换液1次。当细胞达80%融合单层后传代,细胞传代用含10%FCS的L-DMEM培养液。
取第3代和第5代 MSCs,以0.25%胰酶(含0.02%EDTA)消化成单细胞悬液,以PBS缓冲液洗涤3遍,调整细胞密度为1×109/L,分别加入光标记的抗体:anti-CD34-FITC、anti-CD45-FITC、anti-CD29-PE和anti-CD105-FITC,振荡混匀后室温下避光孵育15 min,应用流式细胞术分析样本中细胞相应标记抗原的阳性表达率。
3.2 外周血T淋巴细胞(T lymphocytes,TLC)的分离及培养 抽取入选研究对象的外周静脉血4 mL(EDTA抗凝),PBS等体积稀释,缓慢加入Ficoll淋巴细胞分离液上,2 500 r/min离心20 min;吸取中间白膜层,以PBS充分洗涤后,以2 000 r/min离心10 min,弃去上清后,加入RPMI-1640培养液重悬细胞,调整细胞密度为2×109/L。37℃、5%CO2孵箱内培养3 h后,吸取悬浮细胞为TLC。
3.3 CCK-8法检测MSCs对TLC增殖的影响 第3 ~5代的 MSCs经消化、计数后,按100 μL/well接种于96孔板,每组3个复孔,72 h待其贴壁后,经丝裂霉素C(25 μg/L)孵育30 min后,换为常规培养液;实验分为4个组:阴性对照组:TLC以2×105/L单独培养,未予植物血凝素(phytohaemagglutinin,PHA)刺激;阳性对照组:等量 TLC经 PHA刺激转化(50 μg/L);MSCs组:按每孔2 ×104、1 ×104、2 ×103和1×103个细胞密度接种MSCs于96孔板内;实验组:PHA 刺激下 MSCs与 TLC 按不同比例(1∶1、1∶2、1∶10和1∶20)直接接触共培养。72 h后加入CCK-8 10 μL/well,继续孵育 2 h,在 450 nm 波长处,酶联免疫检测仪测定各孔吸光度(A)值,并计算TLC增殖抑制率:1-(共培养组A值-MSCs组A值)/阳性对照组A值×100%。实验重复3次。
3.4 ELISA法检测细胞培养上清IL-17和TGF-β的含量 收集1∶2比例共培养体系培养上清及TLC单独培养上清,按IL-17和TGF-β定量检测试剂盒操作,每个样本和标准品均设2个复孔,记录酶标仪492 nm处数据。
3.5 qRT-PCR检测维甲酸相关孤儿核受体(retinoic acid-related orphan nuclear receptor C,RORC)及叉头框蛋白3(forkhead box protein 3,Foxp3)mRNA表达收集1∶2比例共培养体中悬浮细胞及TLC单独培养细胞,采用Trizol法提取RNA,ABI Script RT Kit合成cDNA,引物序列见表1。根据Real Master Mix(含SYBR Green I)配置PCR反应体系,95℃ 10 min,95℃ 15 s,60℃ 30 s,40个循环。反应结束,设定最佳阈值,获取扩增循环数(Ct值),根据标准曲线和斜率,用公式2-ΔΔCt方法进行相对定量,计算得出目的基因相对于管家基因GAPDH的量。
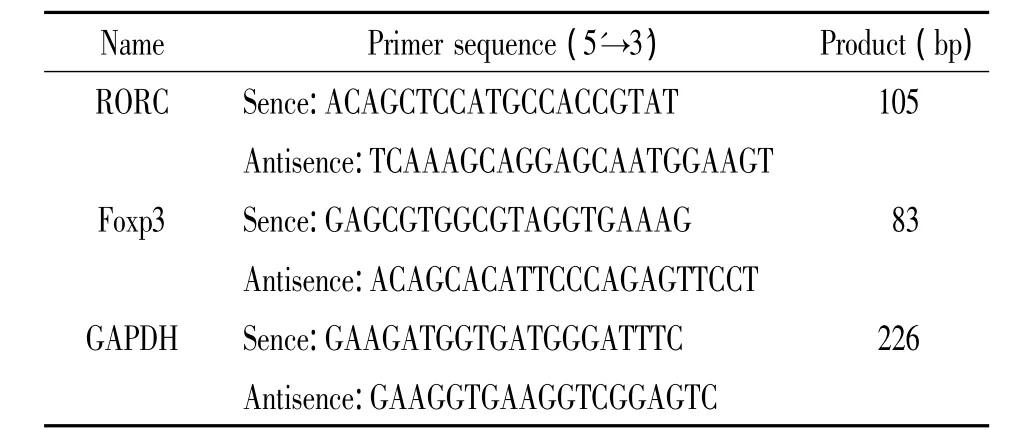
表1 引物序列Table 1.Sequences of the primers
4 统计学处理
采用SPSS 16.0软件处理,正态分布定量资料以均数±标准差(mean±SD)表示,组间均数比较采用t检验或方差分析。以P<0.05为差异有统计学意义。
结 果
1 MSCs的形态和表型
传代培养的MSCs为成纤维细胞样,形态均一、旋涡状生长。流式细胞仪检测第3和5代MSCs表面分子,绝大部分细胞均表达CD29和CD105,不表达 CD34 和 CD45,见图 1、2。

Figure 1.The 3rd passage of MSCs.A:×40;B:×100.图1 第3代骨髓间充质干细胞

Figure 2.Surface markers of CD29,CD105,CD45 and CD34 in MSCs.图2MSCs表型鉴定CD29、CD105、CD45及CD34
2 MSCs对TLC体外诱导增殖的影响
PHA刺激下MSCs与TLC共培养72 h,显微镜下观察到共培养组TLC生长稀疏,增殖受限,见图3。CCK-8法结果提示:4组不同浓度MSCs对TLC增殖的抑制具有统计学意义(P<0.05)。随着MSCs浓度的增高,其抑制能力逐步增强,见表2。

Figure 3.MSCs cocultured with TLC.A:×40;B:×100.图3MSCs与TLC共培养
3 MSCs对重度哮喘患儿外周血IL-17及TGF-β表达水平的影响
MSCs+TLC共培养组IL-17表达水平较TLC单独培养组降低,差别有统计学意义(P<0.05);而共培养后TGF-β表达水平明显升高,差别具有统计学意义(P <0.05),见表3。
4M SCs对重度哮喘患儿外周血RORC mRNA及Foxp3 mRNA表达水平的影响
MSCs+TLC共培养组RORC mRNA表达水平较TLC单独培养组明显减低,差别有统计学意义(P<0.05);共培养组Foxp3 mRNA表达与TLC单独培养组比较差异无统计学意义(P>0.05),见表4。
讨 论
重度哮喘是一种免疫紊乱的变态反应性疾病,常表现为持续性气道炎症、气道重塑及糖皮质激素抵抗性,常规治疗效果欠佳。近年来,淋巴细胞亚群Th17/Treg失衡作为重度哮喘发病机制的重要环节受到广泛关注。课题组以往资料显示,重度哮喘患儿体内Th17细胞过度活化,占优势地位,而Treg细胞数目相对减少及功能低下导致Th17/Treg失衡,加重哮喘的发生发展,与哮喘气道重塑密切相关[6-7]。 Th17与Treg细胞的分化成熟分别受其上游转录因子RORC及Foxp3表达水平调控,而IL-17与TGF-β则分别是二者重要的效应因子。通过调控Th17/Treg之间的平衡,恢复免疫自稳状态,缓解炎症反应,将为哮喘的治疗提供新思路。
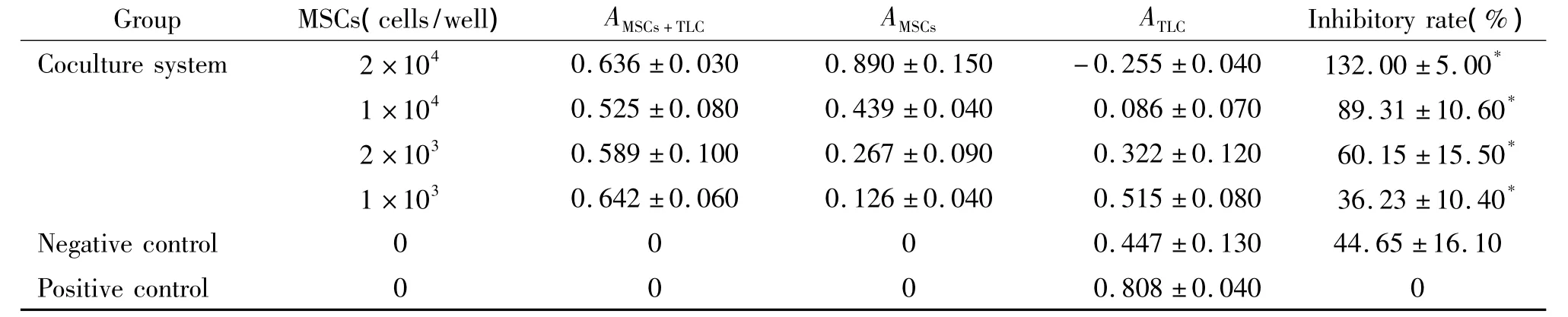
表2 MSCs对PHA刺激下TLC增殖的影响Table 2.Effect of MSCs on the proliferation of T lymphocytes(TLC)stimulated by PHA(Mean±SD.n=9)

表3 2组培养上清IL-17及TGF-β的分泌情况Table 3.Secretion of IL-17 and TGF-β in supernatants of the 2 groups(ng/L.Mean±SD.n=20)
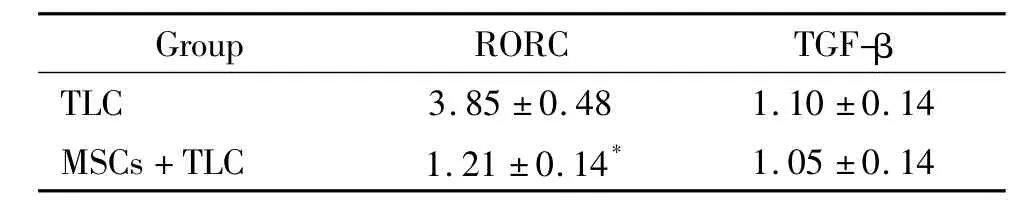
表4 重度哮喘患儿外周血RORC及Foxp3 mRNA表达Table 4.The mRNA expression of RORC and Foxp3 in children with severe bronchial asthma(Mean±SD.n=20)
MSCs广泛存在于全身结缔组织和器官间质中,具有强大的抗炎和免疫调节作用,被广泛应用于炎症性疾病和自身免疫疾病的动物实验及临床研究中[8-10]。本实验通过MSCs与重度哮喘患儿外周血TLC的共培养,探讨MSCs对Th17和Treg细胞效应因子IL-17、TGF-β 及转录因子 RORC、Foxp3 mRNA表达的影响。
近年研究表明,MSCs在体外能够有效抑制TLC的增殖反应。Djouad等[11]证实MSCs能明显抑制共培养体系中TLC的增殖活性,且在一定浓度范围内呈量效和时效正比关系。本实验结果表明,MSCs对PHA刺激下重度哮喘患儿外周血TLC增殖具有显著抑制作用,且随着MSCs数量的增加,抑制作用也同步增强,具有一定的剂量依赖性,与大多数研究相符合。
以往研究显示,MSCs在不同体外培养环境对TLC的免疫调节作用不尽相同。Ghannam等[12]研究发现MSCs不仅能抑制原始CD4+T细胞向Th17细胞方向分化,减少IL-17和IL-22水平,并且通过诱导Foxp3的转录增加Treg细胞数量,从而发挥抗炎作用。而 Kapoor等[13]将过敏性哮喘患者的外周血单个核细胞给予螨虫致敏后,与MSCs共培养,发现MSCs减少IFN-γ、上调IL-10水平的同时,Treg细胞数量没有明显改变,成熟树突状细胞反而明显增加,提示MSCs可能通过促进成熟树突状细胞而非Treg细胞的生成达到抗炎效果。本实验发现,MSCs与PHA刺激下重度哮喘患儿外周血TLC直接接触共培养后,Th17细胞转录因子RORC mRNA和效应因子IL-17均表达减少,提示MSCs可能通过抑制Th17细胞定向分化并下调IL-17的分泌,进而减少重度哮喘患儿体内的中性粒细胞炎症反应。另外我们还发现,MSCs上调TGF-β水平的同时,对Treg细胞调控基因Foxp3 mRNA表达并无明显影响,证实了TGF-β是MSCs发挥免疫调节作用的重要因子。本研究显示,MSCs对重度哮喘患儿的免疫调节作用并非通过上调Treg细胞的定向分化,可能通过高分泌TGF-β来抑制T、B淋巴细胞的增殖及巨噬细胞的活化,抑制CD4+T细胞亚群向Th17方向极化,从而纠正Th17/Treg失衡。
[1] Polosa R,Beneath GT.Managing patients with chronic severe asthma:Rise to the challenge[J].Eur J Intern Med,2009,20(2):114-124.
[2] Al-Ramli W,Préfontaine D,Chouiali F,et al.TH17-associated cytokines(IL-17A and IL-17F)in severe asthma[J].J Allergy Clin Immunol,2009,123(5):1185-1187.
[3] Weaver CT,Hatton RD.Interplay between the TH17 and TRegcell lineages:a(co-)evolutionary perspective[J].Nat Rev Immunol,2009,9(12):883-889.
[4] 甄国华,刘红梅,张珍祥,等.骨髓间充质干细胞移植对木瓜蛋白酶和[60Co]照射所致大鼠肺气肿的作用[J]. 中国病理生理杂志,2008,24(8):1529-1533.
[5] 中华医学会儿科学分会呼吸学组.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,46(10):745-753.
[6] 黄雪琼,檀卫平,麦贤弟,等.哮喘患儿外周血RORC和Foxp3 mRNA表达水平的变化及其意义[J].中山大学学报:医学科学版,2012,33(2):190-194.
[7] 黄雪琼,檀卫平,王东烨,等.哮喘患儿外周血 RORC mRNA、IL-17水平及其与气道重塑的关系研究[J].新医学,2014,45(2):104-107.
[8] Beyth S,Borovsky Z,Mevorach D,et al.Human mesenchymal stem cells alter antigen-presenting cell maturation and induce T-cell unresponsiveness[J].Blood,2005,105(5):2214-2219.
[9] Augello A,Tasso R,Negrini SM,et al.Cell therapy using allogeneic bone marrow mesenchymal stem cells prevents tissue damage in collagen-induced arthritis[J].Arthritis Rheum,2007,56(4):1175-1186.
[10]Zappia E,Casazza S,Pedemonte E,et al.Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy[J].Blood,2005,106(5):1755-1761.
[11] Djouad F,Plence P,Bony C,et al.Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals[J].Blood,2003,102(10):3837-3844.
[12] Ghannam S,Pene J,Torcy-Moquet G,et al.Mesenchymal stem cells inhibit human Th17 cell differentiation and function and induce a T regulatory cell phenotype[J].J Immunol,2010,185(1):302-312.
[13] Kapoor S,Patel SA,Kartan S,et al.Tolerance-like mediated suppression by mesenchymal stem cells in patients with dust mite allergy-induced asthma[J].J Allergy Clin Immunol,2012,129(4):1094-1101.

