DADLE对大鼠急性全脑缺血再灌注继发肺损伤的作用*
黄伟青, 刘升明, 武 钊, 郑埕斌, 郭 伟, 梁 庆
急性全脑缺血为急诊医学常见急症之一,主要病因为急性脑卒中,心脏骤停(猝死)、颅脑创伤等。及时予以再灌注是治疗的关键,但脑血流的恢复除可能对正常或缺血的脑组织产生破坏作用,导致进一步的组织损伤和功能障碍外,还可诱发远隔重要脏器的损伤[1]。根据病灶大小、病变部位和受损程度的不同,可有不同程度的心脏或(和)肺脏损害的表现,严重者常危及患者生命。目前报道较多的是对心脏(脑心综合征)的继发损害研究[2],而对继发肺损伤的研究报道较少。目前抑制再灌注损伤及保护继发脏器损伤成为治疗急性脑缺血再灌注的主要环节,但用于临床且有明确疗效的靶向药物尚缺乏。
DADLE(D-Ala2-D-Leu5-enkephalin)的分子式为C29H39N507,作为被克隆的一种G蛋白偶联受体,是目前国外研究较为深入的δ阿片受体激动剂。近年来在国外对DADLE保护缺血再灌注脏器方面有较多研究,通过实验中发现,DADLE可以提高组织氧利用率及维持组织氧代谢平衡从而减轻组织缺氧造成的能量代谢紊乱,减少细胞和组织的损伤[3]。本研究通过改良的二血管阻断加低血压法建立大鼠急性全脑缺血再灌注模型,于再灌注前经由左侧颈静注射DADLE进行干预,在光镜和电镜下观察肺损伤情况,通过检测肺损伤超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛 (malondialdehyde,MDA)含量的变化,评估其对肺组织的保护作用。
材料和方法
1 实验动物分组
健康雌性SD大鼠30只,体重180~220 g,购自广州中医药大学动物实验中心。于广州医科大学实验动物中心喂养,由专人单笼饲养,明暗周期12 h,自由取食(喂以商用鼠饲料)和饮水,房间温度25℃左右,湿度50%左右。实验单位使用许可证编号:SYXK(粤)2010-0104,许可证号 SCXK(粤)2013-0002。适应性饲养1周后大鼠随机分为3组:包括假手术(sham)组、模型(I/R)组和DADLE处理组,每组10只。
2 试剂与仪器
δ阿片受体激动剂DADLE和戊巴比妥钠购自Sigma;低分子肝素注射液购自江苏万邦生化医药股份有限公司;SOD检测试剂盒和MDA检测试剂盒均由南京建成生物工程研究所研制。
3 实验方法
3.1 二血管阻断加低血压建立大鼠全脑缺血再灌注模型的建立 取禁食12 h的SD大鼠,先用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,仰卧位绑在大鼠固定板上,之后每小时追加2%戊巴比妥钠(10 mg/kg)维持麻醉状态。左侧腹股沟区消毒备皮,剪开腹股沟处皮肤,分离左侧股动脉后采用静脉留置针行动脉插管,右侧股动脉以相同的方法行动脉插管。利用生物机能实验系统监测记录动脉血压。颈部备皮,颈部正中剪开皮肤,用弯镊自气管旁肌肉和胸锁乳突肌之间钝性分离双侧颈总动脉和左侧颈静脉,穿线备用,注意避免损伤迷走神经。在左侧股动脉留置针分次放血使血压保持在30~40 mmHg,观察动物呼吸,维持呼吸平稳,微型动脉夹夹闭双侧颈总动脉,脑电图波形保持平直时为脑缺血成功的标志,在缺血15 min末解除动脉夹,同时通过股动脉分次回输血液进行再灌注至血压达到正常水平。再灌注期时间为120 min。经左侧颈静脉插管建立体外给药途径。DADLE处理组为再灌注前颈静脉注射5 mg/kg的DADLE。Sham组除不做血管夹闭、不抽血和不给药外,其余操作与模型组相同。
3.2 肺组织病理学的检测 光学显微镜观察:取左上肺组织,在10%甲醛固定液中固定24 h,进行脱水、透明、浸蜡、石蜡包埋、切片,苏木精-伊红染色后在光学显微镜下观察肺组织形态学改变。电镜观察:取<1 mm×1 mm×1 mm的组织块。2.5%戊二醛(磷酸缓冲液配制)固定2 h。用0.1 mol/L磷酸漂洗液漂洗15 min×3次。1%锇酸固定液固定2~3 h。用0.1 mol/L磷酸漂洗液漂洗15 min×3次。用乙醇-丙酮系列梯度脱水后Epon-812包埋,超薄切片机切片50~60 nm。3%醋酸铀-枸橼酸铅双染色,透射电镜观察、拍片。
3.3 PaO2的测定 抗凝注射器右侧股动脉取血0.5~1 mL,通过全自动血气分析仪测定PaO2后采用公式PaO2/FiO2计算氧合指数。
3.4 肺组织SOD和MDA的检测 取右肺组织各3块,大小为3 mm×4 mm×3 mm,上、中、下肺叶各取1块。用超声匀浆机(19 000 r/min)制成10%肺匀浆,4℃、3 000 r/min离心10 min,取上清液,采用硫代巴比妥酸法检测肺组织中MDA含量,用邻苯三酚自氧化抑制法测定SOD的活性,SOD和MDA采用酶标仪测定吸光度,所取波长分别为570 nm和540 nm,按照试剂说明书的计算方法检测SOD活性及MDA含量。
4 统计学处理
实验数据使用SPSS 19.0统计学软件进行分析,计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠肺组织的光镜观察
Sham组肺组织肉眼观察表面呈均匀粉红色,胸膜光滑,弹性好,切面无明显液体溢出。光镜下肺泡结构完整,肺泡腔内无液体渗出。肺泡间隔无增宽,间质无炎症细胞浸润,毛细血管内未见透明血栓,无坏死形成,见图1A。
I/R组肺组织肉眼观察表面呈暗红色,尤以两下肺为明显,胸膜尚光滑,弹性较差,切面可见大量血性泡沫样液体溢出。光镜下可见胸膜下广泛出血。肺泡腔内可见出血、水肿液渗出。肺泡间隔明显增宽,间质充血、水肿,弥漫性中性粒细胞浸润。并见散在毛细血管内透明血栓形成,局灶坏死,细胞核消失,肺泡壁破坏,但肺泡轮廓保留,肺泡塌陷,见图1B。

Figure 1.Light microscopic images of the lung tissues exposed to ischemia/reperfusion(I/R)stress(HE staining,scale bar=50 μm).A:sham group;B:I/R group;C:DADLE group.图1 光镜观察缺血再灌注继发的肺损伤组织改变
DADLE处理组显示肺损伤有一定程度的减轻,光镜下可见肺泡壁大部分完好,间质充血、水肿,肺泡腔出血、水肿减少,仅有少量中性粒细胞浸润,偶见毛细血管内透明血栓。坏死灶数目和范围减少,见图1C。
2 各组大鼠肺组织电镜下超微结构的改变
Sham组可见毛细血管内皮细胞结构正常,连接紧密,基底膜完整,线粒体嵴清楚,板层小体数量未见改变,微绒毛完整,见图2A。
I/R组可见毛细血管腔内见多形核中性粒细胞(polymorphonuclear neutrophils,PMN)堵塞。Ⅱ型上皮细胞表面微绒毛明显减少,线粒体肿胀,板层小体减少,出现较多空泡。肺间质水肿,可见PMN浸润,见图2B。
DADLE处理组可见基底膜基本完整,线粒体结构基本正常,少数有水肿。肺泡Ⅱ型上皮细胞形态结构无明显异常。微绒毛无明显脱落,线粒体肿胀不明显,板层小体无明显减少;肺泡间质内未见明显的PMN浸润,见图2C。
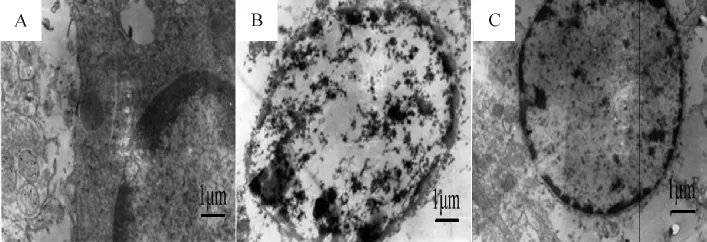
Figure 2.Transmission electron microscopic images of the lung tissue exposed to ischemia/reperfusion(I/R)stress(scale bar=1 μm).A:sham group;B:I/R group;C:DADLE group.图2 电镜观察缺血再灌注继发肺损伤组织改变
3 各组血氧分压和氧合指数的变化结果
I/R组大鼠动脉血氧分压(PaO2)和氧合指数(PaO2/FiO2)明显降低,与sham组比较差异有统计学意义(P<0.05);DADLE处理组动脉血氧分压和氧合指数有升高趋势,与I/R组比较差异有统计学意义(P <0.05),见表1。

表1 各组大鼠动脉血氧分压和氧合指数的比较Table 1.The changes of rat arterial blood oxygen partial pressure(PaO2)and oxygenation index(OI)(Mean±SD.n=10)
4 大鼠肺组织MDA含量和SOD活性的变化
各组处理大鼠的肺组织SOD活性及MDA浓度结果见表2。与假手术组比较,模型组大鼠肺组织MDA浓度升高,而SOD活性降低,有显著差异(P<0.05)。与模型组比较,DADLE处理组可使损伤肺组织中SOD活性有所升高,并降低MDA浓度。SOD活性和MDA含量变化均有显著差异(P<0.05)。

表2 大鼠肺组织MDA含量和SOD活性的变化Table 2.The changes of MDA level and SOD activity in the rat lung tissues(Mean±SD.n=10)
讨 论
国内外实验研究显示急性全脑缺血性再灌注损伤的机制,主要有缺血缺氧与能量代谢异常、兴奋性氨基酸毒性、超氧阴离子的损伤机制、细胞内钙超载、无复流现象、细胞因子、凋亡等,其中研究较多的是细胞因子与神经元凋亡机制[2-3]。但是,急性全脑缺血再灌注损伤不仅引起脑组织不同程度的损伤,而且还可诱发远隔重要脏器的损伤,尤其是心肺损伤[4]。Pelosi等[5]报道在颅脑损伤患者中,脑外器官功能不全最常见的器官为肺。可能机制为:(1)神经源性肺水肿;(2)通气-血流比例失调;(3)实质性结构损害,包括呼吸方式的改变、炎症介质儿茶酚胺的释放以及作为感染或创伤的直接结果。实验研究证实急性脑缺血早期可导致肺损伤,损伤后肺组织出现典型的病理生理改变,主要表现为肺水肿和炎症变化。
本实验观察到在急性全脑缺血性再灌注损伤中肺脏的光镜和电镜病理表现为肺微血管内皮细胞肿胀、结构破坏、发生凋亡或坏死,由中性粒细胞为主介导的肺脏局部炎症反应致肺毛细血管通透性增高,肺泡液渗出,形成富含蛋白质的肺水肿及透明膜形成,表明在急性大鼠全脑缺血再灌注可致肺损伤,与文献报道中该动物模型的死亡大鼠病理表现相吻合[6-7]。但该动物模型中并发肺损伤的死亡率,在国内外文献报道未见明确阐述,尚需进一步探讨。
实验研究已表明δ受体激动剂能显著提高心肌的舒张功能,具有提高组织氧利用率、维持组织氧代谢平衡的作用,对缺血心肌有保护作用[3]。目前尚未见关于δ阿片受体激动剂对急性全脑缺血性再灌注损伤所致的远隔脏器肺损伤的保护作用研究。本实验的观察结果表明应用DADLE治疗后,光镜及电镜下可见肺泡壁大部修复,间质肺泡水肿减少,仅有少量中性粒细胞浸润,肺损伤有一定程度的减轻,表明DADLE治疗可为缺血缺氧的肺组织提供保护作用。DADLE处理组动脉血氧分压、氧合指数有升高趋势,与I/R组比较差异有统计学意义。
自由基对生物大分子的氧化作用可导致细胞损伤,而SOD是一类金属酶,分布于生物体各组织内,能清除机体内过多的超氧阴离子自由基[6]。本实验表明脑缺血再灌注的肺组织内SOD活性降低,MDA含量升高。MDA是生物膜系统脂质过氧化损伤反应的一种产物,是反映机体氧化损伤程度经典有效指标之一[7]。急性大鼠全脑缺血再灌注可致大量的脂质过氧化物产生,同时机体清除氧自由基的能力明显下调。这些活性氧损伤肺泡上皮细胞和肺毛细血管细胞,使肺泡毛细血管膜的屏障功能减弱,对液体和大分子物质的通透性增高,形成肺水肿[8]。为了研究DADLE减轻肺损伤的作用机制,我们检测了肺组织SOD活性及MDA水平。结果表明DADLE治疗可升高损伤肺组织的SOD活性,并降低MDA浓度。
文献报道DADLE可能通过多种机制抗细胞缺氧损伤作用,DADLE可增加ERK途径酪氨酸激酶的磷酸化水平,降低了缺氧无糖性细胞损伤诱发的p38的磷酸化,且ERK磷酸化和p38磷酸化处于动态平衡中[9-10]。从而减轻肺组织缺氧造成的能量代谢紊乱,减少细胞和组织损伤的作用,从而减轻肺组织细胞水肿,减轻全脑缺血再灌注的肺损伤[11]。
DADLE在急性脑缺血再灌注损伤对神经系统及心血管系统的作用在不少实验研究已得到证实,但对后继性肺组织损伤的影响较少报道。本研究结果显示DADLE能减轻该模型中的肺损伤,具有一定的保护作用,但其对死亡率有何影响,是我们将进一步深入探讨的问题。
[1] 张 琳,吕俊刚,徐海丽.脑卒中合并脑心综合征的研究进展及临床分析[J].医学综述,2010,16(18):2769-2771.
[2] Xu Z,Xu RX,Liu BS,et al.Time window characteristics of cultured rat hippocampal rat hippocampal neurons subjected to ischemia and reperfusion[J].Chin J Traumatol,2005,8(3):179-182.
[3] Chung SP,Song FQ,Yu T,et al.Effect of therapeutic hypothermia vs δ-opioid receptor agonist on post resuscitation myocardial function in a rat model of CPR[J].Resuscitation,2011,82(3):350-354.
[4] 梁彦涛.脑心综合征的研究进展[J].中国现代药物应用杂志,2010,4(6):230-232.
[5] Pelosi P,Severgnini P,Chiaranda M.An integrated approach to prevent and treat respiratory failure in brain-injured patients[J].Cur Opin Crit Care,2005,11(1):37-42.
[6] 唐成武,鲍 鹰,朱 鸣,等.δ阿片受体激动剂对脓毒症大鼠肺功能的保护作用[J].华中科技大学学报:医学版,2009,38(6):796-799.
[7] Zhang J,Qian H,Zhao P,et al.Rapid hypoxia preconditioning protects cortical neurons from glutamate toxicity through δ-opioid receptor[J].Stroke,2006,37(4):1094-1099.
[8] Ma MC,Qian H,Ghassemi F,et al.Oxygen-sensitive δopioid receptor-regulated survival and death signals:novel insights into neuronal preconditioning and protection[J].J Biol Chem,2005,280(16):16208-16212.
[9] 郭建荣,岳 云,崔健君,等.异丙酚对缺血再灌注损伤大鼠海马氨基酸递质水平变化及神经元凋亡的影响[J].中国病理生理杂志,2007,23(8):1547-1500.
[10] Endo H,Kamada H,Nito C,et al.Mitochondrial translocation of p53 mediates release of cytochrome C and hippocampal CA1 neuronal death after transient global cerebral ischemia in rats[J].J Neurosci,2006,26(30):7974-7983.
[11]刘慧敏,崔 鹤,刘亚君,等.缺血预处理经抑制p53表达减轻缺血再灌后大鼠海马神经元损伤[J].中国病理生理杂志,2006,22(3):515-519.

