非水毛细管电泳检测辣椒粉中苏丹红
黄 露
非水毛细管电泳检测辣椒粉中苏丹红
黄 露
(闽江学院化学与化学工程系,福建,福州 350108)
首次采用非水毛细管电泳法对两种苏丹红染色剂-苏丹红I与苏丹红II进行了分离检测。考察了电泳介质、背景电解质、SDS浓度对分离的影响。当运行缓冲液为100 mmol/L乙酸钠+35 mmol/L SDS的乙腈/甲醇(6:4,v/v)混合溶液时,两种苏丹红化合物能够在15 min内达到基线分离。各组分的峰面积与待测物浓度在0.01~0.5 mg/mL范围内呈良好的线性关系,检测限均为0.005 mg/mL。最终检测到辣椒样品中含有苏丹红II浓度为3.040 mg/g,苏丹红I与苏丹红II在加标辣椒样品中的回收率分别为94.68%和81.00%。
非水毛细管电泳;辣椒粉;苏丹红I;苏丹红II
苏丹红是一种人工合成的染料,在食品中是非天然存在的。毒理学研究表明:苏丹红类染色剂具有致癌毒性[1],如果人体长期较大剂量地摄入,就会在体内累积而对肌体造成损伤或基因突变而致癌,其代谢产物可能会引起肝脏、膀胱、脾脏等脏器的肿瘤[2-3]。因此,许多国家(包括中国)已经禁止在食品中添加该类物质。但是,仍有不法商家在利益的驱使下将其作为食品添加剂使用。因而,加强食品中苏丹红的检测工作,对于保证食品安全具有重大的现实意义。
苏丹红的检测方法很多,主要是液相色谱法[4-8]和气相色谱法[9]。在诸多的检测方法中,毛细管电泳法在样品用量、实验成本及消耗方面具有很大优势。Mejia等[10]应用胶束电动色谱法在20分钟内实现了四种苏丹红类染色剂的分离检测,线性范围为0.5~36 μg/mL,检出限为96.5~609.8 μg/mL。鉴于苏丹红类染色剂为疏水性化合物,且目前尚无关于使用非水毛细管电泳分离检测苏丹红类染色剂的报道,因此本研究拟采用非水毛细管电泳法对两种苏丹红染色剂-苏丹红I与苏丹红II进行分离检测。考察各实验因素对分离的影响,得到最优化的分离检测条件。采用超声波萃取方法对辣椒粉样品进行前处理,并在最优化的分离检测条件下,对所处理的样品进行检测。
1 实验部分
1.1 仪器和试剂
1.1.1 实验仪器
CAPEL 105型毛细管电泳仪(俄罗斯刘梅克斯公司)和色谱工作站;BSZ10S分析天平(北京赛多利斯仪器系统有限公司);RE-52C旋转蒸发仪(巩义市予华仪器有限责任公司);循环水式真空泵(巩义市予华仪器有限责任公司);电热恒温鼓风干燥箱(上海中友仪器设备有限公司);KQ-250B型超声波清洗器(昆山市超声波仪器有限公司)。
1.1.2 实验试剂
标准物质苏丹红I、II(国药集团化学试剂有限公司);分析纯无水乙酸钠、磷酸二氢钠、磷酸氢二钠、乙酸铵、硼酸、柠檬酸、氢氧化钠(上海成海化学工业有限公司),以及分析纯盐酸、冰乙酸、正己烷、甲醇、乙腈、丙酮(天津市福晨化学试剂厂);分析纯十二烷基硫酸钠(SDS)(ACROS化学试剂公司);辣椒粉购自超市(福州德源食品有限公司);实验室用水为娃哈哈纯净水。
1.2 实验方法
标准溶液的配制:分别称取1.0 mg苏丹红I与苏丹红II,溶于丙酮/甲醇(1:4,v/v)混合溶液中,配制为1 mg/mL母液,置冰箱中避光保存备用。使用前,分别取定量的苏丹红I与苏丹红II母液,用运行缓冲液稀释至所需浓度。
辣椒粉样品的处理[11]:精确称取干燥辣椒粉1.00 g于三角瓶中,然后加入正已烷萃取剂,液固比为20:1(mL/g),用超声波进行萃取30 min,之后对萃取液进行抽滤,用萃取剂洗涤残渣,直至流出的洗涤液呈无色,合并洗涤液,旋转减压蒸干,用甲醇定容至1 mL。
毛细管电泳检测参数:采用压力进样,进样压力35 mbar,进样时间10 s,分离电压25 kV,分离温度25℃,紫外检测波长260 nm。每天实验前后,分别用高纯水冲洗毛细管3 min,0.1 mmol/L NaOH冲洗 5 min,高纯水冲洗5 min后。进样间隔用缓冲液冲洗3 min。
2 结果与讨论
2.1 分离条件的优化
2.1.1 电泳介质的选择
实验考察了水、甲醇、已腈作为电泳介质对样品组分峰形的影响。结果表明,纯水易导致毛细管堵塞,纯甲醇使得出峰时间过长,纯乙腈使得出峰时间过短从而不利于样品组分的分离。最后确定将乙腈与甲醇比例为6:4的混合溶液作为电泳介质,此时出峰时间较短,分离度较好。
2.1.2 背景电解质的选择
实验考察了乙酸钠、磷酸二氢钠、磷酸氢二钠、乙酸铵、硼酸、柠檬酸钠作为背景电解质对分离的影响。结果表明,使用乙酸钠作背景电解质时,两种苏丹红染色剂的分离效果相对较好,出峰时间较短。所以选择乙酸钠作为背景电解质。
实验进一步考察了乙酸钠浓度(分别为50、75、100、125 mmol/L)对迁移时间及峰面积的影响。结果发现,随着乙酸钠浓度的增大,迁移时间基本不变,而分离趋势越来越大,当乙酸钠深度为100 mmol/L时峰形最狭窄,峰高最高,峰面积最大,基线能达到基本分离。因此,最后选择100 mmol/L乙酸钠作为背景电解质。
2.1.3 SDS浓度的选择
在未添加SDS或SDS浓度较低时,分离效果不明显或者较差。实验分别考察了20、25、30、35、40 mmol/L SDS对分离的影响(如图1所示)。从图中可以看出,随着SDS浓度的增大,迁移时间基本不变,但苏丹红I与苏丹红II的分离趋势逐渐增大,峰形变狭窄,各峰面积也越来越大。当SDS浓度为40 mmol/L时由于溶解性问题SDS易析出,因此选择35 mmol/L为SDS最佳浓度。
综合上述实验,得到最佳分离条件为:100 mmol/L乙酸钠,35 mmol/L SDS,乙腈/甲醇(6:4,v/v)。
实验条件:运行缓冲液为100 mmol/L乙酸钠的乙腈/甲醇(6:4,v/v)混合溶液。苏丹红I、II浓度均为0.01 mg/mL。第一个峰是苏丹红II,第二个峰是苏丹红I。

图1 SDS浓度对分离的影响
2.2 标准曲线及重现性
以标准液浓度和相应的峰面积绘制标准曲线。苏丹红I与苏丹红II的回归方程、相关系数、线性范围以及检测限见表1。从表中可看出,该方法的检测线性范围广,且灵敏度高。
在最优条件下进行重现性实验。日内分析:将0.01 mg/mL混合标准溶液在同一天内重复进样3次进行分析实验;日间分析:将0.01 mg/mL混合标准溶液在三天内进样3次进行实验。苏丹红I与苏丹红II的日内相对标准偏差为1.48%~2.16%,而日间相对标准偏差为1.63%~2.49%,证明了该方法重现性良好。
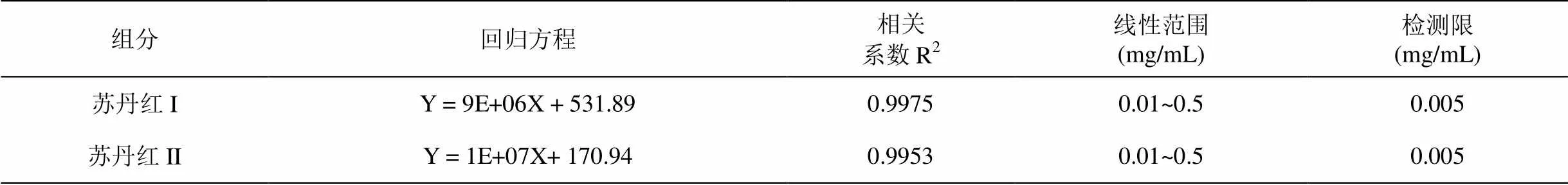
表1 回归方程、线性范围和检测限
2.3 辣椒粉样品的测定

图2 空白辣椒粉样品的毛细管电泳图
实验条件:运行缓冲液为100 mmol/L乙酸钠+35 mmol/L SDS的乙腈/甲醇(6:4,v/v)混合溶液,进样时间10 s,分离电压25 kV,检测波长260 nm。1为苏丹红II号。

图3 加标辣椒粉样品的毛细管电泳图
实验条件如图2所示。1,苏丹红II号;2,苏丹红I号。
空白辣椒粉样品的测定:辣椒粉样品按照1.2部分所述方法进行处理后,使用毛细管电泳法在最佳实验条件下进行分离检测(如图2所示)。
加标辣椒粉样品的分析检测:往辣椒粉中添加苏丹红I号、苏丹红II号这两种分析物,按照1.2部分所述方法进行处理后,使用毛细管电泳法在最佳实验条件下进行分离检测(如图3所示)。
实验表明:购买的辣椒粉中添加了非法添加剂苏丹红II号,含量为3.04 mg/g。苏丹红I号与苏丹红II号的加标回收率(添加浓度0.01 mg/mL,n=3)分别为94.68%和81.00%。数据表明本方法是准确、可靠的。
3 结论
本研究应用非水毛细管电泳法建立了苏丹红I与苏丹红II的分离检测体系,并成功将其应用于实际样品的检测。与他人方法相比[10],本研究建立的方法分析时间稍短,灵敏度不高,优势在于对于实际样品的测定。在文献[10]所提供的样品测定中,处理过的样品需要经由背景缓冲液稀释10倍后再进行检测,这实际上降低了方法的最后检出限,而本研究建立的方法可以直接将处理后的样品不经任何稀释直接进行检测。
[1] 卫生部.苏丹红危险性评估报告[J].中国食品卫生杂志, 2005,17(5):276-278.
[2] Stiborová M, Martinek V, Rydlová H, et al. Hodek expression of cytochrome P450 1A1 and its contributon to oxidation of potential human carcinogen, 1-phenylazo-2-naphthol(SudanⅠ)in human livers [J]. Cancer Letters, 2005, 220 (2): 145-155.
[3] 季宇彬,汲晨锋,高世勇,等.苏丹红Ⅰ、Ⅲ和Ⅳ对HepG-2细胞核SGC-7901细胞增殖的影响[J].环境科学,2006, 27 (6):1201-1207.
[4] Calbiani F, Careri M, Elviri L, et al. Accuratemass measure-ments for the confirmation of sudan azo-dyes in hot chilli products bycapillary liquid chromatography-electrospray tandemquadrupole orthogo- nal-acceleration time of flight mass spectrometry [J]. Journal of Chromatography A, 2004, 1058: 127-135.
[5] 谢维平,黄盈煌,傅晖蓉.凝胶柱净化—高效液相色谱法检测苏丹红[J].色谱,2005,23(5):543-544.
[6] Habibi M H, Hassanzadeh A, Mahdavi S. The effect of operational parameters on the photocatalytic degradation of three textile, dyes in aqueous TiO2suspensions [J]. Journal of Photochemistry and Photobiology A, 2005, 172 (1): 694-700.
[7] 吴银良,李摇存,刘勇军.高效液相色谱法快速测定鸭肉和鸭蛋中苏丹红染料[J].分析化学,2008,36 (6):843.
[8] Zhang Y T, Zhang Z J, Sun Y H. Development and optimization of an analytical method for the determination of Sudan dyes in hot chilli pepper by high-performance liquidchromatogr aphy with on-line electrogenerated Br0-luminol chemiluminescence detection [J]. Journal of Chromatography A, 2006, 1129: 34-40.
[9] 黄晓兰,吴惠勤,黄芳.GC-MS/SIM法同时测定食品中的苏丹红I~IV [J].分析测试学报,2005,24 (4):1-5.
[10] Mejia E, Ding Y, Mora M F, et al. Determination of banned sudan dyes in chili powder by capillary electrophoresis[J]. Food Chemistry, 2007, 102 (4): 1027-1033.
[11] 黄露.超声波萃取辣椒粉中苏丹红类染色剂的工艺研究[J].闽江学院学报,2013,14(2):105-107.
DETECTION OF SUDAN DYES IN CHILI POWDERS BY NONAQUEOUS CAPILLARY ELECTROPHORESIS
HUANG Lu
(Department of Chemistry and Chemical Engineering, Minjiang University, Fuzhou, Fujian 350108, China)
Nonaqueous capillary electrophoresis was applied in the separation and determination of Sudan dyes (Sudan I and Sudan II). The effects of the electrophoretic medium, background electrolyte and SDS concentration on the separation were investigated. When the running buffer was acetonitrile/methanol (6:4, v/v) containing 100 mmol/L sodium acetate and 35 mmol/L SDS, two Sudan red compounds could be basically separated and detected in 15 min. Excellent linearity was observed in the range from 0.01~0.5 mg/mL for these two analytes, and the detection limits were both 0.005 mg/mL. Finally, 3.040 mg/g of Sudan II was found in chili powders, and the recoveries of Sudan I and Sudan II in spiked chili powders were 94.68% and 81.00%, respectively.
nonaqueous capillary electrphoresis; chili powders; Sudan I; Sudan II
O657.8
A
10.3969/j.issn.1674-8085.2014.02.005
1674-8085(2014)02-0023-04
2013-12-12;
2014-01-06
福建省自然科学基金项目(2010J05029);福建省教育厅科技计划项目(JB11142)
黄 露(1983–),女,江西景德镇人,副教授,博士,主要从事毛细管电泳及色谱分离分析(E-mail:lulu5291@126.com).

