全柱成像毛细管等电聚焦电泳测定艾塞那肽等电点
刘洁欣,方均建,王心正,李海静,程建华,吴胜明,董方霆
国家生物医学分析中心,北京 100850
艾塞那肽是一种人工合成的含有39个氨基酸残基的新型糖尿病治疗药物,为胰高血糖素样肽-1类似物,对2型糖尿病患者的血糖有控制作用,能够促进胰腺β细胞增殖和胰岛素的分泌,抑制胰高血糖素的分泌及减缓胃排空[1]。美国食品药品监督管理局于2005年批准其上市,是近年来首个在全球范围内获批的新型治疗2型糖尿病的药物。等电点是多肽和蛋白质类药物质量控制的重要指征,它可以反映生物技术合成的多肽、蛋白质类药物的纯度和空间构象的均一性,以及生产过程中的可靠性,缺失肽、断裂肽、酰胺化/去酰胺化、氨基酸侧链的不完全脱保护[2]、多糖唾液酸化[3]等一些修饰都会改变样品的等电点,影响药物的生物活性。因此,等电点的准确测定对于多肽、蛋白类药物的质量控制和新药研发起着重要作用。
新一代的全柱成像毛细管等电聚焦电泳技术(capillary isoelectric focusing-whole column imag⁃ing detection,CIEF-WCID)[4-5]成功地解决了这一问题,这是一种将毛细管等电聚焦电泳与全柱成像技术相结合的新型电泳系统。当样品进行等电聚焦时,互补性金属氧化物半导体(complementary met⁃al-oxide-semiconductor translator,CMOS)作为成像检测技术,可以对整个聚焦分离通道、聚焦过程进行实时监控和记录,这个过程中不移动毛细管柱,也无须移动样品。该方法使得分析结果不受干扰,提高了样品等电点测定的准确度和重复性。并且通常能在几分钟内完成分析测定,所需时间大大缩短,可实现高通量检测。另外,CIEF-WCID在复杂样品等电点测定[6]、蛋白质纯度分析、蛋白质药物质量控制、蛋白质稳定性研究[7]、相对分子质量测定[8]、药物与蛋白质相互作用[9]等多个研究领域也有着重要的应用。
1 材料与方法
1.1 材料
艾塞那肽为国内公司生产;多肽(pI 6.60、7.40、8.50)、线性固相pH梯度胶条pI 3-10L购自BIORAD公司;载体两性电解质3-10、阳极电解液(0.1 mol/L H3PO4)、阴极电解液(0.1 mol/L NaOH)和marker(pI 4.65、5.91、6.14、6.61、7.05、7.40、7.90、8.18、9.22)均由 Advanced Electrophoresis Solutions公司提供;CEInfinite全柱成像毛细管等电聚焦电泳仪购自Advanced Electrophoresis Solutions公司;PROTEAN IEF Cell等电聚焦电泳仪购自BIO-RAD公司;Centrifuge 5415D离心机购自Eppordorf公司;实验用水均为Milli-Q(Millipore公司)系统制备。
1.2 待测样品
将艾塞那肽样品配制成浓度为0.125 mg/mL的溶液,取100 μL该溶液与100 μL载体两性电解质混合,加入marker(pI 4.65、6.14)各2 μL,充分混匀,13 200 r/min离心1 min后取上清进样3次。
1.3 CIEF-WCID电泳
全柱成像毛细管等电聚焦电泳仪中的毛细管柱一端连接自动进样器,另一端接入废液瓶中。当阴阳极电解液两端通入高压直流电后,载体两性电解质在毛细管柱内形成pH梯度,样品在50 mm的分离通道内根据所带电性向阳极或阴极移动,当样品移动到与其等电点相同的pH值时,该样品净电荷为零,即完成等电聚焦分离。
实验中采用自动进样器进样,上样量50 μL。等电聚焦过程设置为首先1000 V电压聚焦1 min,然后2000 V聚焦1 min,最后3000 V聚焦4 min。在聚焦过程中采用采用CMOS成像技术对毛细管柱进行全程动态成像检测,检测信号为紫外吸收强度。
1.4 凝胶等电聚焦电泳
在30 μg艾塞那肽样品中加入1.75 μL IPG缓冲液和348 μL重泡胀液,振荡混匀,离心后上样。等电聚焦过程为重泡胀1 h、30 V 10 h、500 V 30 min、2000 V 30 min、5000 V 30 min、8000 V 1 h、10 000 V 4 h,最后用考马斯亮蓝R250染色,50%甲醇脱色至条带清晰。
1.5 方法验证
1.5.1 准确性验证 采用BIO-RAD公司已知等电点的多肽验证检测方法的准确性。将已知等电点多肽(pI 6.60、7.40、8.50)分别稀释至1/25,取多肽样品各 22 μL、载体两性电解质300 μL,分别加入适宜marker各3 μL,充分混匀,13 200 r/min离心1 min后取上清进样。
1.5.2 重复性验证 将marker(pI 4.65、6.14、7.40)各4 μl加入400 μL载体两性电解质中,充分混匀,13 200 r/min离心1 min,取上清连续进样6次。
2 结果
2.1 准确性验证
将BIO-RAD公司已知多肽(pI 6.60、7.40、8.50)作为未知样品进行等电点的测定,图1为多肽(pI 6.60)等电聚焦电泳图,根据聚焦完成时等电点到两端marker的距离计算得到等电点为6.73,对参考值相对误差为1.97%。其他多肽等电点测定结果见表1,相对误差在2.5%以内,相对标准偏差均小于0.08%。以上结果表明该方法准确性良好,能够用于对未知样品的等电点测定。
2.2 重复性验证
对系统重复性进行了考察。图2为marker(pI 4.65、6.14、7.40)与两性电解质的混合溶液连续进样6次的等电聚焦电泳图,marker峰形和峰位无明显变化,峰位相对标准偏差均小于0.5%。重复性良好,表明该方法能够满足实验要求。
2.3 艾塞那肽等电点测定

图1 CIEF-WCID测定多肽(pI 6.60)电泳图(marker pI 5.91、7.05)

表1 CIEF-WCID测定3种多肽的等电点结果
CIEF-WCID因采用全柱成像技术,能够实时记录样品动态聚焦过程。图3为艾塞那肽的等电聚焦过程。在未聚焦时,样品均匀分布在毛细管中,开始聚焦后,样品由阳极和阴极向等电点处移动,到360 s时谱图不再改变,表明样品聚焦完全。实时全柱成像技术不仅可以显示蛋白质等电聚焦过程,而且可以及时反映聚焦是否完成,以避免聚焦时间过长引起蛋白质沉淀。
采用CIEF-WCID对艾塞那肽的等电点进行测定时,所用marker的pI为4.65和6.14,连续进样3次,结果如图4所示,分别测得艾塞那肽等电点为5.46、5.45和5.46,平均值为5.46,变异系数为0.11%,检测所需时间仅为6 min。另外,还采用凝胶等电聚焦电泳测定了艾塞那肽的等电点,结果如图5,电泳测得的艾塞那肽的等电点为5.40,所需时间为18 h,是CIEF-WCID方法的近200倍。结果表明,CIEF-WCID测定等电点的方法准确度和重复性均良好,而且相比凝胶等电聚焦电泳能大大缩短检测时间。

图2 marker(pI 4.65、6.14、7.40)连续进样6次CIEF-WCID电泳图
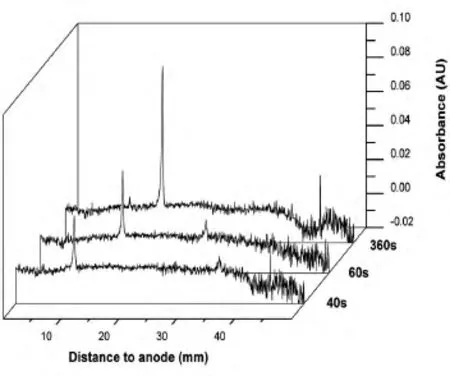
图3 CIEF-WCID测定艾塞那肽等电点的动态聚焦过程聚焦时间分别为40、60、360 s
3 讨论
CIEF-WCID是在毛细管等电聚焦电泳的基础上,采用全柱成像技术,聚焦和检测过程不移动毛细管柱即可实现对样品的检测,通过实时记录动态聚焦过程,确定最佳聚焦时间,使得检测结果更加真实可靠,且检测时间大幅度缩短。凝胶电泳与CIEFWCID相比,存在分析时间长、自动化程度低的问题;而传统的毛细管等电聚焦电泳虽然能克服这些不足,缩短检测时间,但由于检测器为单点检测器,聚焦完成后需要移动样品通过检测窗口,因此在移动的过程中可能会造成pH梯度改变、分辨率下降、蛋白质沉淀,从而影响分析测试结果[10]。本实验对CIEF-WCID方法的准确性进行了考察,对不同等电点的样品均能准确测定;在重复实验中,marker峰形和峰位基本无明显变化。这表明该技术准确度、重复性良好,能够应用于样品等电点的测定。对于艾塞那肽等电点的测定,CIEF-WCID与凝胶等电聚焦电泳结果之间无明显差别,但CIEF-WCID方法自动化程度高,可自动进样,对于聚焦过程可以实时记录,聚焦时间上也缩短至几十分之一,而且无需染色、脱色等步骤,比凝胶等电聚焦电泳方法更加方便快捷。综上所述,应用CIEF-WCID可以很好地对艾塞那肽等电点进行分析,所需时间短,准确性和重复性良好,相比于其他电泳技术具有高通量的优势,这将为多肽的质量控制提供一种更为高效的方法。

图4 连续3次CIEF-WCID测定艾塞那肽等电点结果

图5 凝胶电泳测定艾塞那肽等电点
[1]Nielsen L L,Young A A,Parkes D G.Pharmacology of ex⁃enatide(synthetic exendin-4):a potential therapeutic for im⁃proved glycemiccontroloftype 2 diabetes[J].Regul Pept.2004,117(2):77-88.
[2]国家食品药品监督管理局.合成多肽药物药学研究技术指导原则[S].2007.
[3]Dou P,Liu Z,He J,et al.Rapid and high-resolution glyco⁃form profiling of recombinant human erythropoietin by capil⁃lary isoelectric focusing with whole column imaging detection[J].J Chromatogr A,2008,1190(1):372-376.
[4]Wu J,Tragas C,Watson A,et al.Capillary isoelectric focus⁃ingwith wholecolumn detection and amembranesample preparation system[J].Anal Chim Acta,1999,383:67-78.
[5]Liu Z,Pawliszyn J.Capillary isoelectric focusing of proteins with liquid core waveguide laser-induced fluorescence whole column imaging detection[J].AnalChem,2003,75(18):4887-4894.
[6]Thomassen Y E,van Eikenhorst G,van der Pol L A,et al.Isoelectric point determination of live polioviruses by capillary isoelectric focusing with whole column imaging detection[J].Anal Chem,2013,85(12):6089-6094.
[7]Bo T,Pawliszyn J.Protein thermal stability and phospholipidprotein interaction investigated by capillary isoelectric focus⁃ing with whole column imaging detection[J].J Sep Sc,2006,29(7):1018-1025.
[8]Liu Z,Lemma T,Pawliszyn J.Capillary isoelectric focusing coupled with dynamic imaging detection:a one-dimensional separation fortwo-dimensionalprotein characterization[J].J Proteome Res,2006,5(5):1246-1251.
[9]Lemma T, Pawliszyn J. Human serum albumin interaction with oxaliplatin studied by capillary isoelectric focusing with the whole column imaging detection and spectroscopic method[J].J Pharm Biomed Anal,2009,50(4):570-575.
[10]Mao Q,Pawliszyn J.Capillary isoelectric focusing with whole column imaging detection for analysis of proteins and peptides[J].J Biochem Biophys Methods,1999,39(1-2):93-110.

