PES1蛋白与雄激素受体的相互作用及定位
关鑫,王洪远,任伟,杜佩云,秘晓林,程龙,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.大连医科大学 肿瘤干细胞研究院,辽宁 大连 116000;3.安徽医科大学 附属安庆市立医院口腔科,安徽 安庆 246600;4.福建农林大学 生命科学学院,福建 福州 350002
雄激素受体(androgen receptor,AR)属于核受体超家族,是一种配体依赖的转录因子[1],包含4个结构域,即N端的调控结构域(NTD)、DNA结合结构域(DBD)、铰链区(H)及配体结合结构域(LBD)[2]。NTD结构域又称为转录激活域,它包含一个重要的激活区域 AF1(activation function 1),当人工删减LBD区域后,AF1可通过配体不依赖的方式发挥作用。LBD结构域包含一个配体依赖的激活区域AF2,其突变或缺失会明显降低AR的转录活性[3]。当AR与雄激素结合后,会发生构象变化而与热激蛋白HSP90分离。此时AR将以二聚体的形式入核,并与基因中的特定序列——雄激素应答元件(andro⁃gen response element,ARE)结合,进而激活靶基因的转录[4]。
AR在大多数组织中均有不同程度的表达。无论在正常发育中还是病理状态下,AR都发挥重要的作用。目前,AR已成为前列腺癌的治疗靶标[5]。此外,有研究表明AR在很多乳腺癌患者中高表达,且可能成为治疗ER-/HER2+乳腺癌患者的新靶标[6-9]。
人PES1蛋白由588个氨基酸残基(aa)组成,除包含多个核定位信号和一个小泛素化样修饰蛋白(small ubiquitin-like modifier,SUMO)位点外,在311~415 aa区域存在典型的 BRCT 结构域[10-12]。PES1主要定位于核中,具有DNA结合能力。低等真核生物、鼠或人PES1在正常胚胎发育、核糖体生物发生、DNA复制、染色体稳定性和细胞周期调控中起重要作用[13-16]。
PES1在许多肿瘤,如乳腺癌、胶质瘤、前列腺癌及胃癌等中表达水平上调。我们发现,在雌激素受体(estrogen receptor,ER)阳性的乳腺癌中,PES1通过调节ERα和ERβ的平衡来影响乳腺癌的发生和发展[17]。也有研究表明,在ER阴性的乳腺癌细胞中,PES1仍能促进细胞生长,发挥癌基因的作用,提示在乳腺癌中,PES1还有不依赖于ER的作用方式[18],但这种作用方式尚不明确。AR和ER有着相似的结构,AR能够调节ERα阳性和ERα阴性乳腺癌细胞的生长,因此我们检测了PES1是否能够与AR相互作用,调节AR的表达水平。我们在实验中发现,PES1能够与AR相互作用,PES1不调节AR的表达水平,这为研究PES1对乳腺癌中AR功能的调节提供了重要线索。
1 材料与方法
1.1 材料
人胚肾293T细胞由本实验室保存;乳腺癌ZR75-1敲低PES1稳定克隆细胞系由本实验室构建;大肠杆菌DH5α感受态细胞购自Invitrogen公司;DMEM培养基和胎牛血清购自GIBCO公司;转染试剂LipofectAMINE 2000购自Invitrogen公司;质粒Flag-PES1、Flag-PES1(1-110)、Flag-PES1(111-220)、Flag-PES1(221-322)、Flag-PES1(311-588)、Flag-PES1(415-588)均由本实验室构建;质粒MYC-AR、MYC-AR(1-568)、MYC-AR(484-651)、MYC-AR(484-918)由周建光研究员实验室赠送;Flag-HRP、MYC-HRP抗体购自Sigma公司;兔抗人GAPDH抗体和辣根过氧化物酶偶联的IgG均购自Santa Cruz公司。
1.2 细胞培养及转染
293T细胞和ZR75-1细胞用含10%胎牛血清、50 U/mL青霉素、100 U/mL链霉素的DMEM培养基,在CO2含量为5%的37℃孵箱中培养,细胞长满时用胰酶消化传代。质粒转染时严格按照说明书中转染试剂与质粒的量进行操作,转染4~6 h后更换新鲜的培养基,转染24 h后收细胞。
1.3 Western印迹及免疫共沉淀
1.3.1 Western印迹 收细胞后加入SDS加样缓冲液,煮沸15 min,离心后取上清液进行SDS-PAGE,电转移至硝酸纤维素膜,用5%脱脂奶粉于4℃封闭过夜,加入用5%脱脂奶粉1∶5000稀释的MYC抗体或1∶10 000稀释的GAPDH抗体,室温轻摇1 h,用TBST洗膜3次,每次7 min,加入用5%脱脂奶粉稀释的辣根过氧化物酶偶联的羊抗兔IgG,室温轻摇1 h,用TBST洗膜3次,每次7 min,用化学发光法显色5 min,压片显影。
1.3.2 免疫共沉淀 收集细胞后加入裂解液于冰上裂解30 min,用注射器反复吹打至染色质断裂,离心去上清,加入偶联抗体的琼脂糖珠,4℃结合4 h至过夜,用裂解液洗涤沉淀物3次,每次10 min,在洗涤后的琼脂糖珠中加入SDS上样缓冲液进行Western印迹分析,用另一种抗体检测2种蛋白质之间是否存在相互作用。
2 结果
2.1 PES1蛋白与AR的相互作用
将带有FLAG标签的PES1表达质粒和带有MYC标签的AR表达质粒共转染293T细胞,24 h后收细胞,用抗FLAG琼脂糖珠进行免疫共沉淀,用FLAG和MYC抗体进行Western印迹检测。结果表明,带有MYC标签的AR只在含有FLAG PES1的免疫共沉淀产物中被检测出来(图1),即AR能够特异地与PES1蛋白结合。
2.2 PES1与AR的相互作用定位
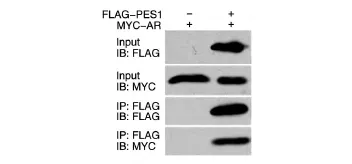
图1 免疫共沉淀检测PES1与AR的相互作用
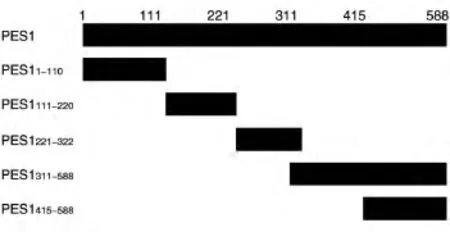
图2 带FLAG标签的PES1截短突变体示意图
为了确定PES1与AR相互作用的区域,首先构建了带有FLAG标签的PES1不同区域的表达载体(图2),将这些载体和MYC-AR质粒共转染293T细胞,用上述方法进行免疫共沉淀之后用Western印迹检测。结果表明,PES11-110、PES1111-220、PES1221-322、和PES1311-588均能与AR相互结合,而PES1415-588不能结合(图3)。此外,将FLAG-PES1质粒与带MYC标签的AR不同区域的表达质粒共转染293T细胞进行免疫共沉淀后发现,PES1与AR484-918能够结合,而与AR1-568、AR484-651不结合(图 4),说明 PES1结合在AR651-918区域。
2.3 PES1不调节AR水平
我们以前的研究发现PES1能和ER结合,并调节ER的蛋白表达水平。因此,我们检测了PES1是否能够调节AR的蛋白表达水平。在ZR75-1细胞中转染PES1 siRNA,48 h后收集细胞,用Western印迹检测PES1和AR的表达水平,发现敲低PES1后AR的蛋白水平没有发生变化(图5)。
3 讨论
在本研究中,我们发现PES1能够与AR相互作用,PES1的多个区域能与AR结合,且主要结合在AR的AF2结构域,PES1不能调节AR的表达水平。
PES1的截短突变体中,除PES1415-588外的区域均能与AR结合,提示PES11-110、PES1111-220、PES1221-322和PES1311-588内均含有与AR直接或间接结合的区域。PES1能够与AR的AF2区域结合,而AF2区域是配体依赖的转录激活域,提示PES1可能作为AR的共调节因子来调节AR的转录活性和功能,这需要进一步通过实验验证。我们以前的研究发现PES1能与ERα、ERβ相互作用,通过抑制泛素化连接酶CHIP与ERα的结合升高ERα的表达水平,通过促进CHIP与ERβ的结合下调ERβ的表达水平。CHIP也是AR的泛素化连接酶,能够介导AR通过泛素-蛋白酶体途径降解。因此,我们检测了PES1是否能够调节AR的表达水平,证实PES1不能调节AR的蛋白表达水平,提示PES1可能不能调节CHIP介导的AR蛋白降解。

图3 免疫共沉淀检测PES1突变体与AR的相互作用

图4 免疫共沉淀检测PES1与AR突变体的相互作用

图5 Western印迹检测ZR75-1细胞中PES1对AR的影响
乳腺癌发生发展的分子机制复杂,众多调节因子参与了这一过程。有研究表明,AR在ERα阳性细胞中通过抑制ERα的活性而抑制细胞生长,在ERα阴性细胞中则促进细胞生长。目前关于AR在乳腺癌中的功能及其调节因子和机制的研究较少,本实验发现了一个新的AR相互作用蛋白PES1,PES1可能通过调节AR的活性调节乳腺癌细胞的增殖。
[1]Mangelsdorf D J,Thummel C,Beato M,et al.The nuclear re⁃ceptor superfamily:the second decade[J].Cell,1995,83(6):835-839.
[2]Brinkmann A O,Faber P W,Van Rooij H C,et al.The hu⁃man androgen receptor:domain structure,genomic organiza⁃tion and regulation of expression[J].J Steroid Biochem,1989,34(1-6):307-310.
[3]Bevan C L,Hoare S,Claessens F,et al.The AF1 and AF2 domains of the androgen receptor interact with distinct re⁃gions of SRC1[J].Mol Cell Biol,1999,19(12):8383-8392.
[4]Dehm S M,Tindall D J.Molecular regulation of androgen ac⁃tion in prostate cancer[J].J Cell Biochem,2006,99(2):333-344.
[5]Keren I K,Susan H,Alex G,et al.A genome-wide RNA in⁃terference screen identifies new regulators of androgen recep⁃tor function in prostate cancer cells[J].Genome Res,2013,23(4):581-591.
[6]Moe R E,Anderson B O.Androgens and androgen receptors:aclinically neglected sectorin breastcancerbiology[J].J Surg Oncol,2007,95(6):437-439.
[7]Higgins M J,Wolff A C.The androgen receptor in breast can⁃cer:learning from the past[J].Breast Cancer Res Treat,2010,124(3):619-621.
[8]Park S,Koo J S,Kim M S,et al.Androgen receptor expres⁃sion is significantly associated with better outcomes in estro⁃gen receptor-positive breast cancers[J].Ann Oncol,2011,22(8):1755-1762.
[9]Ni M,Chen Y,Lim E,et al.Targeting androgen receptor in estrogen receptor-negative breast cancer[J].Cancer Cell,2011,20(1):119-131.
[10]Du Y C,Stillman B.Yphlp,an ORC-interacting protein:po⁃tential links between cell proliferation control,DNA replica⁃tion,and ribosome biogenesis[J].Cell,2002,109(7):835-848.
[11]Holzel M,Grimm T,Rohrmoser M,et al.The BRCT domain of mammalian PES1 is crucial for nucleolar localization and rRNA processing[J].Nucleic Acids Res,2007,35(3):789-800.
[12]Kinoshita Y,Jarell A D,Flaman J M,et al.Pescadillo,a novel cell cycleregulatory protein abnormally expressed in ma⁃lignant cells[J].J Biol Chem,2001,276(9):6656-6665.
[13]Lerch-Gaggl A,Haque J,Li J X,et al.Pescadillo is essen⁃tial for nucleolar assembly,ribosome biogenesis,and mammali⁃an cell proli-feration[J].J Biol Chem,2002,277(47):45347-45355.
[14]Prisco M,Maiorana A,Guerzoni C,et al.Role of pescadillo and upstream binding factor in the proliferation and differenti⁃ation of murine myeloid Cells[J].Mol Cell Biol,2004,24(12):5421-5433.
[15]HolzelM M,RohrmoserM,SchleeT,etal.Mammalian WDR12 is a novel member of the Pes1-Bop1 complex and is required for ribosome biogenesis and cell proliferation[J].J Cell Biol,2005,170(3):367-378.
[16]Zhang H,Fang Y,Huang C,et al.Human pescadillo induces large-scale chromatin unfolding[J].Sci China C Life Sci,2005,48(3):270-276.
[17]Cheng L,Li J P,et al.PES1 promotes breast cancer by dif⁃ferentially regulating ERα and ERβ[J].J Clin Invest,2012,122(8):2857-2870.
[18]Li J,Yu L,Zhang H Z,et al.Down-regulation of pescadillo inhibits proliferation and tumorigenicity of breast cancer cells[J].Cancer Sci,2009,100(12):2255-2260.

