利用自裂解多肽T2A在牛耳皮肤成纤维细胞中实现多基因共同表达
张俨,马晴雯,2
1.上海交通大学 医学院,上海市儿童医院,上海交通大学 附属儿童医院,上海交通大学 医学遗传研究所,上海200040;2.卫生部医学胚胎分子生物学重点实验室暨上海市胚胎与生殖工程重点实验室,上海 200040
多顺反子载体在基因操作中具有重要的应用价值。目前常用的构建多顺反子载体的策略有:构建多启动子表达载体、构建剪切载体、表达融合基因、基因之间以内部核糖体插入位点(IRES)连接等。但这些构建方法往往有载体容量有限、受细胞类型限制及不能表达多个蛋白等缺点。最近几年发展出了自裂解多肽2A(self-cleaving 2A peptide)相关的构建多顺反子载体的新技术。自裂解多肽2A可应用于多顺反子载体的构建,具有结构短小、上下游基因表达平衡性好、可用于共表达多个蛋白等优点,是一种构建多顺反子载体的有效工具[1]。
近几年,利用2A多肽构建多顺反子表达载体的技术在干细胞研究中得到了大量应用。2008年,Sommer等[2]联合应用2A和IRES首次构建了一种多顺反子慢病毒载体,该载体可同时表达Oct4、Klf4、Sox2和c-Myc等4种转录因子,并成功地将新生儿成纤维细胞诱导成iPS细胞。Carey等[3]使用不同来源的2A序列(T2A、E2A和P2A)作为连接元件,构建了含有Oct4、Klf4、Sox2和c-Myc转录因子的多顺反子载体,并且分别在胚胎和成体细胞水平成功地诱导了小鼠和人体细胞的重编程。最近,有研究者分别使用IRES、F2A序列连接O(6)-甲基鸟嘌呤-DNA甲基转移酶基因和多药耐药性基因,通过细胞转染使这2个基因在造血干细胞系中过表达;与IRES的连接相比,F2A的连接对细胞起到了更好的保护效果[4]。我们采用来自一点褐翅蛾病毒(TaV)的T2A构建共表达载体pCMV-GFP-T2A-Neo,转染牛耳皮肤成纤维细胞,分析GFP和Neo基因在分子和细胞水平的表达情况,为在转基因牛制备中利用2A进行多基因转移操作提供基础数据和参考。
1 材料与方法
1.1 材料
小鼠成纤维细胞NIH3T3为本所保存;原代牛耳皮肤成纤维细胞由本所大动物实验基地提供;大肠杆菌TOP10感受态细胞购自天根生化科技(北京)有限公司;质粒pEGFP-N1和pcDNA3.1(+)分别购自Clontech和Invitrogen公司。
DMEM/F12培养液、血清、PBS和TRIzol试剂购自Life Technologies公司;胰蛋白酶购自Becton Dickinson公司;G418购自国药集团化学试剂有限公司;FuGENE HD转染试剂购自Roche公司;限制性内切酶、T4DNA连接酶和Phusion超保真DNA聚合酶购自NEB公司;Taq酶、SYBR荧光定量PCR试剂和PrimeScript反转录酶购自TaKaRa公司;PCR纯化试剂盒和胶回收试剂盒购自Qiagen公司;引物及T2A合成由Life Technologies公司完成。
1.2 载体pCMV-GFP-T2A-Neo的构建
以NarⅠ和BamHⅠ双酶切pcDNA3.1(+),去除SV40启动子。因切除SV40启动子时,Neo基因的部分片段也被切除,因此,以pcDNA3.1(+)为模板扩增含有被切除的Neo基因片段(引物序列见表1),并与上述经NarⅠ和BamHⅠ酶切的pcDNA3.1(+)载体相连,得到pcDNA3.1-CMV-Neo。将合成的T2A及其互补单链T2Arc(分别含有限制性内切酶NheⅠ和BamHⅠ粘性末端,序列见表1)干粉配制为100 μmol/L的溶液后等摩尔混合,于100℃沸水中待其自然冷却,即得到两侧分别为NheⅠ和BamHⅠ粘性末端的T2A双链,将其连入pcDNA3.1-CMV-Neo相应的酶切位点处,得到pcDNA3.1-CMV-T2A-Neo。以pEGFP-N1为模板,PCR扩增含有NheⅠ和AvrⅡ酶切位点的GFP基因,接入pcDNA3.1-CMV-T2A-Neo中,得到目的载体pCMV-GFP-T2A-Neo。
1.3 细胞培养及转染
接种适量NIH3T3细胞或牛耳成纤维细胞至6孔板中,培养至85%~95%汇合度时进行细胞转染。需转染的质粒用无内毒素质粒提取试剂盒制备。采用相同方法转染NIH3T3细胞和牛耳成纤维细胞。转染前进行细胞换液,每孔细胞中加入2 mL新鲜培养基(DMEM/F12+10%血清)。6孔板中每孔细胞的转染操作如下:取3.3 μg DNA加入不含血清的DMEM/F12培养液中,吹打混匀,配成体积为157 μL的DNA混合液,随后将DNA(μg)和转染试剂(μL)按1∶3的比例加入9.9 μL FuGENE HD转染试剂,轻轻吹打混匀,室温静置20 min,将转染复合物逐滴加入6孔板的细胞中,轻轻摇匀。另设转染pEGFP-N1质粒的阳性对照组和未转染质粒的空白对照组。转染12 h后,换新鲜的含血清DMEM/F12培养液继续培养。
1.4 荧光激活细胞分选(FACS)分析
转染48 h后,胰酶消化收集细胞,用PBS洗涤1~2次,取1×105以上的细胞用鞘液重悬,用流式细胞仪分析NIH3T3和牛耳皮肤成纤维细胞中pCMVGFP-T2A-Neo的转染效率及EGFP的表达情况。
1.5 荧光定量PCR
转染牛耳皮肤成纤维细胞48 h后,收集转染组和空白对照组细胞,用TRIzol法提取细胞总RNA,反转录获得cDNA后用荧光定量PCR方法检测GFP、T2A和Neo基因在mRNA水平的表达。引物及序列见表2。采用GraphPaD Prism 5软件分析荧光定量PCR数据。
2 结果
2.1 共表达载体pCMV-GFP-T2A-Neo构建

表1 构建pCMV-GFP-T2A-Neo载体所用引物
构建了共表达载体pCMV-GFP-T2A-Neo(5067 bp),经NheⅠ和BglⅡ酶切鉴定(图1),证明T2A序列已成功接入载体中。
2.2 荧光显微镜下观察绿色荧光蛋白的表达
荧光显微镜下观察牛耳皮肤成纤维细胞转染pCMV-GFP-T2A-Neo后24 h绿色荧光蛋白的表达,以转染pEGFP-N1的细胞作为对照,结果见图2,pCMV-GFP-T2A-Neo可使GFP有效表达。
2.3 FACS检测GFP在牛耳皮肤成纤维细胞和NIH 3T3细胞中的表达
采用FACS检测2种细胞中GFP的表达情况,结果见图3。pCMV-GFP-T2A-Neo可在原代培养的牛耳皮肤成纤维细胞和NIH3T3细胞中有效表达GFP,但表达水平低于pEGFP-N1,与荧光显微镜下观察到的结果一致。
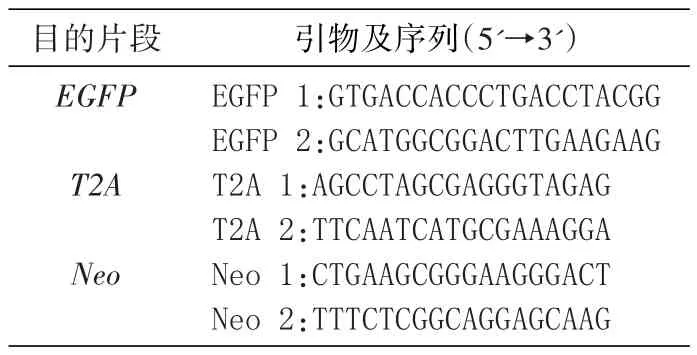
表2 荧光定量PCR引物
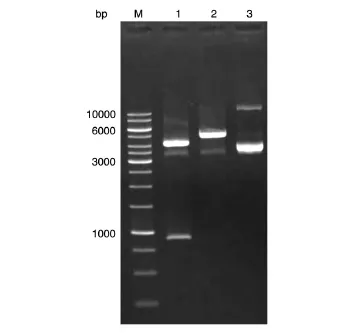
图1 pCMV-GFP-T2A-Neo载体的酶切鉴定结果
2.4 定量PCR检测目的基因的表达
定量PCR结果如图4,在转录水平上,GFP、T2A和Neo表达水平相当,处于同一个数量级。
3 讨论
利用一个启动子实现多基因共同表达,在转基因克隆动物制备中具有重要的应用价值。相对于构建多启动子表达载体、构建剪切载体、表达融合基因、基因之间以IRES连接等共表达载体构建策略,2A序列在构建多顺反子载体中具有序列短小、易操作、上下游基因表达平衡性好等优点,其在腺病毒载体、逆转录病毒载体、慢病毒载体、腺相关病毒载体和质粒载体的构建中都得到了广泛应用。我们利用T2A元件构建的GFP和Neo共表达载体在转入牛耳皮肤成纤维细胞后能够正常翻译,T2A及其相连的2个基因的mRNA表达量处于同一数量级。此外,T2A能够在牛耳成纤维细胞中发挥自裂解功能,可将其作为一种平衡性较好的共表达策略应用于牛耳皮肤成纤维细胞。但目前2A自裂解的机制尚不清楚,且可能存在未剪切前体,同时上游蛋白C端2A残基的残留可能影响蛋白的功能和定位[5-6],如GFPT2A-Neo翻译后T2A介导的断裂会使上游的GFP带上一段十几个氨基酸残基的多肽,这段多肽可能会影响GFP的高级结构,进而影响绿色荧光的强度,这有可能是造成牛耳成纤维细胞及NIH3T3细胞中GFP表达水平较pEGFP-N1载体上GFP单一表达框表达水平低的原因。相信随着研究的深入,自裂解多肽2A将会作为构建多顺反子载体的强有力工具应用于转基因牛的生产,若能同时与多种提高转基因表达水平的策略[7]相结合,有望提高表达转基因大动物的制备效率。
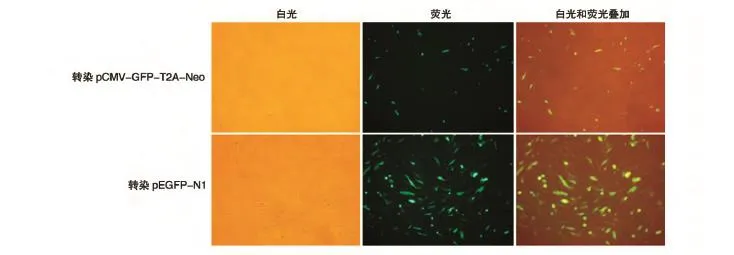
图2 牛耳皮肤成纤维细胞绿色荧光蛋白的表达(40×)
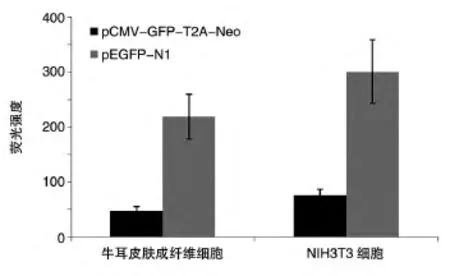
图3 牛耳皮肤成纤维细胞和NIH3T3细胞中GFP的表达
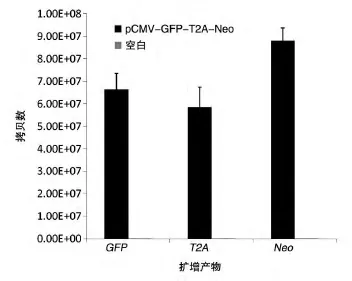
图4 定量PCR检测牛耳皮肤成纤维细胞转染pCMV-GFP-T2A-Neo后细胞中GFP、T2A和Neo的表达
[1]张俨,李振海.多顺反子载体构建的策略及进展[J].医学分子生物学杂志,2012,9(5-6):429-433.
[2]Sommer C A,Stadtfeld M,Murphy G J,et al.Induced plurip⁃otent stem cell generation using a single lentiviral stem cell cassette[J].Stem Cell,2009,27(3):543-549.
[3]Carey B W,Markoulaki S,Hanna J,et al.Reprogramming of murine and human somatic cells using a single polycistronic vector[J].Proc Natl Acad Sci USA,2009,106(1):157-162.
[4]Maier P,Heckmann D,Spier I,et al.F2A sequence linking MGMT(P140K)and MDR1 in a bicistronic lentiviral vector en⁃ables efficient chemoprotection of haematopoietic stem cells[J].Cancer Gene Ther,2012,19(11):802-810.
[5]Ryan M D,King A M,Thomas G P.Cleavage of foot-andmouth disease virus polyprotein is mediated by residues locat⁃ed within a 19 amino acid sequence[J].J Gen Virol,1991,72(Pt 11):2727-2732.
[6]Ryan M D,Drew J.Foot-and-mouth disease virus 2A oligo⁃peptide mediated cleavage of an artificial polyprotein[J].EM⁃BO J,1994,13(4):928-933.
[7]孙世惠,林艳丽,邓继先.提高转基因表达水平的策略[J].生物技术通讯,2005,16(2):197-200.

