结核分枝杆菌Rv3871抗原优势肽段的克隆表达及抗原性鉴定
郄霜,戴振华,杨锡琴,修冰水 ,陈堃 ,郭兰芹,冯晓燕,张庆波,张贺秋
1.河北联合大学,河北 唐山 063000;2.军事医学科学院 基础医学研究所,北京 100850;3.华北石油总医院,河北 任丘 062552
结核分枝杆菌感染所导致的结核病对人类健康依然是极大的威胁,全世界高达三分之一的人口是潜在的结核分枝杆菌感染患者,每年平均死亡人数达到170万[1]。目前我国结核病诊断及流行病学调查主要采用结核菌素纯蛋白衍化物(PPD)检测,但PPD检测包含的抗原复杂,导致难以区别结核杆菌感染和卡介苗接种,因此,寻找特异性更高、敏感性更强的抗原是目前结核病诊断研究的首要任务。
致病性结核分枝杆菌区别于卡介苗(BCG)的一个重要特征是,结核分枝杆菌的基因组中存在RD1区,而所有环境分枝杆菌及BCG中均缺失该区序列。研究表明,敲除RD1区的结核分枝杆菌H37RV与BCG疫苗株的毒力相当,因此推断RD1区与细菌的毒力有关[2]。我们对H37RV株RD1区的Rv3871抗原优势肽段进行了克隆、表达及纯化,初步检测了其抗原性,希望为结核病的临床检测提供新型抗原。
1 材料和方法
1.1 材料
所有血清均来自北京市朝阳区疾病预防控制中心,全部为临床新近诊断的活动性肺结核患者,未合并感染HIV,未接受抗结核治疗或治疗时间不超过2周;阴性对照组来自健康献血员。
结核分枝杆菌H37Rv基因组DNA、大肠杆菌HB101由本室保存;在大肠杆菌中高效表达目的基因的载体pBVIL1由本室构建;实验所需DNA限制性内切酶XhoⅠ和XbaⅠ,及T4DNA连接酶均购自Promega公司。
1.2 抗原表位分析
用Biosun分子生物学软件对Rv3871抗原进行表位分析,将其分成3个优势抗原表位,分别为Rv3871-1、Rv3871-2和Rv3871-3。
1.3 基因克隆与载体构建
针对用Biosun软件分析而得的Rv3871的3段优势肽段基因序列及质粒pBVIL1克隆位点序列设计PCR引物。Rv3871-1基因上游引物为P1(5'-GCC TCGAGACTGCTGAACCGGAAGTACGGA-3'),下游引物为 P2(5'-GCTCTAGAACCGGGCCATCCGTCG ATGAT-3');Rv3871-2基因上游引物为 P3(5'-GC CTCGAGATCGCTTCCCAGCACACCGAA-3'),下 游引物为 P4(5'-GCTCTAGAAATCTCCCAGCGAGTG CGGTA-3');Rv3871-3基因上游引物为P5(5'-GC CTCGAGATCGCTTCCCAGCACACCGAA-3'),下 游引物为 P6(5'-GCTCTAGAACCGGGCCATCCGTCG ATGAT-3')。上、下游引物5'端分别引入XhoⅠ和XbaⅠ酶切位点。
以结核分枝杆菌H37Rv株基因组为模板进行PCR扩增,反应体系包括H37Rv株基因组DNA 1.0 μL、超纯水45 μL、酶50 μL、引物各2.0 μL,总体积为100 μL。反应条件:95℃预变性5 min;95℃变性30 s,58℃退火 30 s,72℃延伸 1 min,30个循环;72℃延伸10 min。扩增产物用2%琼脂糖凝胶电泳检测,用DNA胶回收试剂盒纯化回收扩增产物,由中美泰和生物技术公司测序,将测序正确的目的基因用XhoⅠ和XbaⅠ酶切,并将其与经相同酶切的pBVIL1原核表达载体连接构成重组质粒,将重组质粒转化大肠杆菌HB101,对氨苄西林(Amp)抗性培养菌落进行菌落PCR鉴定,并对重组质粒进行双酶切鉴定,阳性克隆用于诱导表达。
1.4 表达纯化
将重组质粒转化大肠杆菌HB101,挑取单一克隆接种于2 mL LB液体培养基(含100 μg/mL Amp),37℃摇床振摇培养过夜,次日以1∶100的比例接种于新鲜LB液体培养基(含100 μg/mL Amp),37℃振摇培养2~3 h,转至42℃水浴诱导表达4 h以上,收集菌体,提取包涵体与上清,进行SDSPAGE。重组蛋白的纯化参照文献[5]进行。
1.5 活性检测
用纯化的结核分枝杆菌抗原Rv3871-1、Rv3871-2和Rv3871-3分别包被酶联测定板,用间接ELISA方法检测结核阳性患者和健康献血员,测定D450nm值,评价抗原的反应活性。
2 结果
2.1 抗原表位分析
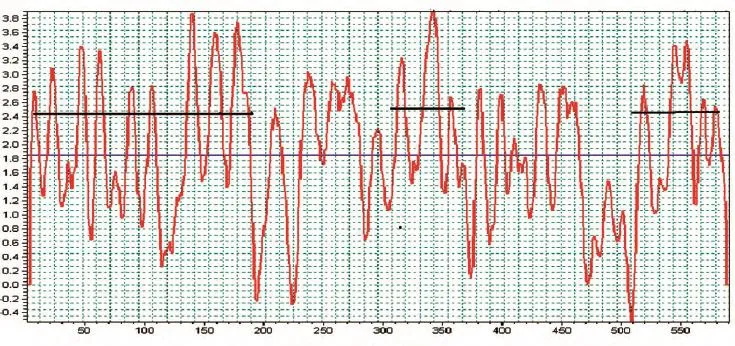
图1 Biosun分子生物学软件对Rv3871抗原的分析结果
用Biosun分子生物学软件对Rv3871抗原进行抗原表位分析,将Rv3871抗原分成3个优势抗原表位,分别为 Rv3871-1(10~190 aa)、Rv3871-2(310~370 aa)和Rv3871-3(510~580 aa)(图1)。
2.2 PCR产物的琼脂糖电泳鉴定
以H37Rv基因组DNA为模板,分别扩增Rv3871-1、Rv3871-2和Rv3871-3抗原基因片段,相应的PCR产物大小分别为540、180和210 bp(图2)。
2.3 重组质粒的测序鉴定
用XhoⅠ和XbaⅠ双酶切扩增的基因,得到相应的目的基因,连接到经同样双酶切的pBVIL1载体上,构建成重组质粒,重组质粒的测序结果表明所扩增的基因序列完全正确(序列略)。
2.4 抗原的表达纯化
将重组质粒转化大肠杆菌HB101,对经PCR鉴定和酶切鉴定阳性的克隆进行热诱导。由于目的基因与载体上的一段IL1基因相融合,因此表达的Rv3871-1、Rv3871-2和Rv3871-3重组蛋白的相对分子质量分别约为 39.2×103、21.6×103和 22.5×103。将大量诱导表达的菌体用超声波破碎,对表达于包涵体内的各重组蛋白进行离子交换柱纯化。相关SDS-PAGE结果如图3。
2.5 间接ELISA检测抗原活性

图2 抗原基因片段PCR产物琼脂糖电泳结果
分别用纯化的抗原Rv3871-1、Rv3871-2和Rv3871-3包被酶联板,通过ELISA方法检测40例结核病患者、36例健康体检者,对检测结果用Graph⁃Pad Prism 4软件进行统计学分析,确定cut-off值,表明差异有统计学意义(图4)。对3个抗原优势肽段进行IgG检测,Rv3871-1的敏感性为32.5%(13/40,t=6.091,P<0.001),特异性为97.2%;Rv3871-2的敏感性为45%(18/40,t=5.756,P<0.001),特异性为100%;Rv3871-3的敏感性为37.5%(15/40,t=4.847,P<0.001),特异性为91.6%。Rv3871-2优势肽段的检测效果最佳。参见表1、2。
3 讨论
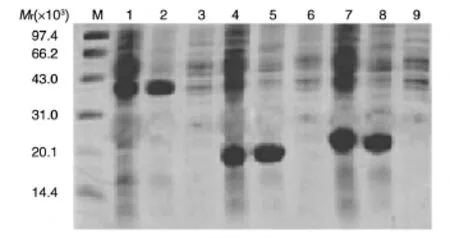
图3 重组菌的SDS-PAGE

表1 抗原优势肽段Rv3871-1、Rv3871-2和Rv3871-3的ELISA检测结果

表2 抗原优势肽段Rv3871-1、Rv3871-2和Rv3871-3的特异性和敏感性

图4 Rv3871-1、Rv3871-2和Rv3871-3抗原的活性
对于结核病的血清学检测,检测试剂的敏感性与特异性一直是困扰科研工作者和医务人员的难题,其主要原因是检测试剂所用的抗原种类和质量问题仍未解决。因此,寻找敏感性高、特异性好的结核病诊断抗原一直是研究重点[6]。目前比较成熟的结核病诊断试剂盒大多选用分泌性抗原或多抗原联合检测[7]。本研究主要针对结核分枝杆菌H37Rv株RD1区编码蛋白进行。RD1区编码蛋白(Rv3871~Rv3879c)是结核分枝杆菌在长期传代过程中丢失的特异性保护性抗原,仅存在于致病性结核分枝杆菌中,在BCG及环境分枝杆菌中缺失[8],从而使其在结核病的免疫学诊断和预防中发挥重要作用。Rv3871是膜结合ATP水解酶的组成部分,是转录形成单位,有2个ATP/GTP结合位点[9]。
目前关于Rv3871蛋白的研究较少。我们对Rv3871抗原进行了表位分析,将该抗原分成3段,利用本室构建的原核表达载体pBVIL1进行抗原优势肽段的表达纯化,发现3个抗原优势肽段都能高效表达。在先前的研究中,曾用多种载体对Rv3871抗原进行全长表达,但均未成功。本研究中,通过表达抗原优势肽段,避免了由于抗原本身分子较大,不易表达的缺点。
通过间接ELISA法对3个抗原优势肽段免疫活性进行初步检测,发现Rv3871-2抗原优势肽段的敏感性和特异性均高于Rv3871-1和Rv3871-3。由此可以推断Rv3871-2抗原在3个抗原中效果最佳。
抗原优势肽段的检测可以克服抗原蛋白分子较大而不易克隆表达的缺点,同时也可以克服由于蛋白自身结构复杂,相互折叠,使线性表位被覆盖而不能充分表现其抗原活性的缺点。本研究结果表明,Rv3871-2抗原在pBVIL1载体中可以高效表达,同时该抗原在3个优势肽段中活性最好。该抗原可以与其他RD1区抗原如ESAT-6、CFP-10联合用于检测,以提高检出率,同时又可以保持特异性。但是目前对Rv3871抗原的研究较少,需要进一步扩大临床样品评价,探讨抗原在结核病检测中的应用价值。
[1]Lienhardt C,Davies G.Methodological issues in the design of clinical trials for the treatment of multidrug-resistant tubercu⁃losis:challenges and opportunities[J].Int J Tuberc Lung Dis,2010,14(5):528-537.
[2]姚翠梅,孙长江,张智勇,等.结核分枝杆菌RD1区T细胞表位分布情况预测及分析[J].安徽农业科学,2011,39(25):15218-15221.
[3]宋晓国,凌世淦,张贺秋,等.高效原核融合表达载体(pBVILⅠ)的构建及在HCV表达中的应用[J].细胞与分子免疫学杂志,2001,17(3):231-233.
[4]Feng X,Xiu B,Chen K,et al.Enhanced serodiagnostic utili⁃ty of novel Mycobacterium tuberculosis polyproteins[J].J Infect[J].2013,66(4):366-375.
[5]王国华,陈坤,宋晓国,等.基于结核分枝杆菌分泌抗原的新型结核诊断试剂研究[J].现代检验医学杂志,2009,24(4):59-61.
[6]Mahairas G G,Sabo P J,Hickey M J,et al.Molecular analy⁃sis of genetic differences between Mycobacterium bovis BCG and virulent M.bovis[J].J Bacteriol,1996,178(5):1274-1282.
[7]郄霜,戴振华,冯晓燕,等.重组结核分枝杆菌抗原在结核病诊断中的应用[J].中国卫生检验杂志,2013,23(4):1051-1053.

