人MDM2基因真核表达载体的构建及其与p53的相互作用
叶晨阳,徐建明,林莉,王岩,葛飞娇,赵传华,李珊珊,付亚莉,李志强
军事医学科学院 附属医院消化肿瘤科,北京 100071
人MDM2(murine double minute 2)基因定位于12号染色体,广泛表达于人体的多个器官,在骨骼肌中的含量最高,其次为肝、肺、胰等,与细胞基本生理活动有关。MDM2蛋白包含5个保守区,从N端开始,分别为Ⅰ区(19~102氨基酸残基,是MDM2与p53相互结合部位)、Ⅱ区(181~185残基,为核定位序列)、Ⅲ区(221~272残基,是含有40%谷氨酸和精氨酸残基的高度酸性区域,能与核糖体L5蛋白及5S rRNA结合)、Ⅳ区(305~322残基,含有1个锌指结构)和Ⅴ区(438~478残基,含有1个环指结构,可介导蛋白质-蛋白质的相互作用,也可以与DNA或RNA结合)[1]。MDM2具有泛素化连接酶的功能,已报道的MDM2蛋白最重要的功能是与p53蛋白直接结合形成p53-MDM2复合物,介导p53通过泛素-蛋白酶体途径降解,从而抑制p53的功能[2-4]。MDM2在细胞中的其他功能研究相对较少。
我们拟构建MDM2真核表达载体,并验证其与p53的相互作用,为进一步研究MDM2蛋白在细胞内的功能提供基础。
1 材料和方法
1.1 材料
人胚肾293T细胞购自ATCC;pcDNA3.0-Flag载体购自Invitrogen公司;VigoFect为威格拉斯生物技术有限公司产品;限制性内切酶、DNA连接酶、PCR试剂购自TaKaRa公司;DMEM、小牛血清购自Gibco公司;质粒提取、胶回收、PCR回收试剂盒购自Pro⁃mega公司;测序由华大生物技术有限责任公司完成。
1.2 Flag-MDM2重组质粒的构建与测序
以人乳腺文库为模板,PCR扩增MDM2基因的CDS序列。正向引物为5'-CGCGGATCCATGGTGA GGAGCAGGCAAATGTG-3',反向引物为5'-CGG AATTCCTAGGGGAAATAAGTTAGCACAAT-3'。扩增条件:95℃预变性5 min,以95℃变性30 s、55℃退火30 s、72℃延伸1.5 min行30个循环,72℃延长7 min。用胶回收试剂盒回收PCR产物。用BamHⅠ和EcoRⅠ双酶切pcDNA3.0-Flag载体,经琼脂糖凝胶电泳后,胶回收载体大片段;将PCR片段回收后再用BamHⅠ和EcoRⅠ酶切,形成带有粘性末端的双链,用T4DNA连接酶连接入pcDNA3.0-Flag载体,转化大肠杆菌DH5α,挑选克隆,振荡培养后提质粒,用BamHⅠ和EcoRⅠ双酶切鉴定,鉴定正确的克隆进行测序。
1.3 哺乳动物细胞转染和Western印迹检测
将293T细胞接种于6 cm皿中,接种量以转染时细胞密度达到80%为宜,24 h后进行转染。将4 μL VigoFect与 200 μL NaCl混合,再将总量为 5 μg的重组质粒与200 μL NaCl混合,然后将上述2种溶液轻轻混合,室温放置15 min,加入6 cm皿中,24 h后收集细胞蛋白,加入2×SDS加样缓冲液,煮沸10 min,12 000 r/min离心5min,取上清液进行SDS-PAGE后,转移至硝酸纤维素膜上,用5%脱脂奶粉于4℃封闭1 h,加入用5%脱脂奶粉以1∶5000稀释的用HRP标记的Flag抗体,室温轻摇1 h,TBST洗膜3次,每次5 min,用化学发光法显色5 min,压片显影。
1.4 免疫共沉淀
转染24 h后收集细胞,用0.5 mL IP缓冲液裂解细胞,冰浴30 min;超声波破碎,4℃、12 000 r/min离心10 min,取上清,留30 μL做Input;取一定量的偶联抗体的磁珠,用IP缓冲液平衡3次,每次10 min;取30 μL磁珠加到细胞裂解物中,4℃结合4 h;用0.5 mL IP缓冲液洗涤沉淀物4次,每次10 min;沉淀加入30 μL 2×SDS蛋白加样缓冲液,煮沸10 min变性,进行SDS-PAGE;用抗另一种蛋白的抗体进行Western印迹分析,检测2种蛋白质之间是否存在相互作用。
2 结果
2.1 Flag-MDM2重组质粒的构建与鉴定
以人乳腺文库为模板,PCR扩增人MDM2的编码序列,获得长1494 bp的DNA片段,与预期大小一致(图1)。将PCR产物用BamHⅠ和EcoRⅠ双酶切后与同样经这2种酶切的pcDNA3.0-Flag载体连接,转化大肠杆菌DH5α,挑选克隆,进行菌液PCR鉴定,所得的阳性克隆提质粒经酶切鉴定,可切出2条长度分别约为5000和1494 bp的条带,5000 bp条带为pcDNA3.0-Flag载体,1494 bp条带为MDM2,符合预期结果(图2)。序列测定结果表明,插入载体的DNA序列与人MDM2基因的编码序列完全一致(序列略)。
2.2 Flag-MDM2在293T细胞中的表达
将构建的Flag-MDM2重组质粒和空载体分别转染293T细胞,24 h后收细胞,提取蛋白进行SDSPAGE,Western印迹检测构建的Flag-MDM2是否表达。结果显示,转染Flag-MDM2的细胞裂解物能在相对分子质量约60×103处检测到明显的特异性条带,而转染空载体的细胞裂解物无条带(图3),说明Flag-MDM2重组蛋白在293T细胞中能够成功表达。
2.3 Flag-MDM2与p53存在相互作用
文献报道MDM2能够结合并降解p53,因此,我们利用免疫共沉淀实验验证了构建的带Flag标签的MDM2与带Myc标签的p53的相互作用,结果如图4,在细胞内p53可以和MDM2结合,而不能与阴性对照Flag空载体结合,说明MDM2与p53存在特异的相互作用,与文献报道一致。

图1 PCR扩增人MDM2的编码序列

图2 Flag-MDM2的BamHⅠ和EcoRⅠ双酶切电泳图谱

图3 Western印迹检测Flag-MDM2的表达
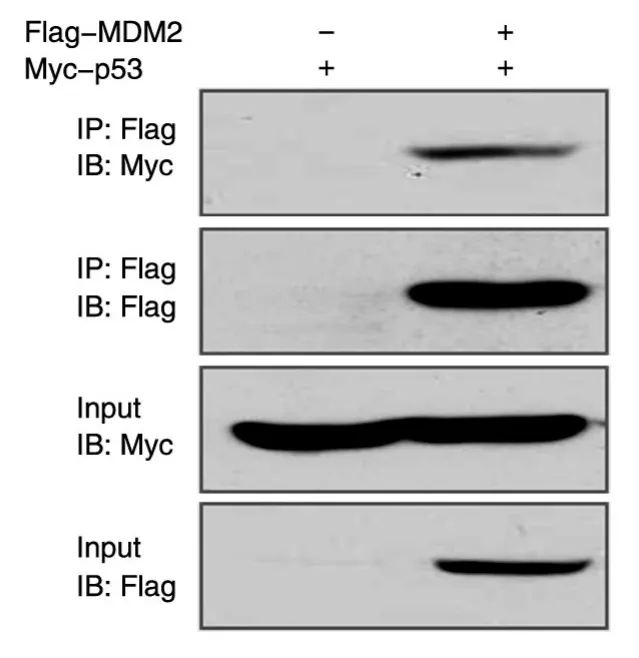
图4 Flag-MDM2与p53存在相互作用
3 讨论
我们扩增了人MDM2基因,并连接到带有Flag标签的真核表达载体上,经过酶切和测序鉴定克隆构建成功,转染293T细胞证明Flag-MDM2基因成功表达。根据文献报道,利用免疫共沉淀实验验证了Flag-MDM2与p53的相互作用,证明Flag-MDM2载体表达的蛋白具有生物学功能。
MDM2蛋白由497个氨基酸残基构成,在胶质母细胞瘤[5]、脂肪肉瘤[6]、黑色素瘤[7]、乳腺癌[8]、食道癌[9]、骨肉瘤[10]、结直肠癌[11-12]等多种肿瘤中过量表达。研究表明,MDM2在肿瘤中发挥癌基因的功能,MDM2的转基因小鼠实验证实MDM2会诱导小鼠肿瘤的发生[13-14]。p53是目前研究最深入的抑癌基因,广泛参与细胞凋亡、细胞周期、基因组稳定性等肿瘤发生发展的关键步骤。MDM2癌基因功能的发挥主要是通过泛素-蛋白酶体途径降解抑癌基因p53,抑制p53的转录活性[15]。MDM2在肿瘤中的其他功能及分子机制研究较少,我们构建的Flag-MDM2真核表达载体将为探讨MDM2的其他功能奠定基础。
[1]Popowicz G M,Czarna A,Wolf S,et al.Structures of low mo⁃lecular weight inhibitors bound to MDMX and MDM2 reveal new approaches for p53-MDMX/MDM2 antagonist drug discov⁃ery[J].Cell Cycle,2010,9(6):1104-1111.
[2]Haupt Y,Maya R,Kazaz A,et al.Mdm2 promotes the rapid degradation of p53[J].Nature,1997,387(6630):296-299.
[3]Wade M,Wang Y V,Wahl G M.The p53 orchestra:Mdm2 and Mdmx set the tone[J].Trends Cell Biol,2010,20(5):299-309.
[4]Tovar C,Graves B,Packman K.MDM2 small-molecule antag⁃onist RG7112 activates p53 signaling and regresses human tu⁃mors in preclinical cancer models[J].Cancer Res,2013,73(8):2587-2597.
[5]Cancer Genome Atlas Research Network. Comprehensive ge⁃nomic characterization defines human glioblastoma genes and core pathways[J].Nature,2008,455(7216):1061-1068.
[6]Ito M,Barys L,O'Reilly T,et al.Comprehensive mapping of p53 pathway alterationsrevealsan apparentrole forboth SNP309 and MDM2 amplification in sarcomagenesis[J].Clin Cancer Res,2011,17(3):416-426.
[7]Gembarska A,Luciani F,Fedele C,et al.MDM4 is a key therapeutic target in cutaneous melanoma[J].Nat Med,2012,18(8):1239-1247.
[8]Lam S,Lodder K,Teunisse A F,et al.Role of Mdm4 in drug sensitivity of breast cancer cells[J].Oncogene,2010,29(16):2415-2426.
[9]Shibagaki I,Tanaka H,Shimada Y,et al.p53 mutation,mu⁃rine double minute 2 amplification,and human papillomavirus infection are frequently involved but not associated with each other in esophageal squamous cell carcinoma[J].Clin Cancer Res,1995,1(7):769-773.
[10]Mejia-Guerrero S,Quejada M,Gokgoz N,et al.Characteriza⁃tion of the 12q15 MDM2 and 12q13-14 CDK4 amplicons and clinicalcorrelationsin osteosarcoma[J].GenesChromo⁃somes Cancer,2010,49(6):518-525.
[11]Forslund A,Zeng Z,Qin L X,et al.MDM2 gene amplifica⁃tion is correlated to tumor progression but not to the pres⁃ence of SNP309 or TP53 mutational status in primary colorec⁃tal cancers[J].Mol Cancer Res,2008,6(2):205-211.
[12]Gilkes D M,Pan Y,Coppola D,et al.Regulation of MDMX expression by mitogenic signaling[J].Mol Cell Biol,2008,28(6):1999-2010.
[13]Lundgren K,Montes de Oca Luna R,McNeill Y B,et al.Targeted expression of MDM2 uncouples S phase from mito⁃sis and inhibits mammary gland development independent of p53[J].Genes Dev,1997,15;11(6):714-725.
[14]Jones S N,Hancock A R,Vogel H,et al.Overexpression of Mdm2 in mice reveals a p53-independent role for Mdm2 in tumorigenesis[J].Proc Natl Acad Sci USA,1998,95(26):15608-15612.
[15]Wade M,Li Y C,Wahl G M.MDM2,MDMX and p53 in on⁃cogenesis and cancer therapy[J].Nat Rev Cancer,2013,13(2):83-96.

