人1型酪蛋白激酶的真核表达及其在肿瘤细胞中的定位
冀全博,徐小洁,张强,康磊,李玲,黄蓉,周丽英 ,王荣福,王岩,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.解放军总医院 骨科,北京 100853;3.北京大学 第一医院核医学科,北京 100034
1型酪蛋白激酶(casein kinase 1,CK1)是一类具有独特理化特性的丝氨酸/苏氨酸蛋白激酶,其家族序列高度保守[1],并广泛存在于哺乳动物、酵母等真核生物的细胞质、细胞核、细胞膜及细胞骨架等部位[2],参与调节包括基因表达、囊泡运输、生物节律、DNA损伤修复、细胞周期调控等多种过程[3]。
q CK1表达水平及活性的变化能促进肿瘤发生,并通过一系列细胞内信号通路调节肿瘤的进展[4]。为此,我们构建了带有FLAG标签的CK1的真核表达载体,并研究该激酶在骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞中的表达及定位情况,为进一步深入探讨肿瘤发生的潜在分子标记物和药物治疗靶点的深层次研究奠定了基础。
1 材料和方法
1.1 材料
骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞由本室传代培养;大肠杆菌DH5α、人乳腺文库、pCMV-Tag2B载体为本室保存;XhoⅠ和HindⅢ限制性内切酶、高保真primerSTAR DNA聚合酶、T4DNA连接酶、Taq酶为TaKaRa公司产品;PCR回收试剂盒、胶回收、质粒提取试剂均来自Pro⁃mega公司;转染试剂Vigofect为威格拉斯生物技术有限公司产品;小鼠源抗FLAG标签单抗(mAb)αm-FLAG和HRP标记的抗FLAG标签小鼠源mAb购自Sigma公司;FTTC标记的山羊抗小鼠二抗购自San⁃ta Cruz公司;引物由北京赛百盛生物技术公司合成;测序由北京奥科生物技术有限责任公司完成。
1.2 人CK1全长编码区序列的扩增
以人乳腺文库为模板,根据文献报道的人CK1 CDS序列合成上游引物(5'-CGGGATCCATGTCGG GACCCGTGCCAAGCAG-3')和下游引物(5'-CGGA ATTCTTACTGCTGAGCGCCAGCGGCAGC-3'),PCR扩增CK1编码区全长(95℃ 5 min,以95℃ 30 s、58℃ 30 s、72℃ 1 min进行32个循环,72℃延长7 min;使用高保真primerSTAR DNA聚合酶)。
1.3 重组表达质粒的构建、鉴定
用XhoⅠ和HindⅢ限制性内切酶双酶切pCMVTag2B载体(37℃,4 h),经10 g/L琼脂糖凝胶电泳后,胶回收载体大片段;将PCR产物胶回收后用XhoⅠ和HindⅢ双酶切,形成带有黏性末端的双链,用T4DNA连接酶连接到pCMV-Tag2B载体中,得到重组质粒pCMV-Tag2B-CK1,将其转化大肠杆菌DH5α,挑选克隆,培养后菌液PCR鉴定阳性的提取质粒,用XhoⅠ和HindⅢ双酶切鉴定,酶切鉴定正确的克隆送北京奥科生物公司测序。
1.4 哺乳动物细胞的培养与转染
将骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞接种于6孔板中含10%胎牛血清的双抗DMEM培养基中,接种细胞密度以80%为宜,培养12 h后按常规方法进行转染,转染前1 h换液。将2 μL Vigofect与100 μL NaCl混合,取5 μg重组质粒与100 μL NaCl混合,再将上述2种溶液混合,室温放置15 min,加入6孔板中,并以同样的方法转染空pCMV-Tag2B作为对照,37℃、5%CO2条件下常规培养,转染后4~6 h换液。
1.5 SDS-PAGE和Western印迹检测FLAG-CK1的表达
将pCMV-Tag2B-CK1重组质粒分别转入骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞,24 h后收集细胞,提取蛋白,加入2×SDS上样缓冲液,100℃水浴15 min,12 000 r/min离心5 min,取上清液进行SDS-PAGE后,电转移至硝酸纤维素膜上,用50 g/L脱脂奶粉在室温下封闭1 h,加入用50 g/L脱脂奶粉以1∶3000稀释的HRP标记的抗FLAG标签的小鼠mAb,室温轻摇1 h,TBST洗膜3次,每次5 min;化学发光法显色5 min,压片显影。
1.6 细胞免疫荧光检测FLAG-CK1的细胞定位
将骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞分别接种于6孔板,用pCMV-Tag2BCK1重组质粒分别转染细胞,常规培养24 h后弃培养基,用PBS洗3次,胰酶消化2 min;分别将3种消化后的细胞接种至12孔板中继续培养,接种密度以5%为宜,12孔板各孔中预先分别置入3个1 cm圆形盖玻片,待细胞贴壁后弃培养基,加入预先配制的40 g/L的多聚甲醛室温固定30 min;用含10%山羊血清的PBS封闭30 min,加入1∶200稀释的小鼠源抗FLAG标签的mAb(αm-FLAG),37℃孵育1.5 h;用含10%山羊血清的PBS洗3次,每次10 min;用1∶200稀释的FITC标记的山羊抗小鼠二抗(αm-FITC)37℃孵育1 h,用1×PBS漂洗3次,每次10 min;用终浓度为1 μg/mL的DAPI染细胞核10 min,用1×PBS漂洗3次,每次5 min;在荧光显微镜下观察细胞内融合蛋白2B-FLAG-CK1的表达及定位。
2 结果
2.1 人CK1基因编码区的扩增
以人乳腺文库作为模板,PCR扩增获得约1170 bp的产物,与预期片段大小一致(图1)。
2.2 pCMV-Tag2B-CK1重组质粒的构建与鉴定
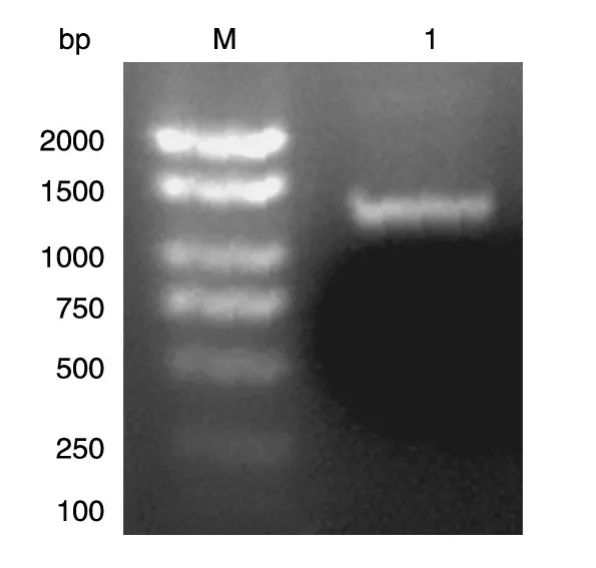
图1 PCR扩增目的基因
用XhoⅠ和HindⅢ双酶切PCR产物后与经同样双酶切的pCMV-Tag2B载体连接,转化大肠杆菌DH5α,培养后菌液PCR鉴定,筛选目的条带大小接近1170 bp的阳性克隆(图2),提取质粒后酶切鉴定,可切出2条长度分别约为5000和1170 bp的条带(图3),表明CK1基因的CDS序列已插入pCMVTag2B上游的多克隆位点中。测序结果显示,与已知人CK1基因的编码序列完全一致(序列略)。
2.3 SDS-PAGE和Western印迹检测CK1融合蛋白的表达
将构建的pCMV-Tag2B-CK1重组质粒分别转染骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞,24 h后提取蛋白进行SDS-PAGE,Western印迹检测2B-FLAG-CK1蛋白的表达。结果表明,在相对分子质量约40 000处能够检测到明显的特异性条带,说明2B-FLAG-CK1融合蛋白在上述3种细胞中获得正确表达,而空载体则无蛋白表达(图4)。
2.4 细胞免疫荧光检测2B-FLAG-CK1在骨肉瘤U2OS细胞、乳腺癌ZR-75-1细胞、肝癌HepG2细胞中的定位
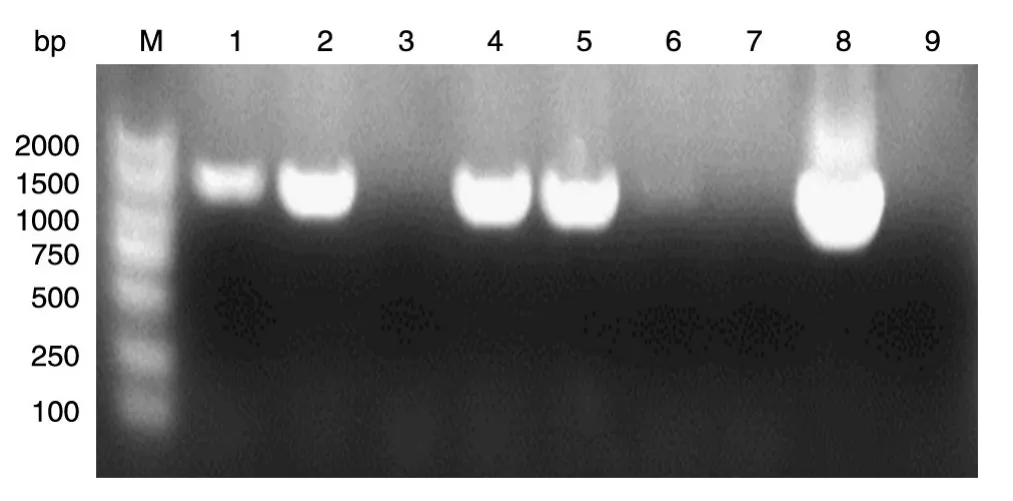
图2 菌液PCR鉴定

图3 表达载体的双酶切鉴定
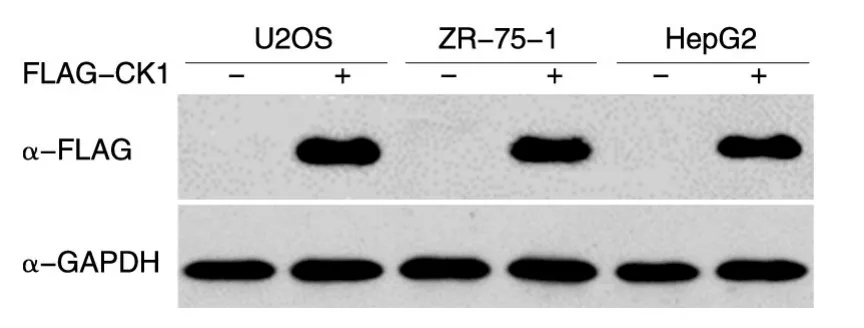
图4 重组蛋白表达的Western印迹
将pCMV-Tag2B-CK1重组质粒分别转染骨肉瘤U2OS细胞、ZR-75-1细胞、HepG2细胞,24 h常规培养并处理后,于荧光显微镜下观察CK1融合蛋白在细胞中的定位(图5),发现2B-FLAG-CK1蛋白在3中细胞的胞核和胞质中均有分布,在U2OS、HepG2细胞胞质中的信号强于胞核中,而在ZR-75-1细胞胞核中的信号强于胞质中。
3 讨论
肿瘤的发生发展与蛋白质磷酸化水平的异常调节密切相关,而蛋白质磷酸化作为蛋白质转录及转录后修饰(磷酸化、甲基化、乙酰化、糖基化等)中的重要类型之一,参与调控代谢、信号转导、细胞分裂等不同过程[5]。CK1作为钙黏着蛋白功能的重要调控因子,可通过与细胞膜、细胞骨架、某些细胞表面受体及细胞核因子的稳定结合,参与蛋白质的级联磷酸化过程[6],从而调节生理功能[7]。
CK1还参与调节Wnt、Hedgehog信号通路及细胞周期、细胞凋亡,通过磷酸化作用直接或间接参与Dv1-1、APC、Axin和β-catenin的磷酸化反应[8],并能够 与 MDM2(mutine double minute chromosome 2)共同调节p53蛋白的磷酸化[9-10]及缺氧诱导因子HIF-1的调控[11],还能负向调控E钙粘连蛋白介导的细胞-细胞黏附[12]。CK1调节功能的紊乱,可影响肿瘤的发生与发展。鉴于此,我们设计并完成了CK1真核表达载体的构建,并确定了其在不同肿瘤细胞中的定位。

图5 细胞免疫荧光检测2B-FLAG-CK1在肿瘤细胞中的定位
另已发现,CK1δ/ε在结肠癌、胰腺癌、乳腺癌中可通过抑制凋亡或激活β-catenin信号通路影响肿瘤进展[10]。CK1γ2可磷酸化转移性肿瘤抗原1(me⁃tastastic tumor antigen 1,MTA1),并调节其功能[13],而最近对MTA1转基因小鼠的研究,证明CK1在乳腺癌的发生发展中也有重要作用[14]。研究还表明,CK1可作为恶性黑色素瘤的诊断分子标记物,对肿瘤的侵袭和代谢产生影响[15]。
因此,CK1的真核表达及其在不同肿瘤细胞系中的定位研究,对阐明CK1调节细胞进程的作用,更好地研制抗肿瘤药物、制定肿瘤治疗新策略具有重要意义。
[1]Graves P R,Roach P J.Role of COOH-terminal phosphoryla⁃tion in the regulation ofcasein kinase 1 delta[J].JBiol Chem,1995,270(37):21689-21694.
[2]Knippschild U,Gocht A,Wolff S,et al.The casein kinase family:participation in multiple cellular processes in eukary⁃otes[J].Cell Signal,2005,17(6):675-689.
[3]Peters J M,McKay R M,McKay J P,et al.Casein kinase I transduces Wnt signals[J].Nature,1999,401(6751):345-350.
[4]Knippschild U,Wolff S,Stöter M,et al.The role of the ca⁃sein kinase 1(CK1)family in differentsignaling pathways linked to cancer development[J].Onkologie,2005,28(10):508-514.
[5]Xu Y,Xing Y,Chen Y,et al.Structure of protein phospha⁃tase 2A homoenzyme[J].Cell,2006,127(6):1239-1251.
[6]Flotow H,Roach P J.Synergistic phosphorylation of rabbit muscle glycogen synthase by cyclic AMP-dependent protein kinase and casein kinase I.Implications for hormonal regula⁃tion ofglycogen synthase[J].J BiolChem,1989,264(16):9126-9128.
[7]Vancura A,Sessler A,Leichus B,et al.A prenylation motif is required for plasma membrane localization and biochemical function of casein kinase I in budding yeast[J].J Biol Chem,1994,269(30):19271-19278.
[8]Swiatek W,Tsai I C,Klimowski L,et al.Regulation of ca⁃sein kinase Iepsilon activity by Wntsignaling[J].JBiol Chem,2004,279(13):13011-13017.
[9]Huart A S,Saxty B,Merritt A,et al.A casein kinase 1/checkpoint kinase 1 pyrazolo-pyridine protein kinase inhibitor as novel activator of the p53 pathway[J].Bioorg Med Chem Lett,2013,23(20):5578-5585.
[10]Cheong J K,Virshup D M,Wagner P.Casein kinase 1:com⁃plexity in the family[J].Int J Biochem Cell Biol,2011,43(4):465-459.
[11]Kalousi A,Mylonis I,Politou A S,et al.Casein kinase 1 reg⁃ulates human hypoxia-inducible factor HIF-1[J].J Cell Sci,2010,123(Pt 17):2976-2986.
[12]Dupre-Crochet S,Figueroa A,Hogan C,et al.Casein kinase 1 is a novel negative regulator of E-cadherin-based cell-cell contacts[J].Mol Cell Biol,2007,27(10):3804-3816.
[13]Knippschild U,Wolff S,Giamas G,et al.The role of the ca⁃sein kinase 1(CK1)family in differentsignaling pathways linked to cancer development[J].Onkologie,2005,28(10):508-514.
[14]Bagheri-Yarmand R,Talukder A H,Wang R A,et al.Metas⁃tasis-associated protein 1 deregulation causesinappropriate mammary gland developmentand tumorigenesis[J].Develop⁃ment,2004,131(14):3469-3479.
[15]Sun D,Zhou M,Kowolik C M,et al.Differential expression patterns of capping protein,protein phosphatase 1,and casein kinase 1 may serve as diagnostic markers for malignant mela⁃noma[J].Melanoma Res,2011,21(4):335-343.

