UA-SPE-HPLC快速分离法测定乳饮料中的硫氰酸钠的研究
张丽媛,姚笛,贾鹏宇,王颖,李秀波
(1.黑龙江八一农垦大学食品学院,大庆163319;2.黑龙江省农产品加工工程研究中心)
牛乳及其制品以其营养价值高,富含钙、维生素D等营养成分而受到大众的欢迎,但也因此成为掺假、制假的温床。据报道,健康牛奶中平均含有0.9 mg·kg-1的硫氰酸离子,是乳制品过氧化物酶抗菌体系的主要成分之一。含乳饮料是以鲜乳或乳制品为原料,经发酵或未经发酵加工制成的制品,含乳饮料中掺入硫氰酸钠后可有效的抑菌、保鲜,但硫氰酸钠能在体内释放氰根离子,并很快与细胞色素氧化酶中的三价铁离子结合,抑制该酶的活性,使组织不能利用氧而导致人昏迷[1]。另有报道称,由于硫氰酸钠在人体内代谢可形成硫氰酸,可干扰人的甲状腺功能,导致非缺碘性甲状腺肿,影响人体正常生理代谢[2]。
目前,国内外关于硫氰酸盐的研究多集中在化学和生物方面,如运用硫氰酸盐离子吸附形成复杂的离子交换剂[3]、硫氰酸钠对银腐蚀溶出度氨基硫脲解率的影响[4]等。在硫氰酸钠检测方法方面主要有毛细管电泳法[5]、离子色谱法[6]、分光光度法[7]、气相色谱法[8]、电化学法[9]。张永峰[10-11]等建立了离子色谱/电导检测分析奶粉、牛奶中硫氰酸盐的方法,针对不同形态的乳制品前处理方法进行重点研究和讨论。宋洁[12]等利用顶空进样-气相色谱法检测乳制品中硫氰酸盐的含量,采用蒸馏水提取乳制品中的硫氰酸盐,用乙酸锌沉淀乳制品中的蛋白质,将硫氰酸离子衍生后,采用顶空进样,气相色谱法检测。
主要研究了乳饮料中硫氰酸钠的前处理方法,利用乙腈加酸溶液沉淀蛋白,超声辅助萃取乳饮料中的硫氰酸钠,固相萃取柱进行净化,高效液相色谱法[13]进行检测,并对超声时间、萃取条件等进行讨论和研究。
1 材料和方法
1.1 试剂
三氯乙酸、硫氰酸钠、丙酮、乙醚、乙酸乙酯,以上均为分析纯;甲醇、乙腈为色谱纯。
硫氰酸盐标准储备液:称取在80℃下烘2 h的硫氰酸钠0.083 17 g于100 mL容量瓶中,用水定容至刻度,混匀,即得浓度为500μg·mL-1的硫氰酸盐标准储备液。
硫氰酸钠标准溶液:将硫酸氰钠标准储备液(500μg·mL-1) 逐级稀释得到浓度为0.020、0.10、0.50、2.50、12.50、20.00 mg·mL-1的标准溶液。
0.02 moL·L-1磷酸盐缓冲溶液:称取含两个结晶水的磷酸二氢钠0.312 g,加水溶解并定容至100mL,加磷酸调节pH=4.0,经0.22μm微孔滤膜(水相)过滤后备用。
1.2 仪器设备
高效液相色谱仪(PC-2025型,美国SSI有限公司),配紫外检测器;超声波仪(上海生析超声波仪器有限公司);分析天平(Mettler AE240,瑞士);高速离心机(安徽中科中佳仪器有限公司);一次性水系(纤维素)、有机系(尼龙)针式滤膜(0.22μm,天津市兰博仪器公司)。
1.3 加标样品
乳饮料:乳饮料样品共5种,复原乳样品、爽歪歪,AD钙奶和味动力及优酸乳分别设为样品1、2、3、4、5,均购买自超市。在2.2.2中的样品分别是样品1、2、3、4、5,其他所有结果都是由样品1获得。在乳饮料样品中加入硫氰酸钠标准溶液并振摇2 min获得加标样品溶液。
1.4 萃取过程
准确称取5 g试样于50 mL离心管中,加入5.0μg·mL-1标准溶液20μL,振摇混均后向其加入少量去离子水、2mL 0.1moL·L-1三氯乙酸和30 mL乙腈,最后用去离子水定容,超声提取10 min,14 000 r·min-1离心5 min,静置,取上清液滤入10 mL离心管中,氮气吹干,用去离子水定容。过经2mL甲醇、2 mL水活化后的C18固相萃取小柱,收集流出液,过0.22μm有机滤膜待测。在50mL离心管中,不加入乳饮料,其他按照上述过程依次处理,过膜后得到空白样品溶液待测。
1.5 硫氰酸钠的HPLC测定
色谱条件:色谱柱:XDB C18柱(5 mm,4.6 mm×150 mm);C18(4.0 mm×50 mm) 保护柱。流动相:0.02 moL·L磷酸盐缓冲溶液-乙腈(50∶50);流速:0.5 mL·min-1;柱温:35℃;检测波长:218 nm;定量环体积:20μL。
将空白样品溶液、标准溶液、加标样品溶液和样品溶液依次按照上述色谱条件进行HPLC分析,得到色谱图以及峰面积。
2 结果与讨论
2.1 前处理方法的确定
样品前处理的基本原则是:首先用去离子水对目标物进行提取,再采用有机溶剂沉淀蛋白质,进而用固相萃取小柱净化、去除脂肪等有机物,得到测试液。鉴于硫氰酸钠无机盐的属性以及定量计算方便,选择三氯乙酸加有机溶剂沉淀蛋白—超声提取—固相萃取柱净化的前处理方法,可以有效去除蛋白质、氨基酸等杂质的影响,有利于提高提取效率和净化效果,得到较满意的结果。
2.1.1 蛋白沉淀剂的选择
蛋白沉淀剂的选择直接影响着后续HPLC法的分析性能。考察不同有机溶剂甲醇、丙酮、乙腈以及酸溶液、碱溶液对乳饮料样品的蛋白沉淀效果,实验结果如图1。单一选择有机溶剂进行蛋白沉淀时易出现分层现象,结合图1结果中回收率情况,加入2 mL 0.1 moL L-1三氯乙酸和30 mL乙腈进行蛋白沉淀,可以更有效的去除乳饮料中的蛋白质等杂质。
2.1.2 超声时间
在超声功率150W、温度25℃条件下,考察超声时间范围变化从5、7、10、13、15 min对回收率的影响。结果如图1,随着超声时间增加,样品中硫氰酸钠提取回收率随之增加,超声时间增加到一定时间后提取回收率无明显影响。因此选择10 min为最优超声时间。
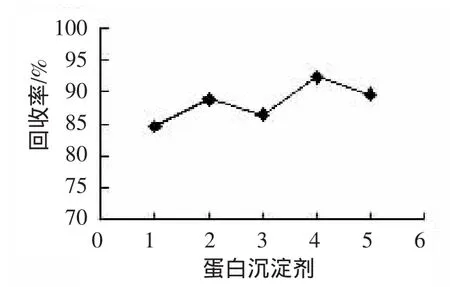
图1 蛋白沉淀剂的影响Fig.1 Effectof protein precipitation agent
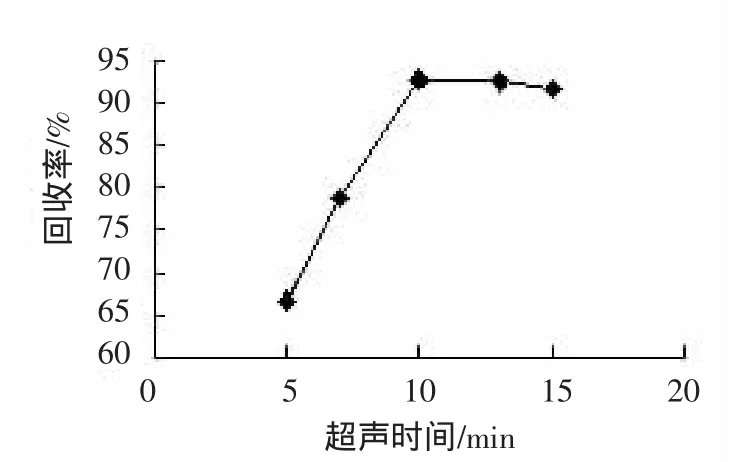
图2 超声时间的影响Fig.2 Effect of ultrasonic time

图3 SPE类型的影响Fig.2 Effectof type of SPE cartridges
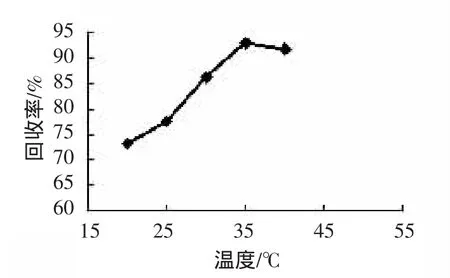
图4 柱温的影响Fig.4 Effectof column temperature
2.1.3 固相萃取柱类型
选择固相萃取柱的主要目的是净化,因为主要干扰硫氰酸钠检测的杂质包括蛋白质,脂肪、氨基酸和水溶性维生素。研究进一步考察HLB、MCX、Si、C18、C8(规格均为300mg,6mL)5种不同填料的SPE柱,结果如图3。结果表明C18柱对样品净化效果最好。
2.1.4 柱温的影响
色谱柱的柱温对硫氰酸钠的分离分析有一定的影响,升高柱温可以保留时间提前,分离效果变好,但是升高到一定程度后保留时间变化不明显,还会影响分离效果。见图4,最终选择35℃为最佳柱温。
2.2 方法评价
2.2.1 线性关系
以硫氰酸钠标准溶液浓度和所得色谱峰面积绘制标准曲线,得到线性回归方程;同时得到硫氰酸钠的检出限(LOD)和定量限(LOQ)。LOD和LOQ均由以下公式得到:

σ是11个空白样品直接引入到HPLC分析得到的信号的标准偏差,k是曲线的斜率。所得数据如表1。

表1 工作曲线和线性范围Table1 Working curves and Linear range
2.2.2 样品分析
通过评价方法的精密度和回收率分析5种乳饮料样品,(1)标准溶液、(2)空白样品1溶液、(3)加标样品1溶液、(4)牛奶样品2如图5所示。7种牛奶样品都检出硫氰酸钠,检出量数据如表2。

图5 标准溶液(1),空白溶液(2),加标样品溶液(3),样品溶液(4)的色谱图Fig.5 Chromatograms of standard solution(1),blank solution(2),spiked sample solution(3),sample solution(4)

表2 硫氰酸钠检出量Table2 Detectable amountof Sodium Thiocyanate
对于同一个样品分别加入两个不同浓度水平的标准溶液(2.00、20.00μg·kg-1),每一个样品一天内分析三次,求得日内精密度;三天内每天分析一次,求得日间精密度,都是由相对标准偏差(RSD)表示。

表3 牛奶样品的分析结果Table3 Analytical results of dairy samples
3 结论
建立了超声辅助萃取/固相萃取柱净化/高效液相色谱快速测定乳饮料中硫氰酸钠的方法,针对样品前处理技术进行研究,并对萃取、净化条件进行优化。3min完成硫氰酸钠的检测,并在0.05~50mg·kg-1范围内具有良好的线性,检测限为0.024mg·kg-1。经此方法检测5种乳饮料样品,(下均检出不同程度的硫氰酸钠残留,最高达到95.40mg·kg-1。经检测样品2—爽歪歪、3—AD钙奶、5—优酸乳疑似添加,饮用不安全。此方法前处理简单、分析快速,为乳饮料中硫氰酸钠的质量监控提供了可靠的检测手段。
[1]伍金娥,常超,胡海琼,等.紫外分光光度法测定掺假牛奶中的硫氰酸钠含量[J].武汉工业学院学报,2010,29(2):1-3.
[2]顾欣,黄士新,李丹妮,等.乳中硫氰酸盐对人类健康的风险评估[J].中国兽药杂志,2010,44(9):45-49.
[3]Kononova O N,Goryaeva N G,Kononov Y S,The sorption of thiocyanate ions on complex forming ionites[J].Zhurnal Fizicheskoi Khimii,2011,85(6):1142-1147.
[4]Kozin L F,Danil’tsev B I.The Effect of sodium thiocyanate on the corrosion dissolution rate of silver in thiosemicarbazide solutions[J].Zashchita Metallov,2005,41(4):372-380.
[5]Glatz z,NovákováS,sˇtěrbováH.Analysis of thiocya-nate in biological fluids by capillary zone electrophoresis[J].J.Chromatrogr.A,2001,916(1-2):273-277.
[6]刘明.离子色谱法快速测定原料乳中硫氰酸盐含量的研究[J].安徽工程科技学院学报,2010,25(2):47-49.
[7]水明,赵慧芬,曹燕淑.可见分光光度法测定牛乳中硫氰酸钠[J].中国奶牛,2009(11):50-51.
[8]胡桂林,薛志清,张河霞,等.气相色谱法测定牛奶和奶粉中的硫氰酸盐[J].中国乳品工业,2010,38(10):54-56.
[9]Shamsipur M,Ershad S,Samadi N,et al.The first use of a Rh(Ⅲ)complex as a novel ionophore for thiocyanateselective polymeric membrane electrodes[J].Talanta,2005,65(4):991-997.
[10]张水锋,林珍珍,陈小珍,等.基于离子色谱/电导检测的全脂奶粉中硫氰酸盐污染物的测定及前处理方法研究[J].分析测试学报,2012,31(1):85-89.
[11]张永峰,陈小珍,张东雷,等.离子色谱-电导检测法测定不同乳制品中硫氰酸盐[J].中国无机分析化学,2012,2(3):60-63.
[12]宋洁,傅英文,杜利君,等.顶空进样-气相色谱法检测乳制品中硫氰酸盐的含量[J].色谱,2012,30(7):743-746.
[13]张丽媛,姚笛,何莹,等.固相萃取-高效液相色谱法联用检测花椒样品中的玫瑰红B[J].黑龙江八一农垦大学学报,2012,24(6):53-57.

