萝卜红色素的提取工艺研究
刘海军,孙井坤
(1.黑龙江八一农垦大学食品学院,大庆163319;2.东北农业大学工程学院)
红心萝卜成本低,来源丰富,萝卜红色素可广泛应用于食品行业以及药品外表着色等。按食品工业生产使用着色,最大用量不限,可作为天然食用色素逐步取代合成色素的最优品种[1]。具有抗氧化功能的天然食用色素。色素的提取方法主要有溶剂浸提法[2]、超声波萃取法[3]和微波萃取法[4]。微波萃取法速度最快,但是微波控制不好极易使色素分解,而溶剂浸提法可以减少溶剂消耗,操作简单方便,学者用此方法对不同物料如紫心萝卜[5]、紫甘薯[6-7]、辣椒[8-9]、紫茄皮[10]、红叶甜菜[11]和火龙果[12]等的红色素提取工艺进行了大量研究,但是,这种提取时间较长,耿明江等[13]在提取桃花红色素时,优选浸提溶剂后,以超声方法辅助提取,结果表明,这种方法优选所得工艺稳定可行。
因此,采用溶剂方法,辅助超声波加快提取速度,以红心萝卜为原料提取红色素,对影响红色素提取的因素和最佳提取条件进行研究。
1 材料与方法
1.1 试验材料
新鲜红心萝卜购于大庆当地农贸市场;萝卜红色素胶质、冰乙酸均为分析纯,购于天津市天大化学试剂厂。
1.2 仪器设备
TDL8D-2B型台式离心机:上海安亭科学仪器厂;BSA-224S-CW型电子天平:北京赛多利斯仪器系统有限公司;FW型高速万能粉碎机:天津市泰斯特仪器有限公司;KQ-500DV型数控超声波清洗器:昆山市超声仪器有限公司;TU-1901型双光束紫外可见分光光度计:北京普析通用有限责任公司;SHB-3循环水多用真空泵:郑州杜甫仪器厂;202-2A型电热恒温干燥箱:天津市泰斯特仪器有限公司;ZKF035型电热真空干燥箱:上海实验仪器厂有限公司。
1.3 试验方法
1.3.1 萝卜红色素提取工艺流程
将新鲜胭脂萝卜洗净,去皮,切成细丁状,将切成细丁状的红心萝卜破碎,加入一定浓度的乙酸提取剂中,在一定温度下,经400W功率的超声辅助提取一定时间,取出放入离心机中,在4 000 r·min-1下旋转离心10min,得到澄清的色素上清液,取1mL定容至100mL容量瓶中,在530 nm下测其吸光度值。
1.3.2 红色素提取量的计算
用1%的盐酸甲醇溶液,准确配制系列浓度的红色素溶液,在530 nm波长下测其吸光度A,根据浓度C与吸光度A的关系,拟合得到标准曲线方程为A=1.934C-0.048 5(决定系数R2=0.998 9),花青素萃取率的计算公式如式(1):

式中:D——试样中红色素的含量(μg·g-1);
C——红色素浓度(μg·mL-1);
V——定容体积(mL);
n——稀释倍数;
W——试样重量(g)。
1.3.3 单因素试验设计
1.3.3.1 温度对色素提取量的影响
在5.00 g红心萝卜样品中,加入5.00 mL浓度为20%的乙酸,浸提10min,对提取量在不同提取温度下的变化进行试验。
1.3.3.2 料液比对色素提取量的影响
在5.00 g红心萝卜样品中,加入一定体积的浓度为20%的乙酸,浸提10 min,对提取量在不同乙酸体积下的变化进行试验。
1.3.3.3 乙酸浓度对色素提取量的影响
在5.00 g红心萝卜样品中,加入5.00 mL不同浓度的乙酸,在浸提温度40℃下浸提10 min,对提取量在不同乙酸浓度下的变化进行试验。
1.3.3.4 浸提时间对色素提取量的影响
在5.00 g红心萝卜样品中,加入5.00 mL浓度为20%的乙酸,在浸提温度40℃下浸提,对提取量在不同提取时间下的变化进行试验。
以上所有试验均为重复3次,取平均值。
1.3.4 正交实验
在单因素实验的基础上,根据表1所列的条件进行提取,将浸提液在4 000 r·min-1的离心机中离心后,取1mL的上清液定容至100mL的容量瓶中,测其在530 nm下的吸光度值,以提取量为评价指标,对萝卜红色素提取量影响的因素进行正交实验,根据预试验结果,以料液比A(μg·g-1)、乙酸浓度B(%)、提取时间C(min)、温度D(℃)为4因素,各取3水平,进行萝卜红色素提取产量的L9(34)正交试验,并对实验结果进行统计分析。

表1 正交实验因素水平表Table1 The factors and levels of orthogonal experiment
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 温度对色素提取量的影响
提取量随提取温度的变化结果如图1所示。
由图1可以看出:随温度的增加提取量逐渐增加,在提取温度达到40℃时提取量达到最大值5.835μg·g-1,随着温度继续升高,提取量下降。这是因为温度升高会促进传质作用,有利于色素的提取,但是,过高的温度会使红色素分解,从而降低提取量,所以选择40℃为最佳提取温度。
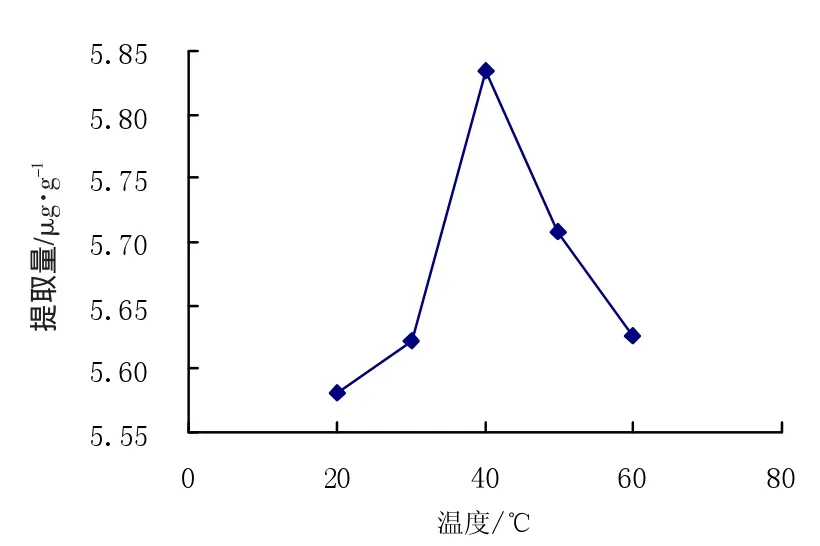
图1 温度对提取量的影响Fig.1 Effect of temperature on extraction quantity
2.1.2 料液比对色素提取量的影响
提取量随料液比的值变化如图2所示,由图可以看出,提取量随着料液比的增大提取量逐渐增大,5 g样品质量固定,料液比越大表明所加提取剂乙酸的体积越大,这使得提取出的红色素质量更多,综合考虑,选择料液比1∶1为宜,即5 g样品中加入5mL乙酸。

图2 料液比对提取量的影响Fig.2 Effectof solid-liquid ratio on extraction quantity
2.1.3 乙酸浓度对色素提取量的影响
提取量随乙酸浓度的变化如图3所示。

图3 乙酸浓度对提取量的影响Fig.2 Effect of acetic acid concentration on extraction quantity
由图3可以看出:随着乙酸浓度的增加,提取量逐渐增加,当达到30%后开始下降,所以选取30%的乙酸作为提取剂,这与文献的结论是一致的[14]。
2.1.4 时间对色素提取量的影响
提取量随提取时间的变化如图4所示。
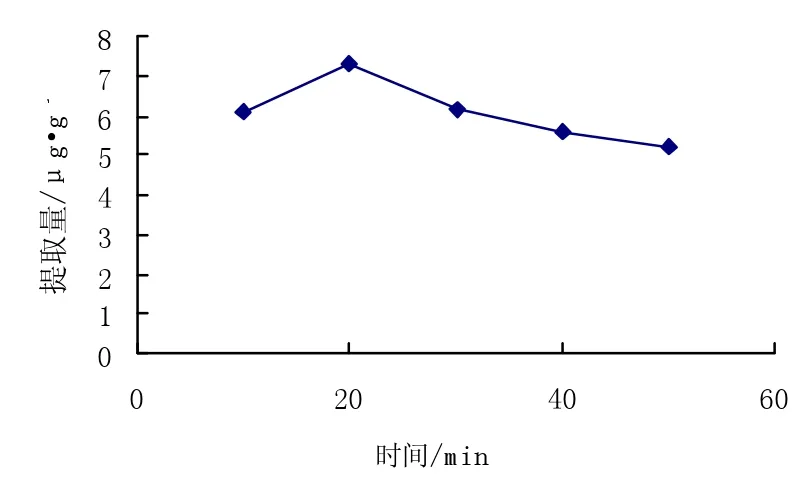
图4 时间对提取量的影响Fig.4 Effect of time on extraction quantity
由图4可以看出,提取量随着提取时间的增加先增后减小,在时间为20min时提取量达到最大值7.295μg·g-1,而后时间增大,提取量反而减小,因为随着浸提时间的增长色素可能分解,因此浸提时间确定在20 min。
2.2 正交试验结果分析
正交试验结果如表2所示。
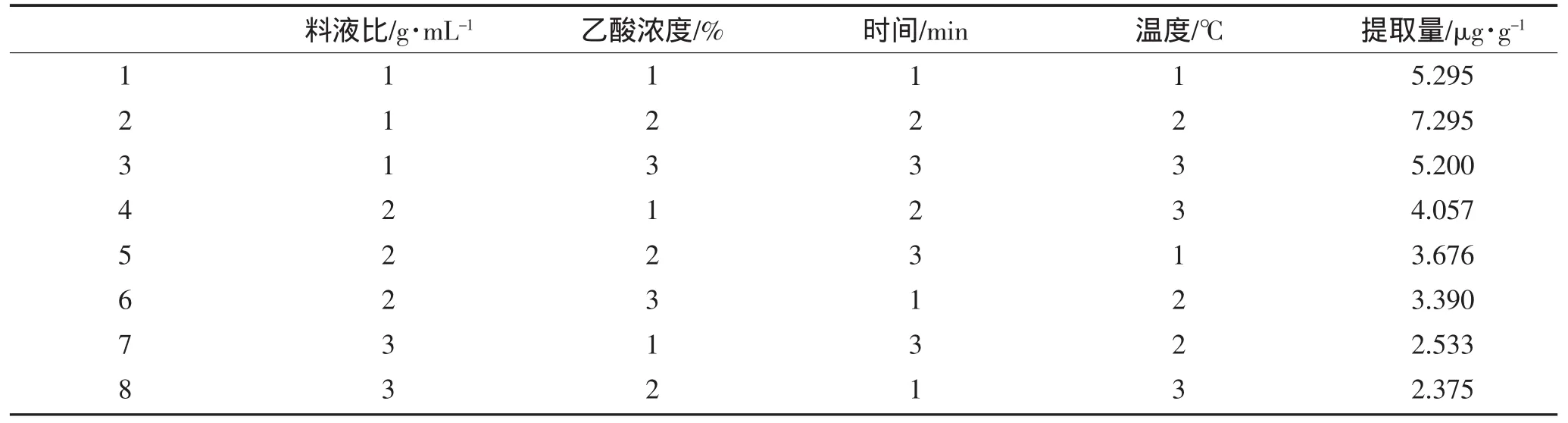
表2 正交试验设计与结果Table2 Results of orthogonal experiment design
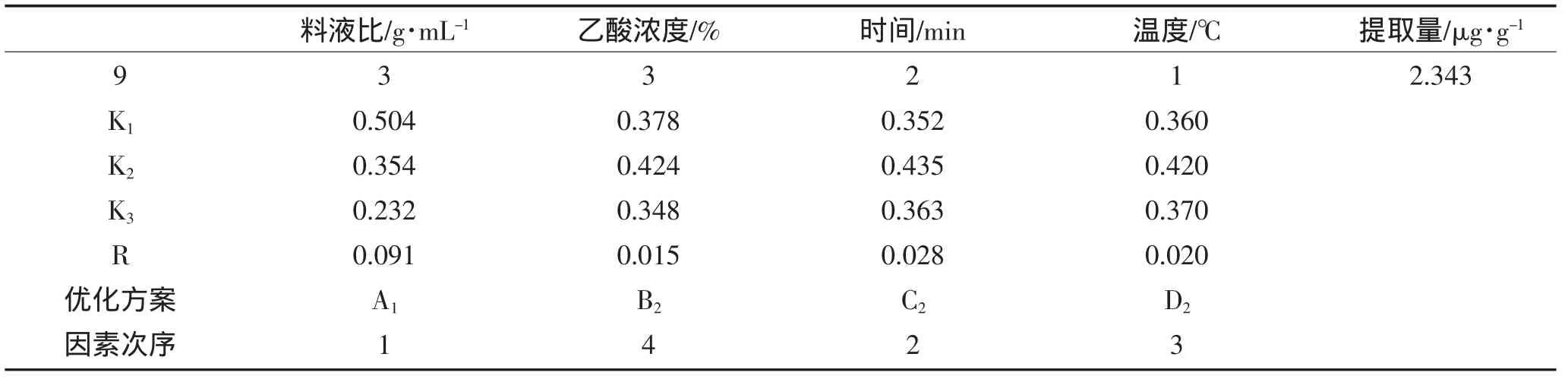
续表2正交试验设计与结果Continued Table2 Results of orthogonal experiment design
由表2可以看出,根据级差分析可知:利用乙酸作为提取剂提取萝卜红色素时,各影响因素的顺序为:D>C>B>A,即:料液比>时间>温度>浓度。 最佳工艺为:A1B2C2D2即:料液比为1∶1、乙酸的浓度为30%、温度为40℃、超声波浸提20min最好。因为最佳组合在试验设计中,故不需要做验正试验。
3 结论
试验确定的色素提取重要条件为色素的实验室小量提取条件,与工业的提取条件有一定的差异和距离,可作为工业生产提取条件的参考和依据。在萝卜红色素的提取过程中,采用乙酸进行浸提,提取量较高,同时乙酸成本相对较低,在大规模生产中切实可行。提取萝卜红色素的最佳工艺为:料液比为1∶1,乙酸的浓度为30%,在40℃的温度下,浸提20min,提取量为7.295μg·g-1。
[1]高家祥.红心萝卜和萝卜红色素研究进展及前景展望[J].南方农业,2012(9):53-56.
[2]孙天宇,杨宏志.超声波法提取沙棘叶总黄酮最佳工艺的研究[J].黑龙江八一农垦大学学报,2012,24(3):45-50.
[3]薛敏敏,邓学良,李忠海,等.微波-超声波协同提取野生毛葡萄皮色素的工艺研究[J].食品与机械,2010,26(6):141-143.
[4]邓祥元,刘约翰,高坤,等.超声波辅助提取辣椒红色素的工艺研究[J].食品研究与开发,2013,34(6):25-29.
[5]张春玲,杜以文,翟明昌.紫心萝卜红色素提取工艺及其稳定性研究[J].食品科学,2008,29(11):290-293.
[6]王玲,邓敏姬.紫甘薯天然红色素的提取及其稳定性研究[J].食品科技,2011,36(23):179-183.
[7]李新华,林琳,鄂巍.紫甘薯红色素提取技术的研究[J].沈阳农业大学学报,2007,12(9):556-559.
[8]丁杰,何锡阳,赵俊生.溶剂法提取天然辣椒红色素研究[J].安徽农业科学,2010,38(25):13805-13806.
[9]陈咏梅.辣椒红色素的提取[J].科技信息,2007(25):321-337.
[10]付莉,王丽颖,顾英.紫茄皮红色素超声波提取工艺及其性质的研究[J].安徽农业科学,2010,38(15):8167-8169.
[11]李伟,周大寨.浸提溶剂对红叶甜菜红色素的影响[J].食品科学,2012,33(17):87-89.
[12]杨洪元,黄康晟.火龙果红色素提取工艺及其性质研究[J].安徽农学通报,2009,15(3):151-152.
[13]耿明江,程迪,赵晓霞,等.正交法优选桃花红色素提取工艺[J].食品科技,2008(1):185-187.
[14]Dryby M.Lightand heat sensitivity of red cabbage extract in soft drink model systems[J].Food Chemistry,2001,72(4):431-437.

