红松松子壳多糖的单糖组成及结构初步分析
张曜武,丁 宁
(青岛科技大学化工学院,山东 青岛266042)
我国东北地区红松(Pinus koraiensis)资源丰富,其果实松子因具有较高的营养价值和保健功能而被广泛食用。从摘除松子后的松球鳞片中提取的松子壳多糖具有抗病毒[1-2]、抗肿瘤[3-4]、增强免疫[5]等多种生物活性,而多糖的活性又与其结构组成密切相关[6],因此有必要对其单糖组成和结构特征进行分析。
作者将膜分离技术与离子交换纤维素柱层析联用,分别得到红松松子壳总多糖PPSPⅠ-b和其分离纯化组分PPSPⅠ-1,采用气相色谱仪测定多糖样品的单糖组成及其物质的量比,采用红外光谱仪对PPSPⅠ-1的结构特征进行初步分析,拟为红松松子壳多糖成分的深入研究提供参考。
1 实验
1.1 材料、试剂与仪器
红松松子壳,青岛天元普康生物技术有限公司;DEAE-52离子交换纤维素,北京瑞达恒辉科技发展有限公司。
鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、氯仿、吡啶、肌醇、三氟乙酸、醋酸酐、甲醇、盐酸羟胺均为国产分析纯试剂。
98-1-B型电子调温电热套;SHZ-Ⅲ型循环水真空泵;80-2B型台式低速离心机;RE-52型旋转蒸发仪;T6新世纪紫外可见分光光度计;N-300型气相色谱仪(氢火焰离子检测器);FTIR-480型红外光谱仪。
1.2 方法
1.2.1 混合单糖标准品溶液的制备[7]
单糖标准品衍生化:称取单糖标准品10mg,放入具塞试管中,加盐酸羟胺10mg、内标7mg、无水吡啶0.5mL,放入90℃水浴中加热30min并振荡使其完全溶解,取出后冷却至室温,加入醋酸酐0.5mL,在90℃下继续反应30min进行乙酰化,冷却后加入少量甲醇,旋蒸除掉溶剂,加入氯仿1mL重新溶解。
分别称取鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖等6种单糖标准品各10mg,按上述方法进行衍生化处理,氯仿溶解,即得混合单糖标准品溶液。
1.2.2 红松松子壳多糖的提取、分离与纯化
称取一定量红松松子壳粉末,用15倍水提取3次,每次2h,合并提取液;经活性炭吸附、离心,再经微滤、超滤分离纯化,木瓜蛋白酶结合Sevage法脱蛋白,大孔吸附树脂脱色,醇沉,离心,得总多糖PPSPⅠ-b。
取一定量PPSPⅠ-b溶于蒸馏水,上样到已平衡的DEAE-52离子交换纤维素柱上,用蒸馏水洗脱,3,5-二硝基水杨酸法(DNS法)跟踪检测,根据洗脱曲线的主峰位合并收集液,透析,干燥,即得红松松子壳多糖纯化组分PPSPⅠ-1。
1.2.3 多糖样品的水解和衍生化[8]
称取红松松子壳多糖样品10mg,置于安瓿瓶中,加入4mol·L-1的三氟乙酸(TFA)2mL,振荡使其溶解,充氮气封管后于110℃水解3h;取出冷却后,将水解液减压蒸干,然后加少量甲醇溶解,再减压蒸干,重复上述操作4~5次以完全除尽TFA。
衍生化步骤同1.2.1。
1.2.4 色谱条件
HP-5型 毛 细 管 色 谱 柱 (30m×0.32mm,0.25 μm),载气为N2,检测器为FID,汽化室温度260℃,检测器温度260℃;程序升温:初温140℃保留5min;以2℃·min-1的速率升温至180℃,保留5min;以2℃·min-1的速率升温至210℃,保留10min。
1.2.5 红外光谱分析[9]
对纯化组分PPSPⅠ-1进行红外光谱分析:取干燥的PPSPⅠ-1样品2mg,以 KBr压片,在4 000~400 cm-1区间进行红外光谱扫描。
2 结果与讨论
2.1 红松松子壳多糖的单糖组成分析
混合单糖标准品溶液、红松松子壳总多糖PPSPⅠ-b和纯化组分PPSPⅠ-1的气相色谱见图1。

图1 混合单糖标准品(a)、PPSPⅠ-b(b)、PPSPⅠ-1(c)的气相色谱Fig.1 The gas chromatogram of mixed monosaccharide standard(a),PPSPⅠ-b(b),PPSPⅠ-1(c)
由图1a可知,6种标准单糖可以得到较好的分离。以肌醇为内标,在混合标准单糖衍生物中逐一加入标准单糖,根据相应色谱峰面积的变化,可鉴定出各单糖的出峰顺序依次为:鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。
由图1b可知,PPSPⅠ-b是由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖等单糖组成的杂多糖,其物质的量比为3.40∶1.40∶0.79∶7.82∶10.67∶18.35。
由图1c可知,PPSPⅠ-1是由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖等单糖组成的杂多糖,其物质的量比为0.96∶2.30∶2.97∶10.60∶6.91。在PPSPⅠ-b和PPSPⅠ-1色谱图保留时间为16min附近均有一个色谱峰,因缺乏相应的标准品未能鉴别归属。
2.2 红松松子壳多糖的结构分析
纯化组分PPSPⅠ-1的红外光谱见图2。
由图2可知,PPSPⅠ-1在1 000~1 200cm-1、2 800~3 000cm-1、3 200~3 500cm-1区域内均具有多糖的特征吸收峰。3 431.27cm-1处为分子间O-H伸缩振动吸收峰;2 933.33cm-1处为C-H伸缩振动吸收峰;1 629.58cm-1处为多糖的水合振动吸收峰;1 452.03cm-1处是C-H 变角振动吸收峰;1 040.48 cm-1处是吡喃糖环的醚键C-O-C的吸收峰,表明PPSPⅠ-1中的单糖是以吡喃糖的形式存在;806.34 cm-1处是α-端基差向异构的C-H变角振动吸收峰。
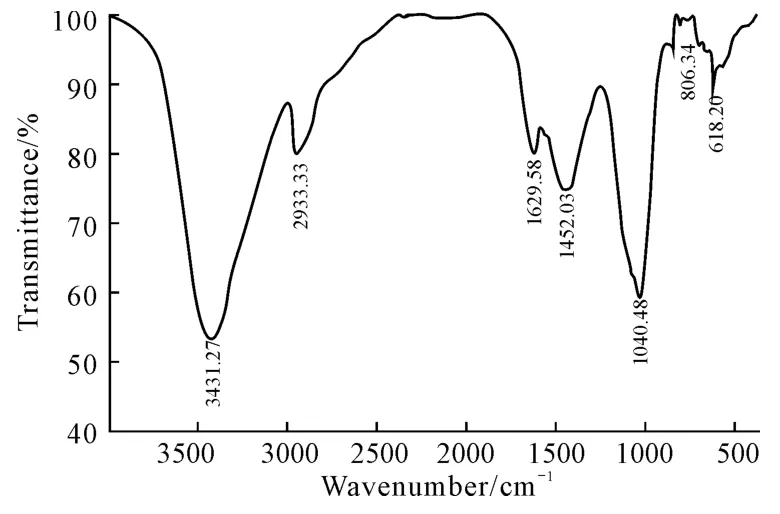
图2 PPSPⅠ-1的红外光谱Fig.2 The FTIR spectrum of PPSPⅠ-1
3 结论
采用膜分离技术对红松松子壳热水提取物进行分离纯化,经脱蛋白、脱色后得到总多糖PPSPⅠ-b,经DEAE-52离子交换纤维素柱层析分离得到纯化组分PPSPⅠ-1。PPSPⅠ-b主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成;PPSPⅠ-1主要由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成;PPSPⅠ-1的红外光谱中具有多糖特征吸收峰,显示其中存在吡喃糖和α-构型糖苷键。
[1]SAKAGAMI H,KONNO K,NONOYAMA M.Anti-HIV agents:US,4985249A[P].1991-01-15.
[2]HARADA H,SAKAGAMI H,NAGATA K,et al.Possible involvement of lignin structure in anti-influenza virus activity[J].Antiviral Res,1991,15(1):41-49.
[3]吕永俊,王士贤,彭芳,等.松果有效成分研究.Ⅵ.红松与油松松塔及松子壳的抗癌活性[J].大理学院学报(综合版),2008,7(2):1-2.
[4]NAGASAWA H,IWAI Y,IWAI M,et a1.Suppression by apine cone extract of Pinus parviflora Sieb et Zucc of mammary tumour virus in milk of mice[J].Anticancer Res,1992,12(3):845-847.
[5]刘中禄,吕铁钢,张永亮.松子壳多糖对小鼠主要免疫细胞功能的影响[J].中国比较医学杂志,2010,20(10):33-37.
[6]张松,徐章荫.多糖类医药生物活性研究进展[J].中国生化药物杂志,1996,17(6):272-274.
[7]康学军,曲见松.白芷多糖中单糖组成的气相色谱分析[J].药物分析杂志,2006,26(7):891-894.
[8]邓颖琳.金针菇子实体多糖的提取、分离纯化及结构鉴定[D].杭州:浙江工业大学,2011.
[9]柳红,张静.用气相色谱和红外光谱对羧甲基化南瓜多糖结构的研究[J].光谱实验室,2008,25(3):313-318.

