茜素红褪色法检测分子印迹膜上血红蛋白
李慕梓,李雨亭,徐青青,谢卫红
(湖北工业大学轻工学部 发酵工程省部共建教育部重点实验室,湖北 武汉430068)
分子印迹聚合物(MIP)是一类针对特定目标合成的具有特异性识别位点及孔穴的新型高分子材料,近年来发展迅速,已有多种蛋白质、糖类、农药、药物和氨基酸衍生物的分子印迹聚合物被研发出来,并在分离分析、固相萃取、化学传感器、类酶催化、检测指示和药物释放等方面得到开发利用[1-3],作为仿生分子识别材料具有广阔的应用前景。
血红蛋白是蛋白质分子印迹技术常用的一种模板蛋白,血红蛋白的检测是评价分子印迹聚合物印迹效率的关键环节。血红蛋白的测定方法有很多种,常规方法有紫外吸收法、Bradford法、双缩脲法和荧光法等。其中双缩脲法适用于定性的快速检测,灵敏度较低,检出限为5~160mg·mL-1,不适于微量蛋白质的检测;Bradford法与紫外吸收法操作简便,检出限均为1μg·mL-1,但容易受到去污剂、表面活性剂等物质的干扰;荧光法的检出限能够达到3μg·mL-1,但由于能够引起荧光猝灭的物质较多,因此对溶液体系要求较高[4-5]。另外,利用血红蛋白是一种色素蛋白的性质也发展了如氰化高铁法、十二烷基月桂酰硫酸钠法等检测方法。氰化高铁法用到的氰化钾试剂有剧毒;十二烷基月桂酰硫酸钠法的检出限为1μg·mL-1,显色稳定、准确度较高,是医学上较常用的血红蛋白检测方法[6]。应用最多的紫外吸收法虽然操作简便,但该方法是间接检测分子印迹聚合物上血红蛋白,存在一定误差。目前,直接检测固相上血红蛋白的方法比较少,如BCA法虽然能够用于固定蛋白的检测,但检出限只能达到10μg·mL-1,而且无法区分分子印迹聚合物上的模板血红蛋白和其它蛋白。因此,发展分子印迹聚合物上血红蛋白的直接检测方法十分必要。
血红蛋白具有与辣根过氧化物酶相同的铁卟啉辅基和相似的空间结构,可替代辣根过氧化物酶作为生物催化剂,用于以过氧化氢为氢受体的反应[7]。在碱性介质中,血红蛋白作为辣根过氧化物模拟酶能够催化过氧化氢产生羟基自由基加速茜素红褪色[8],鉴于此,作者建立了一种操作简便、灵敏度高的直接检测分子印迹膜上血红蛋白的方法。
1 实验
1.1 试剂与仪器
牛血红蛋白、四甲基乙二胺(TEMED)、N,N′-亚甲基双丙烯酰胺、丙烯酰胺、三羟甲基氨基甲烷(Tris),Sigma公司;磷酸二氢钠、磷酸氢二钠、过硫酸铵,国药集团化学试剂有限公司;甘氨酸,Canalab公司;过氧化氢,上海展云化学试剂有限公司;氨水,武汉联碱厂;茜素红,天津广成试剂有限公司;氯化铵,Angus公司。
Lambda 35型紫外可见分光光度计,美国Perkin-Elmer公司;AL104型精密电子分析天平、DELTA 320型精密pH计,梅特勒-托利多仪器有限公司;K5200G型超声波清洗器,昆山超声仪器有限公司;DYY-6C型双稳定时电泳仪、24DN型迷你双垂直电泳槽,北京六一仪器厂;MK-3型全自动多功能酶标仪,赛默飞科技;TS-1型数显脱色摇床,常州奥华仪器有限公司。
1.2 血红蛋白分子印迹膜的制备
按照凝胶度5%、交联度3%的比例称取194mg丙烯酰胺和6mg N,N′-亚甲基双丙烯酰胺溶液溶于2mL PB缓冲溶液(0.01mol·L-1,pH=6.3)中,超声溶解后,加入2mL 1×10-4mol·L-1的血红蛋白溶液,氮气除氧30min,加入35μL 10%过硫酸铵与6 μL TEMED,催化过硫酸铵生成自由基[9]。将聚合液迅速转入2块玻璃板中,室温聚合30min。聚合完成后将水凝胶聚合物切成直径为1cm的圆形。非分子印迹聚合物(NIP)的制备除不加模板分子外,其余步骤同上。
模板蛋白的洗脱:洗脱液为Tris-Gly-SDS溶液[0.05mol·L-1Tris,0.2mol·L-1甘氨酸,1%(质量浓度)SDS],采用电泳洗脱法[10]洗脱3h,随即用PB缓冲溶液(0.01mol·L-1,pH=6.3)反复洗涤3次(每次30min)以除去模板蛋白及残留的洗脱液。
1.3 茜素红褪色法检测血红蛋白浓度的原理
在碱性介质中,血红蛋白作为辣根过氧化物模拟酶能够催化过氧化氢产生羟基自由基加速茜素红的褪色。由紫外可见分光光度计检测茜素红褪色前后的吸光度差值与血红蛋白浓度在一定范围内呈线性关系。因此,测量反应前后印迹膜上茜素红溶液的吸光度差值,即可得到印迹膜上血红蛋白浓度。
1.4 茜素红褪色法检测血红蛋白浓度的方法
将 NH3-NH4Cl(500mol·L-1,pH=10)缓冲溶液、一定浓度的茜素红溶液、一定浓度的过氧化氢溶液、1×10-6mol·L-1的血红蛋白溶液按1∶5∶3∶1的体积比混合[11],室温反应一定时间,测定其在540 nm处的吸光度值A。以不加血红蛋白溶液作为空白,吸光度值为A0。计算吸光度差值△A=A0-A。
依次考察反应时间、茜素红浓度、过氧化氢浓度对催化反应的影响。
1.5 分子印迹膜上血红蛋白浓度的测定
1.5.1 标准曲线的绘制
在1.5mL 离 心管中 依次加入 100μL NH3-NH4Cl缓冲溶液、500μL 1.0×10-4mol·L-1茜素红溶液、300μL 1.0×10-3mol·L-1过氧化氢溶液、100 μL不同浓度的血红蛋白溶液,室温反应35min,用酶标仪测定其在540nm处的吸光度值。按1.4方法计算△A,以血红蛋白浓度(c)为横坐标、△A为纵坐标绘制标准曲线。
1.5.2 印迹膜上血红蛋白浓度的检测
配制浓度为5×10-5mol·L-1、1×10-5mol·L-1、5×10-6mol·L-1、1×10-6mol·L-1、1×10-7mol·L-1、1×10-8mol·L-1的血红蛋白溶液,将洗脱了模板蛋白的分子印迹膜和非分子印迹膜分别置入其中,重结合完成后,将分子印迹膜和非分子印迹膜取出,放置妥当,按优化体系配方依次加入100μL NH3-NH4Cl缓冲溶液、500μL茜素红溶液、300μL过氧化氢溶液,室温反应35min。反应完成后迅速用排枪吸出200μL于96孔板中,于540nm处测定吸光度值,计算吸光度差值△A,以未重结合的分子印迹膜及非分子印迹膜作为空白。
2 结果与讨论
2.1 血红蛋白催化过氧化氢氧化茜素红反应条件的优化
2.1.1 反应时间的确定(图1)
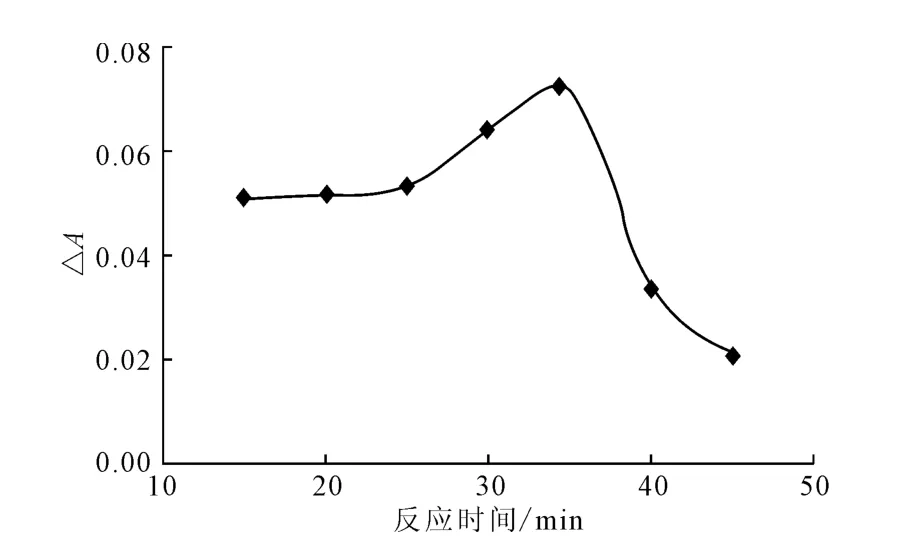
图1 反应时间对吸光度差值的影响Fig.1 The effect of reaction time on the absorbance difference
由图1可知:随着反应时间的延长,吸光度差值缓慢增大;当反应时间为35min时,吸光度差值最大,为0.0708;当反应时间超过35min后,吸光度差值迅速减小。因此,选择适宜的反应时间为35min。
2.1.2 茜素红浓度的确定(图2)
由图2可知,当茜素红浓度为1.5×10-4mol·L-1时,吸光度差值最大。因此,选择适宜的茜素红浓度为1.5×10-4mol·L-1。
2.1.3 过氧化氢浓度的确定(图3)
由图3可知,当过氧化氢浓度为0.01mol·L-1时,吸光度差值最大。因此,选择适宜的过氧化氢浓度为0.01mol·L-1。

图2 茜素红浓度对吸光度差值的影响Fig.2 The effect of concentration of alizarin red on absorbance difference

图3 过氧化氢浓度对吸光度差值的影响Fig.3 The effect of concentration of H2O2on absorbance difference
2.2 分子印迹膜上血红蛋白浓度的测定
2.2.1 茜素红体系检测血红蛋白的标准曲线(图4)

图4 茜素红体系检测血红蛋白的标准曲线Fig.4 The standard curve of hemoglobin determined by alizarin red reaction system
由图4可知,在0.5×10-8~8×10-8mol·L-1范围内,血红蛋白浓度(c)与吸光度差值(△A)之间存在线性关系,拟合线性回归方程为△A=5.74×10-10c+0.0173,相关系数R2=0.9956。
2.2.2 分子印迹膜上血红蛋白的浓度
以重结合血红蛋白浓度为横坐标、吸光度差值△A为纵坐标绘制分子印迹膜和非分子印迹膜的重结合血红蛋白浓度与吸光度差值关系曲线,如图5所示。

图5 重结合血红蛋白浓度与吸光度差值的关系曲线Fig.5 The relationship curves of hemoglobin recombined with absorbance difference
由图5可知,重结合血红蛋白浓度与吸光度差值呈正相关,且分子印迹膜的检测信号强于非分子印迹膜。
进一步根据标准曲线得出血红蛋白的吸附量,如图6所示。

图6 分子印迹膜和非分子印迹膜上血红蛋白的饱和吸附曲线Fig.6 Saturated adsorption curves of hemoglobin on molecular imprinted membrane or non-molecular imprinted membrane
由图6可知,分子印迹膜和非分子印迹膜上血红蛋白的饱和吸附浓度均为1.0×10-6mol·L-1,此浓度下分子印迹膜上血红蛋白的吸附量为8.52μg·mL-1,非分子印迹膜上血红蛋白的吸附量为3.29μg·mL-1,印迹效率α达到2.7。
3 结论
(1)基于血红蛋白作为辣根过氧化物模拟酶能够在碱性介质中催化过氧化氢产生羟基自由基加速茜素红褪色的原理,建立了分子印迹膜上血红蛋白的检测方法。优化的反应体系中茜素红、过氧化氢的最佳浓度分别为1.5×10-4mol·L-1和0.01mol·L-1,反应时间为35min。以丙烯酰胺凝胶包埋血红蛋白制备分子印迹聚合物,并用优化后的体系对分子印迹膜上结合血红蛋白的浓度进行了测定。结果表明,重结合血红蛋白浓度与茜素红吸光度差值呈正相关。
(2)与其它方法相比,茜素红褪色法的检出限较低,能够检测到0.3μg·mL-1(5×10-9mol·L-1)的血红蛋白,由于只有具有活性的血红蛋白才能被测得,因而这种在固相印迹聚合物上检测血红蛋白的方法不仅能够测定血红蛋白的浓度,而且能够直观地表现所测蛋白的性质,在快速检测元件的发展中具有极大的潜力。
[1] WU S G,TAN W G,XU H H.Protein molecularly imprinted polyacrylamide membrane:For hemoglobin sensing[J].Analyst,2010,135(10):2523-2527.
[2]TONG D,HETENYI C,BIKADI Z,et al.Some studies of the chromatographic properties of gels for selective adsorption of proteins[J].Chromatographia,2001,54(1-2):7-14.
[3]OGISO M,MINOURA N,SHINBO T,et al.DNA Detection system using molecularly imprinted polymer as the gel matrix in electrophoresis[J].Biosensors and Bioelectronics,2007,22(9-10):1974-1981.
[4]H·比斯瓦根.酶学实验手册[M].北京:科学出版社,2006:23-24.
[5]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2005:13.
[6]许文荣.临床血液学与检验[M].北京:人民卫生出版社,2007:312-313.
[7]黄应平,刘丰,陈百玲,等.血红蛋白作为过氧化物模拟酶催化测定过氧化氢[J].分析试验室,2003,22(1):1-4.
[8]陈亚红,卜彦林,田丰收.茜素红褪色法测定血红蛋白[J].信阳师范学院学报(自然科学版),2008,21(3):436-438.
[9]丁安子,方桂杰,高琴,等.含酯血红蛋白分子印迹膜的制备[J].化学与生物工程,2010,27(6):24-27.
[10]BOSSI A,ANDREOLI M,BONINI F,et al.‘Gate effect’in templated polyacrylamide membranes influences the electrotransport of proteins and finds applications in proteome analysis[J].Anal Bioanal Chem,2007,389(2):447-454.
[11]PARMPI P,KOUNAS P.Biomimetic glucose recognition using molecularly imprinted polymer hydrogels[J].Biomaterials,2004,25(10):1969-1973.

