格尔德霉素对SMYD3核转位的影响
齐燕南,邢莹莹,奚 涛
(中国药科大学生命科学与技术学院,江苏 南京210009)
在基因组中,除了核酸序列本身,还有许多信息可以调控基因表达并且可以遗传给子代,这就是表观遗传学[1]。表观遗传学主要包括DNA甲基化和组蛋白修饰。其中,组蛋白修饰在转录调控中发挥着重要的作用。组蛋白修饰包括乙酰化、甲基化、磷酸化、核糖基化、瓜氨酸化、泛素化等6种形式[2]。
SMYD3是一种新发现的组蛋白甲基化酶,它包含SET和MYND两个结构域,通过与启动子区域的“5′-CCCTCC-3′”序列结合可以上调下游基因(包括很多原癌基因[3])的表达,在肿瘤发生中有着重要的作用,但SMYD3需要进入细胞核才能发挥其组蛋白甲基化酶的作用。SMYD3的过表达可以促进多种癌细胞的增殖[4-5],而用 RNAi敲除SMYD3则可以明显抑制癌细胞的增殖[6]。罗学刚等[7]研究表明,SMYD3过表达可以促进人乳腺癌细胞的增殖,而抑制组蛋白修饰将促进癌细胞的凋亡[8],说明抑制SMYD3通路有望成为肿瘤治疗的新方法。
格尔德霉素(geldanamycin)是一种HSP90特异性的抑制剂。研究表明,HSP90可以与SMYD3形成复合体促进SMYD3在转录水平的调控[4]。
作者在此研究了格尔德霉素对SMYD3核转位的影响,并探讨了SMYD3核转位受到抑制时对细胞增殖的影响。
1 实验
1.1 材料、试剂与仪器
人乳腺癌细胞株MDA-MB-231,中国药科大学肿瘤药理实验室。
1640、胎牛血清,Gibco公司;胰酶;PBS;二甲基亚砜(DMSO);MTT;核蛋白提取试剂盒,南京凯基;SMYD3多克隆抗体,自制;β-actin多克隆抗体,Santa Cruz公司;脱脂奶粉;蛋白印记发光液,Pierce公司;显影液;定影液;格尔德霉素,上海生工。
RPMI 1640培养基:含10%的胎牛血清、100μg·mL-1的链霉素和100U·mL-1的青霉素。
细胞培养箱,ThermoForma公司;酶标仪,BioRad公司;倒置显微镜,Leica公司;6孔板、96孔板,Corning公司。
1.2 方法
1.2.1 Western blot法检测SMYD3核转位
将 MDA-MB-231细胞(在 RPMI 1640培养基中于5%CO2、37℃培养箱中培养)接种于6孔板中培养至70%融合。将格尔德霉素溶于DMSO,加至6孔板中,使每孔的格尔德霉素终浓度(μmol·L-1)分别为0.03、0.06、0.12、0.24、0.48,继续培养24h。将细胞用胰酶消化,离心,PBS洗2遍,按照核蛋白提取试剂盒说明提取核蛋白和胞质蛋白。蛋白浓度用BCA法测定。
取蛋白样品50μg进行电泳(SDS-PAGE):分离胶为10%,浓缩胶为5%,起始电压为80V,电泳至分离胶时调为120V,继续电泳2h。电泳完成后半干式转移到NC膜上。一抗4℃过夜孵育,二抗室温1h孵育,用ECL发光液暗室显色,考察格尔德霉素对SMYD3核转位的影响。
1.2.2 MTT比色法检测 MDA-MB-231细胞的增殖
将MDA-MB-231细胞以每孔5×103个接种于96孔板,培养至70%融合,加入不同浓度(0.03、0.06、0.12、0.24、0.48,μmol·L-1)格尔德霉素继续培养24h,向待测每孔加入20μL浓度为5mg·mL-1的MTT,37℃继续孵育4h,加入150μL的DMSO,用酶标仪在波长570nm处测定吸光度(吸光度与细胞存活数成正比),考察格尔德霉素对 MDA-MB-231细胞增殖的影响。
2 结果与讨论
2.1 格尔德霉素对SMYD3核转位的影响
经过24h不同浓度格尔德霉素处理后,提取MDA-MB-231细胞的核蛋白和胞质蛋白,采用 Western blot法检测SMYD3的入核情况,结果见图1。
由图1可见,随着格尔德霉素浓度的增大,入核的SMYD3逐渐减少,说明格尔德霉素能浓度依赖性地抑制SMYD3的入核。
2.2 格尔德霉素对MDA-MB-231细胞增殖的影响(图2)
由图2可知,格尔德霉素具有较好的抗肿瘤能力,浓度为0.03mol·L-1时就对 MDA-MB-231细胞增殖有明显的抑制作用。表明格尔德霉素可以通过抑制SMYD3的核转位抑制MDA-MB-231细胞的增殖。
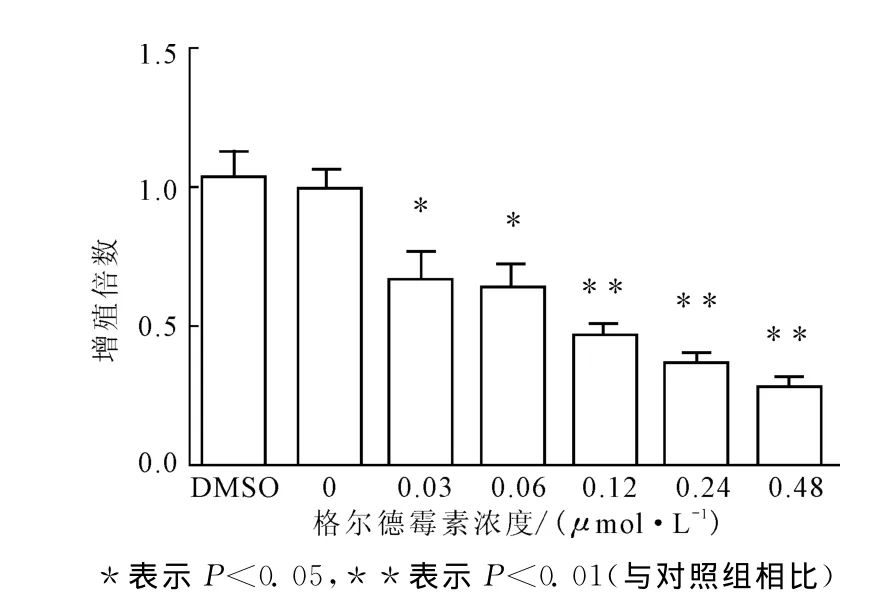
图2 格尔德霉素对MDA-MB-231细胞增殖的影响Fig.2 Effect of geldanamycin on the proliferation of cancer cells MDA-MB-231
3 结论
采用Western blot检测法研究了不同浓度的格尔德霉素对人乳腺癌细胞 MDA-MB-231中SET 和MYND结构域蛋白3(SMYD3)核转位的影响,采用MTT比色法检测了格尔德霉素对人乳腺癌细胞MDA-MB-231增殖的影响。结果表明:格尔德霉素可以抑制SMYD3的核转位,并且这种抑制作用是浓度依赖性的;与对照组相比,人乳腺癌细胞 MDA-MB-231的增殖速率被显著地抑制了。说明格尔德霉素可以通过抑制SMYD3的核转位显著抑制人乳腺癌细胞MDA-MB-231的增殖。
[1]MURRELL A,RAKYAN V K,BECK S.From genome to epigenome[J].Hum Mol Genet,2005,14(S1):R3-R10.
[2]KHORASANIZADEH S.The nucleosome:From genomic organization to genomic regulation[J].Cell,2004,116(3):259-272.
[3]SIMS R J,REINBERG D.From chromatin to cancer:A new histone lysine methyltransferase enters the mix[J].Nat Cell Biol,2004,6(8):685-687.
[4]HAMAMOTO R,FURUKAWA Y,MORITA M,et al.SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J].Nat Cell Biol,2004,6(8):731-740.
[5]HAMAMOTO R,SILVA F P,TSUGE M,et al.Enhanced SMYD3expression is essential for the growth of breast cancer cells[J].Cancer Sci,2006,97(2):113-118.
[6]徐鋆耀,陈立波,徐鋆阳,等.短发夹状RNA抑制SMYD3基因在HepG2细胞中的表达[J].中华肝脏病杂志,2006,14(2):105-108.
[7]罗学刚,林超,陆云华,等.SMYD3与细胞增殖相关性及其对细胞周期的影响[J].中国药科大学学报,2007,38(3):277-282.
[8]HORING E,PODLECH O,SILKENSTEDT B,et al.The histone deacetylase inhibitor trichostatin a promotes apoptosis and antitumor immunity in glioblastoma cells[J].Anticancer Res,2013,33(4):1351-1360.

