1,2,3-三氮唑桥连水杨醛类席夫碱菊糖衍生物的合成及抑菌活性研究
胡云霞,李琬聪,周婷婷,郭占勇
(1.中国科学院烟台海岸带研究所 海岸带生物学与生物资源利用重点实验室,山东 烟台264003;2.中国科学院大学,北京100049)
菊糖广泛存在于30 000多种植物中,是一种天然的、可生物降解的植物性多糖[1-2],在菊苣、菊芋、雪莲果、大丽花等菊科植物的块根块茎中储量较为丰富[3]。通过对菊糖高附加值利用的研究,可以提高菊糖的经济价值,研发新型农业杀菌剂,减轻环境污染,改善人们生活质量,调动人们种植菊芋等盐生植物的积极性,推动生态环境的修复和利用。国内外对于菊糖的研究大多集中在菊糖的提取纯化、菊糖自身的生理功能等方面,对于菊糖化学修饰的研究也多为酯化、醚化、羧甲基化等作为表面活性剂应用于洗涤剂等日用化工行业[4-5],关于菊糖衍生物作为农业领域中抗菌剂、杀菌剂的应用鲜有报道。
席夫碱的基本结构中含有亚胺(-CH=N)结构,可通过活泼的羰基与氨基反应得到,其特有的化学结构赋予席夫碱优良的生物化学活性,广泛应用于抗菌剂、消炎剂等的合成[6]。
1,2,3-三氮唑类氮杂环化合物具有广泛的生物活性,在抗真菌、抗细菌、抗HIV以及治疗关节炎、神经性精神错乱和恶性肿瘤方面有显著疗效[7],广泛应用于DNA、RNA、多肽和糖类等化合物的结构改造中,并表现出良好的效果。
鉴于此,作者根据活性叠加原理,首先利用丙炔胺与水杨醛及其卤代衍生物合成席夫碱中间体,然后再通过Huisgen-Click反应(即一价铜盐催化端基炔和叠氮化合物发生1,3-偶极环加成生成1,4-二取代1,2,3-三氮唑的反应[8-9]),将中间体与叠氮代菊糖分子通过1,2,3-三氮唑桥连,最后对桥连产物脱乙酰化得到含有1,2,3-三氮唑和席夫碱官能团的新型菊糖衍生物(4a~4c),并测定其抑菌活性、评价其杀菌性能,为寻找环境友好、低毒、安全、高效的生物抑菌制剂提供参考。
1 实验
1.1 材料、试剂与仪器
菊糖(纯度≥90%),北京威德生物科技有限公司。
黄瓜炭疽病菌(Colletotrichum lagenarium)、西瓜枯萎病菌(Fusarium oxysporium)、芦笋茎枯病菌(Phomopsis asparagi)均来自青岛农业科学院。
丙炔胺、水杨醛、5-氯水杨醛、5-溴水杨醛、N-溴代丁二酰亚胺(NBS)、三苯基膦(PPh3)、叠氮钠(NaN3)、三乙胺(Et3N)、乙酸酐(Ac2O)、N,N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)等合成实验所用试剂均为分析纯;真菌培养基、琼脂粉等活性实验所用试剂均为生化纯;多菌灵。
XS10500型电子天平,瑞士Mettler Toledo公司;MF-D105型恒温油浴锅,郑州长城科工贸有限公司;FD-1C-80型冷冻干燥机,北京博医康实验仪器有限公司;FTIR-6300型红外光谱仪,日本Jasco公司;SWCJ-2F型超净工作台,苏州安泰有限责任公司;LOZX-50KB型高压灭菌锅,上海申安医疗器械厂;SHZ-B型水浴恒温振荡器,上海博讯实业有限公司。
1.2 方法
1.2.1 合成路线(图1)

图1 目标化合物4a~4c的合成路线Fig.1 Synthetic route of target compounds 4a~4c
1.2.2 合成方法
1)水杨醛类丙炔胺席夫碱(1a~1c)的合成[10]
分别取水杨醛、5-氯水杨醛、5-溴水杨醛10mmol溶于50mL乙醇中,搅拌,恒压缓慢滴加10mmol丙炔胺,于70℃水浴回流反应4h,反应结束后静置冷却,待结晶后过滤,冷冻干燥,得化合物1a~1c。
2)C-6脱氧叠氮代乙酰化菊糖衍生物(2)的合成[11-12]
取10mmol菊糖、50mmol NBS溶于100mL DMF中,冰浴条件下搅拌至溶解完全;取50mmol PPh3溶于50mL DMF中,缓慢加入反应液中,冰浴条件下继续搅拌20min,然后置于80℃油浴中反应3 h;用丙酮沉淀,洗涤,抽滤,将所得产物溶于100mL吡啶中,加入15mL乙酸酐,室温反应12h;用冰水沉淀,洗涤,索氏提取36h,冷冻干燥,得C-6脱氧溴代乙酰化菊糖;取10mmol溶于100mL DMF中,加入15 mmol NaN3,于80℃反应4h;用冰水沉淀,洗涤,索氏提取36h,冷冻干燥,得化合物2。
3)1,2,3-三氮唑桥连水杨醛类席夫碱乙酰化菊糖衍生物(3a~3c)的合成[12]
取10mmol化合物2溶于150mL DMSO中,然后加入1mmol CuI和10mmol Et3N,于70℃油浴条件下搅拌,用恒压漏斗分别滴加15mmol化合物1a~1c,惰性气体保护,搅拌48h,反应结束冷却至室温,用乙醚-异丙醇(3∶1)400mL沉淀,抽滤,用水洗涤,冷冻干燥,得化合物3a~3c。
4)1,2,3-三氮唑桥连水杨醛类席夫碱菊糖衍生物(4a~4c)的合成
分别取1mmol化合物3a~3c于10mL 2mmol·mL-1的 MeOH/MeONa溶液中,室温搅拌3h,抽滤,甲醇洗涤,冷冻干燥,得目标化合物4a~4c。
1.2.3 红外光谱分析
采用KBr压片法,在4 000~400cm-1范围内扫描,进行红外光谱分析。
1.2.4 抑菌活性测定
采用菌丝生长速率法[13]研究目标化合物4a~4c在浓度分别为1 000μg·mL-1、500μg·mL-1、100 μg·mL-1时对黄瓜炭疽病菌、西瓜枯萎病菌、芦笋茎枯病菌的抑制活性:将冰箱内保存的菌种经2次转管复壮后备用,用直径5mm的打孔器在新鲜菌落的外围打取菌饼接种;然后置于27℃培养箱中培养48h或72h后,用十字交叉法测量菌落直径(D)。每个样品重复测定2次,以商品化多菌灵为对照药剂,等量蒸馏水为空白对照。依下式计算抑菌率:

2 结果与讨论
2.1 红外光谱分析
菊糖、化合物2、3a~3c以及目标化合物4a~4c的红外光谱如图2所示。
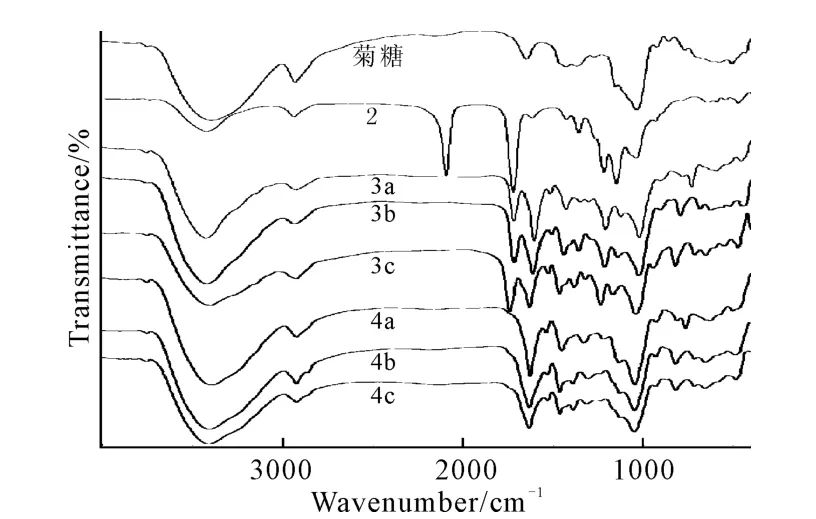
图2 菊糖、化合物2、3a~3c、4a~4c的红外光谱Fig.2 FTIR Spectra of inulin,compound 2,3a~3c,4a~4c
从图2可知:菊糖骨架的特征峰为848cm-1、1 029cm-1和3 390cm-1;与菊糖相比,化合物2红外光谱中新增加的2 105cm-1处的吸收峰为叠氮基的强烈振动峰[14],1 735cm-1处为乙酸酐保护后引入的乙酰基的特征吸收峰[15];当叠氮代乙酰菊糖与水杨醛类丙炔胺席夫碱中间体通过1,2,3-三氮唑桥连后,化合物3a~3c红外光谱中叠氮基2 105cm-1处的强烈振动峰消失,同时在1 527~1 531cm-1、1 461~1 465 cm-1、713~821cm-1、651~659cm-1范围内出现振动吸收,推断为苯环和三唑环的振动叠加特征峰[12-15],1 627~1 631cm-1处出现席夫碱-CH=N基团的特征吸收峰[16],1 041~1 045cm-1处的吸收峰与化合物2相比明显增强,推断为1,2,3-三氮唑上与菊糖C-6位相连的C-N的特征吸收峰;用MeOH/MeONa脱保护后,化合物4a~4c的红外光谱中1 735cm-1左右的吸收峰消失,其它特征峰没有明显变化。证明水杨醛类丙炔胺席夫碱已经通过Huisgen-Click反应与菊糖桥连生成含1,2,3-三氮唑的水杨醛类席夫碱的菊糖衍生物。
2.2 目标化合物4a~4c的抑菌活性
不同浓度下,菊糖、化合物4a~4c对黄瓜炭疽病菌、西瓜枯萎病菌、芦笋茎枯病菌的抑菌率如图3所示。

图3 菊糖、化合物4a~4c对黄瓜炭疽病菌(a)、西瓜枯萎病菌(b)、芦笋茎枯病菌(c)的抑菌活性Fig.3 Antifungal activities of inulin,compound 4a~4cagainst Colletotrichum lagenarium(a),Fusarium oxysporium(b),Phomopsis asparagi(c)
从图3可看出,菊糖没有明显的抑菌活性,而目标化合物4a~4c的抑菌活性明显强于菊糖,且随着浓度的增大逐渐增强。化合物4a的抑菌活性最好,500μg·mL-1时,对3种植物真菌的抑制率分别为40.5%、33.3%、41.9%,高 于 菊 糖 的 8.3%、6.2%、9.7%;1 000μg·mL-1时,对3种植物真菌的抑菌率分别达66.7%、42.0%、58.1%,远 高 于 菊 糖 的 8.3%、11.3%、9.9%。化合物4a~4c对黄瓜炭疽病菌的抑菌活性强于西瓜枯萎病菌和芦笋茎枯病菌。在500 μg·mL-1和1 000μg·mL-1时,化合物4a~4c对3种植物真菌的抑菌活性均强于菊糖。
2.3 讨论
Huisgen-Click反应一般需要叠氮基和端基炔2个配体。本实验首先通过溴代激活菊糖C-6位的羟基,使其变成易离去基团,然后叠氮基进攻易离去基团,发生SN亲核置换反应,将溴取代得到叠氮代配体。
菊糖是一种多羟基化合物,具有较强的吸湿性、水溶性,在大多数有机溶剂中的溶解性均十分优良,增大了反应后处理的难度,同时也降低了产率。为了解决该问题,本实验先采用“一锅法”利用乙酸酐对溴代菊糖上的极性羟基进行乙酰基保护,制备得到疏水性溴代乙酰化菊糖衍生物,使得反应后处理过程中可以对产物直接用水沉淀并且洗涤,大大提高了反应中间体的产率;然后再利用 MeOH/MeONa对1,2,3-三氮唑桥连水杨醛类席夫碱乙酰化菊糖衍生物脱乙酰基,释放羟基,增大目标产物的极性,以使其更好地分散于水中,有利于发挥抑菌活性。
由抑菌结果可以看出,不同卤素取代基的抑菌活性相差不大,且低于不含卤素衍生物的抑菌活性。表明,芳环上取代基的吸电子效应对化合物抑菌活性的提高没有明显作用。在菊糖分子中引入席夫碱和1,2,3-三氮唑,可以明显提高菊糖对真菌的抑制活性,实现活性叠加的目的。这一结果与有关席夫碱和1,2,3-三氮唑能够提高化合物抑菌活性的报道相吻合[17-18]。
3 结论
采用化学方法对菊糖进行结构修饰,通过1,2,3-三氮唑桥连水杨醛类席夫碱于菊糖分子中得到新型三氮唑类菊糖衍生物,其抑菌活性相比于菊糖有明显提高。该研究不仅为环境友好型农业杀菌剂的开发提供了参考依据,而且为菊糖的高值化利用开辟了新的领域,有助于推动菊芋的种植开发,提高盐碱地的利用率。
[1]WICHIENCHOT S,THAMMARUTWASIK P,JONGJAREONRAK A,et al.Extraction and analysis of prebiotics from selected plants from southern Thailand[J].Songklanakarin Journal of Science & Technology,2011,33(5):517-523.
[2]APOLINARIO A C,de LIMA DAMASCENO B P G,de MACEDO BELTRAO N E,et al.Inulin-type fructans:A review on different aspects of biochemical and pharmaceutical technology[J].Carbohydrate Polymers,2014,101:368-378.
[3]de OLIVEIRA A J B,GONCALVES R A C,CHIERRITO T P C,et al.Structure and degree of polymerisation of fructooligosaccharides present in roots and leaves of Stevia rebaudiana(Bert.)Bertoni[J].Food Chemistry,2011,129(2):305-311.
[4]VARSHNEY V K,GUPTA P K,NAITHANI S,et al.Carboxymethylation ofα-cellulose isolated from Lantana camara with respect to degree of substitution and rheological behavior[J].Carbohydrate Polymers,2006,63(1):40-45.
[5]YUEN S N,CHOI S M,PHILLIPS D L,et al.Raman and FTIR spectroscopic study of carboxymethylated non-starch polysaccharides[J].Food Chemistry,2009,114(3):1091-1098.
[6]JIAO T F,ZHOU J,ZHOU J X,et al.Synthesis and characterization of chitosan-based Schiff base compounds with aromatic substituent groups[J].Iranian Polymer Journal,2011,20(2):123-136.
[7]RECK F,ZHOU F,GIRARDOT M,et al.Identification of 4-substituted 1,2,3-triazoles as novel oxazolidinone antibacterial agents with reduced activity against monoamine oxidase A[J].Journal of Medicinal Chemistry,2005,48(2):499-506.
[8]ERIKSEN E,MELSEN F,SOD E,et al.Effects of long-term risedronate on bone quality and bone turnover in women with postmenopausal osteoporosis[J].Bone,2002,31(5):620-625.
[9]KOLB H C,FINN M,SHARPLESS K B.Click chemistry:Diverse chemical function from a few good reactions[J].Angewandte Chemie International Edition,2001,40(11):2004-2021.
[10]张强华,固旭.含卤席夫碱的合成及抑菌活性观察[J].西北药学杂志,2001,16(6):284-285.
[11]MA L S,CHEN H X,ZHANG Y,et al.Chemical modification and antioxidant activities of polysaccharide from mushroomInonotus obliquus[J].Carbohydrate Polymers,2012,89(2):371-378.
[12]IFUKU S,WADA M,MORIMOTO M,et al.Preparation of highly regioselective chitosan derivatives via“Click Chemistry”[J].Carbohydrate Polymers,2011,85(3):653-657.
[13]de RODRIGUEZ D J,HERNANDEZ-CASTILLO D,ANGULOSANCHEZ J.Antifungal activity in vitro of Flourensiaspp.extracts on Alternariasp.,Rhizoctonia solani,and Fusarium oxysporum[J].Industrial Crops and Products,2007,25(2):111-116.
[14]REN J,WNAG P,DONG F,et al.Synthesis and antifungal properties of 6-amino-6-deoxyinulin,a kind of precursors for facile chemical modifications of inulin[J].Carbohydrate Polymers,2012,87(2):1744-1748.
[15]ZHONG Z M,AOTEGEN B,XU H,et al.Structure and antimicrobial activities of benzoyl phenyl-thiosemicarbazone-chitosans[J].International Journal of Biological Macromolecules,2012,50(4):1169-1174.
[16]袁泽利,张欣,吴庆,等.壳聚糖嫁接大环席夫碱Cu(Ⅱ)配合物的合成及其抗氧活性研究[J].分子科学学报(中英文版),2013,29(3):246-250.
[17]KUMAR S,KUMARI M,DUTTA P K,et al.Chitosan biopolymer Schiff base:Preparation,characterization,optical,and antibacterial activity[J].International Journal of Polymeric Materials,2014,63(4):173-177.
[18]LV J S,PENG X M,KISHORE B,et al.1,2,3-Triazole-derived naphthalimides as a novel type of potential antimicrobial agents:Synthesis,antimicrobial activity,interaction with calf thymus DNA and human serum albumin[J].Bioorganic & Medicinal Chemistry Letters,2014,24(1):308-313.

