丙谷二肽对γ射线致小鼠肺组织损伤的防护作用*
任雪玲,汤 宁,白 丽,陈 斌,李莹辉,赵玉芬
1)郑州大学药学院 郑州 450001 2)郑州大学第一附属医院感染科 郑州 450052 3)航天医学基础与应用国家重点实验室 北京 100094 4)郑州大学化学与分子工程学院河南省磷化工工程研究中心 郑州 450052
60Co-γ射线等电离辐射源是临床上常用的放疗用射线,可用于肺癌及其他胸部肿瘤的放射治疗[1]。然而,γ射线尽管具有较强的病变细胞杀死效应,但同时也会不可避免地引起机体正常组织和器官的损伤,不仅可对患者造成放射性损伤[2],而且也会给受照医护人员带来一定程度的危害。因此如何减轻辐射损伤受到人们的日益关注。有研究[3]显示,γ射线对肺组织和细胞的损伤主要是由于它可以促进活性氧自由基的生成,从而造成有机体生物分子断裂、DNA 损伤。N(2)-L-丙氨酰-L-谷氨酰胺(丙谷二肽)是临床上常用的一种营养药物。据报道,丙谷二肽除可提高组织和细胞的免疫功能外[4],还可以提高细胞内谷胱甘肽的含量,从而有效清除过氧化物[5]。作者先对小鼠进行丙谷二肽灌胃给药,然后再进行γ射线全身照射,观察小鼠肺组织辐射损伤变化情况,并分析肺组织中Bcl-2和Bax蛋白表达的变化,探讨丙谷二肽对肺组织辐射损伤的防护作用及可能的机制,为临床放射防护药物的开发应用提供一定的实验依据。
1 材料与方法
1.1 材料 雄性昆明小鼠27只,体重(20±2)g,6~8周龄,由河南省实验动物中心提供。丙谷二肽由厦门大学化学系提供。兔抗小鼠Bcl-2、Bax多克隆抗体购自Santa Cruz公司,β-actin鼠源单克隆抗体购自康成生物公司。Trizol、碘化丙啶(PI)、MTT等生化试剂购自创生科技有限公司。超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所。RIPA裂解液购自北京鼎国生物技术有限责任公司。FCC-8000型同心回转式60Co治疗机购自山东新华医疗器械股份有限公司,参数设定为源皮距80 cm,布野面积20 cm×20 cm,剂量1 Gy/min。
1.2 实验分组 将27只小鼠随机分为3组,分别为正常对照组、辐射组、丙谷二肽组,每组9只。丙谷二肽组灌胃给予丙谷二肽,给药剂量1000 mg/kg,1次/d,连续7 d。第8天,辐射组、丙谷二肽组均给予4.0 Gy60Co γ射线照射,正常对照组不作处理。射线照射3 d后,将3组小鼠脱颈处死,收集有关脏器,进行相关指标的测定。
1.3 外周血白细胞总数检测 小鼠脱颈处死前摘眼球眼眶取血,加入体积分数1%盐酸,混匀后置于细胞计数板中进行白细胞计数,并按照以下公式换算成白细胞总数。白细胞总数(×109L-1)=细胞计数板中白细胞数÷4×稀释倍数×107。
1.4 脏器指数测定 取脾脏、肺脏称重,按照下列公式计算脏器指数。脏器指数=脏器重(mg)/体重(g)×100%。
1.5 肺组织学观察和SOD活性测定 取出肺叶组织,生理盐水清洗干净后甲醛固定24 h,然后脱水、固定、切片、HE染色,光学显微镜下观察。分离小鼠肺脏,按照SOD试剂盒说明书操作,测定SOD活性。
1.6 肺组织细胞增殖和凋亡的检测 ①将肺组织取出,剪碎并匀浆,200目滤网过滤得到单细胞悬液,过夜培养,加入MTT继续培养4 h,加入二甲基亚砜溶解蓝紫色结晶,测定570 nm波长处的吸光度(A)值。细 胞 增 殖 率 = [(A实验组- A空白)/(A正常对照组-A空白)]×100%。②将小鼠肺组织剪碎、匀浆滤网过滤后,PBS洗涤,用结合缓冲液重悬细胞,加入 5 μL FITC AnnexinV 和 5 μL PI染料,混合均匀后室温避光放置15 min,上流式细胞仪检测,使用ModFit LT for Mac V3.0软件分析细胞凋亡率。
1.7 肺组织中 Bcl-2和 Bax蛋白的检测 采用Western blot法检测。向肺组织中加入RIPA裂解液,冰浴条件下匀浆提取蛋白,BCA法进行蛋白定量,采用常规SDS-PAGE法进行垂直电泳、转膜和封闭后,分别加入 Bcl-2一抗(稀释1000倍)、Bax一抗(稀释1000倍)或β-actin一抗(稀释2000倍)4℃过夜孵育。TBST洗涤3次后加入二抗(稀释5000倍)室温孵育1 h。最后采用ECL化学发光法进行显影、定影。用Quantity One图像分析软件分析条带的光密度,以目的蛋白与β-actin条带光密度的比值表示目的蛋白的相对表达量。
1.8 统计学处理 采用SPSS 10.0进行统计学分析。3组小鼠外周血白细胞总数、脏器指数、肺组织SOD活性、细胞凋亡率、Bcl-2和Bax蛋白表达水平的比较采用单因素方差分析和LSD-t检验,辐射组和丙谷二肽组细胞增殖率和Bcl-2/Bax比值的比较采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 组织学观察 见图1。正常对照组小鼠肺组织形态自然,间质少;辐射组小鼠肺组织出现异常,毛细血管通透性增加,血管内细胞渗出进入肺间质,肺泡壁增厚;丙谷二肽组小鼠肺组织学变化较辐射组有所减轻。
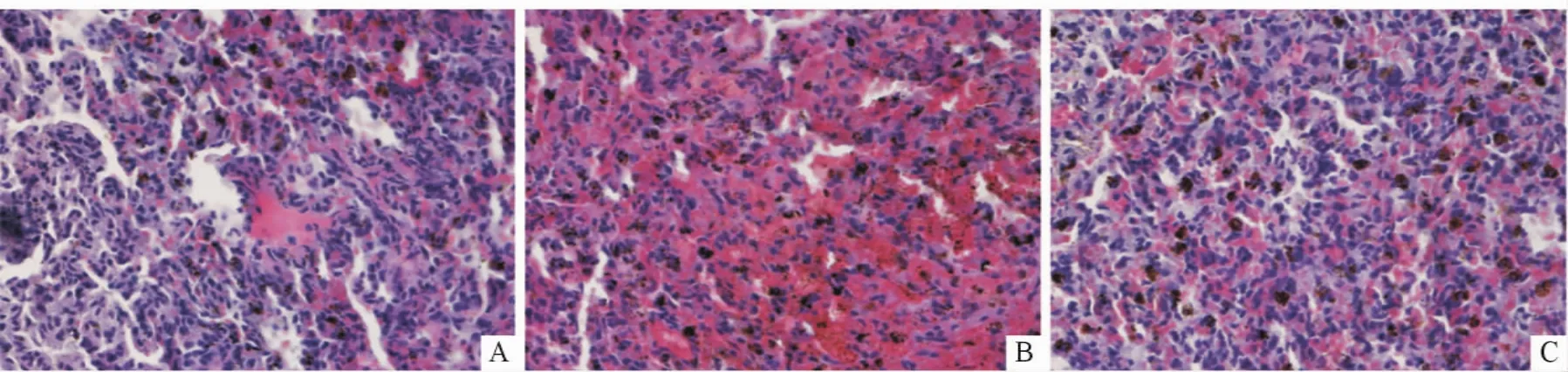
图1 3组小鼠肺组织学表现(HE,×400)
2.2 3组小鼠外周血白血细胞总数、脏器指数、肺组织SOD活性的比较 见表1。由表1可知,与正常对照组相比,辐射组小鼠外周血白细胞总数、脾脏指数下降,肺脏指数升高,肺组织SOD活性降低。与辐射组比较,丙谷二肽组小鼠肺脏指数下降,肺组织SOD活性升高。
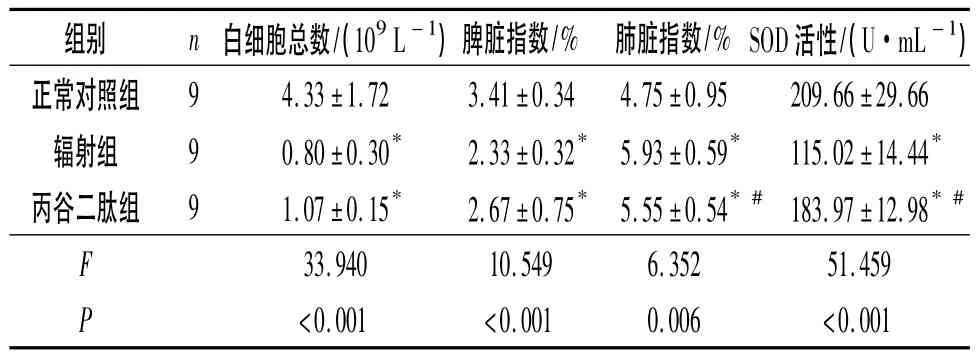
表1 3组小鼠白细胞总数、脏器指数和肺组织SOD活性的比较
2.3 3组小鼠肺组织细胞增殖率和凋亡率的比较丙谷二肽组细胞增殖率为(78.88±3.87)%,较辐射组的(57.25 ±11.63)% 提高(t=5.294,P <0.001);细胞凋亡率亦较辐射组降低,见表2。
2.4 3组小鼠肺组织中Bcl-2和Bax蛋白表达的比较 见图2、表2。

图2 3组小鼠肺组织中Bcl-2和Bax蛋白的表达
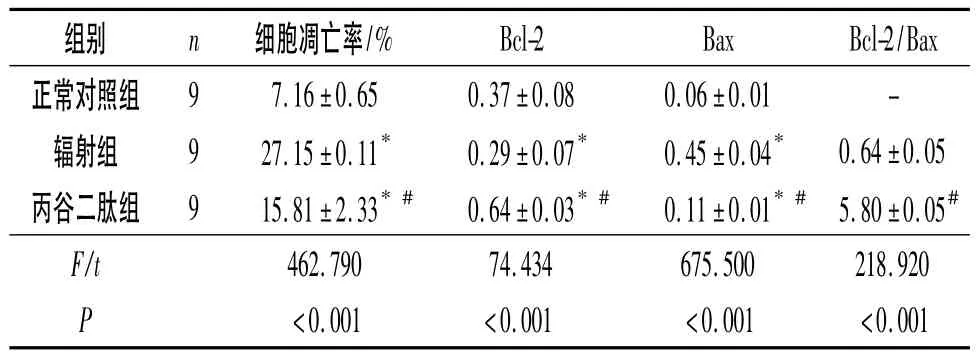
表2 3组小鼠肺组织中细胞凋亡率、Bcl-2和Bax蛋白表达的比较
3 讨论
胸部恶性肿瘤在进行放射性治疗时,非常容易导致放射性肺损伤,临床表现主要有肺充血,肺泡纤维蛋白渗出增多,甚至出现肺间质纤维化[6]。已有研究[7]表明,氧自由基的大量生成是放射性损伤的主要机制。SOD是一类广泛存在于机体各种组织细胞内的金属酶,主要用于清除超氧阴离子自由基;在辐射损伤的肺组织中,SOD活性与氧自由基水平呈负相关[8]。该研究中,辐射组小鼠肺组织呈放射性损伤改变,同时外周血白细胞总数、脾脏指数显著下降,肺脏指数升高,肺组织SOD活性降低,说明该组小鼠存在放射性肺损伤。与辐射组小鼠比较,丙谷二肽组小鼠放射性肺损伤改变减轻,同时肺脏指数下降,肺组织SOD活性升高,提示丙谷二肽对γ射线照射导致的肺组织损伤确实有一定的防护作用。
氧自由基可以通过多种途径诱导细胞凋亡[9-10],从而对机体造成损伤。细胞凋亡的调控与两类基因直接相关,分别是促凋亡基因和抑制凋亡基因,其中最具代表性的分别是 bcl-2 和 bax[11],其表达产物Bax和Bcl-2蛋白可以形成同源或异源二聚体,在细胞凋亡的调控中发挥关键作用,因此有研究[12-13]称 Bcl-2/Bax 比值是调控细胞凋亡的“分子开关”。该研究中,辐射组小鼠肺组织细胞凋亡率较正常对照组显著升高,同时肺组织中Bcl-2蛋白的表达降低,而Bax蛋白表达升高,说明γ射线照射诱导了肺组织Bax和Bcl-2蛋白表达水平的改变,从而导致细胞凋亡的增加。与辐射组比较,丙谷二肽组小鼠肺组织细胞增殖率显著提高,而凋亡率降低,小鼠肺组织中Bcl-2蛋白表达升高,Bax蛋白表达降低,Bcl-2/Bax比值升高。这表明丙谷二肽有可能通过Bcl-2信号通路介导调控肺组织的细胞凋亡,从而实现对辐射致肺损伤小鼠肺组织的防护。但是,辐射损伤及其防护机制是一个涉及多基因、多通路的网络系统,确切的机制还有待于进一步的深入研究。
[1]Lee WW,Ahn G,Lee BJ,et al.Radio-protective effect of polysacharides isolated from Lactobacillus brevis-fermented Ecklonia cava[J].Int J Bio Macromol,2013,52:260
[2]梅欣,章倩,刘迎玫,等.阿米福汀对大鼠肺放射性肺损伤保护作用的实验研究[J].中国癌症杂志,2013,23(1):1
[3]Donà M,Ventura L,Macovei A,et al.γ irradiation with different dose rates induces different DNA damage responses in Petunia x hybrida cells[J].J Plant Physiol,2013,170(8):780
[4]阳国平,李荣辉,裴奇,等.新型复方氨基酸(19)丙谷二肽注射液临床耐受性试验[J].中国新药与临床杂志,2013,32(1):47
[5]赵敬湘,赵玉芬,怀文辉,等.丙氨酰谷氨酰胺二肽对人脐静脉内皮细胞ECV304缺氧缺糖损伤的保护作用[J].国际药学研究杂志,2009,36(1):6
[6]赵路军.放射性肺损伤相关因素临床及实验室研究[D].北京:中国协和医科大学,2005.
[7]Ohshima Y,Tsukimoto M,Takenouchi T,et al.Gamma-irradiation induces P2X(7)receptor-dependent ATP release from B16 melanoma cells[J].Biochim Biophys Acta,2010,1800(1):40
[8]李倩茗,黄俊杰,韦红巧,等.bFGF对大鼠脑出血血肿周围组织SOD活力、MDA含量和Bax、Bcl-2基因表达的影响[J].中国实用神经疾病杂志,2008,11(12):7
[9]Li HY,Zhang H.Proteome analysis for profiling infertility markers in male mouse sperm after carbon ion radiation[J].Toxicology,2013,306:85
[10]谭永红.放射性肺损伤关键靶细胞电离辐射效应及其调控研究[D].重庆:第三军医大学,2006.
[11]Otterson MF,Nie L,Schmidt JL,et al.EUK-207 protects human intestinal microvascular endothelial cells(HIMEC)against irradiation-induced apoptosis through the Bcl2 pathway[J].Life Sci,2012,91(15/16):771
[12]Korsmeyer SJ,Shutter JR,Veis DJ,et al.Bcl2/Bax:a rheostat that regulates an anti-oxidant pathway and cell death[J].Semin Cancer Biol,1993,4(6):327
[13]Childs AC,Phaneuf SL,Dirks AJ,et al.Doxorubicin treatment in vivo causes cytochrome C release and cardiomyocyte apoptosis,as well as increased mitochondrial efficiency,superoxide dismutase activity,and Bcl-2 ∶ Bax ratio[J].Cancer Res,2002,62(16):4592

