莱菔硫烷抗凋亡对移植大鼠心脏的保护作用
王 帅,伊 雪,邬鹏宇,崔翔宇,杨学慧,王耕野,郑素琴,杨 方,李占清
0 引 言
心肌细胞凋亡在心肌缺血再灌注损伤(ischemia/reperfusion injury,IRI)占有重要地位[1]。莱菔硫烷(Sulforaphane,SFN)能通过抑制心肌细胞凋亡,减轻离体心脏的心肌IRI[2],然而对心脏移植的IRI是否有保护作用尚未见报道。本实验通过建立大鼠腹腔同种异体异位心脏移植模型,观察SFN是否通过调控细胞凋亡来减轻心脏移植的IRI。
1 材料与方法
1.1 材料 健康雄性Lewis大鼠60只,BN大鼠20只,3月龄,体重200~220g,购自北京维通利华实验动物技术有限公司,合格证号:SCXX(京)2011-0007,清洁级(SPF),饲养于河北联合大学动物实验中心,自由进食饮水,室温控制在(25±2)℃,单笼饲养,自然光照。SFN购自美国Sigma公司,HTK液(德国克勒化学制药生产)由德国海德堡大学提供,抗Caspase-3抗体购自英国Abcam公司,Tunel试剂盒购自德国Calbiochem公司。
1.2 实验分组及模型建立 Lewis大鼠40只,配对比较法随机分为2组,每组20只。对照组:受体大鼠于移植前24 h经尾静脉注射等渗盐水0.5 mL;实验组:受体大鼠于移植前24 h经尾静脉注射SFN 2.5 mg/kg。实验组和对照组的供心均冷藏于4℃ HTK液18h,建立大鼠心脏移植模型[3]。具体操作如下:经大鼠腹腔注射苯巴比妥钠(20 mg/kg)、肌内注射氯胺酮(100mg/kg)麻醉后,摘取供体大鼠心脏,将供心升主动脉、肺动脉与受体大鼠腹主动脉、下腔静脉端侧吻合;吻合完毕后放开阻断夹见冠状动脉充血,5~10s心脏复跳,检查吻合口无出血,关腹。
1.3 移植心脏存活时间 20只BN大鼠作为供体,20只Lewis大鼠作为受体,每组各10只。对照组及实验组的处理同上述。建立心脏移植模型后,每天早晚2次触摸受体腹部,了解移植心脏跳动情况,直至其停止跳动,记录移植心脏存活天数,使用Kaplan-Meier分析其生存率。
1.4 观察指标 ①生存率:采用Kaplan-Meier方法进行生存率分析;②移植心脏功能:采用半定量方法评价移植心脏的功能[4],即心脏吻合完毕后放开阻断夹,然后通过直接触诊、肉眼及显微镜观察移植物来评价移植心脏的功能,共分为4分。1分:能通过显微镜可见肌束颤动和肌纤维颤动,但触摸不到;2分:能触摸到弱的或局部的心肌收缩;3分:两心室同源性收缩,但心跳的频率和强度降低;4分:收缩的强度和频率正常。③心肌细胞凋亡指数:移植后24h摘取移植心脏,留取心肌组织标本,应用Tunel法检测心肌细胞凋亡。④心肌组织中Caspase-3蛋白的表达:移植后24h摘取移植心脏,留取心肌组织标本,应用免疫组织化学检测心肌组织Caspase-3蛋白表达,并按照半定量分析方法进行免疫组化评分[5]。
1.5 统计学分析 采用SPSS 17.0统计软件进行分析。计量资料数据以均数±标准差()表示,组间比较采用t检验,采用Kaplan-Meier方法进行生存率分析,组间比较用 Logranke检验。以 P≤0.05为差异有统计学意义。
2 结 果
2.1 生存率 采用Kaplan-Meier方法进行生存率分析,实验组移植心脏的中位生存期与对照组比较明显提高(7 d vs 5 d,P <0.05),见图1。
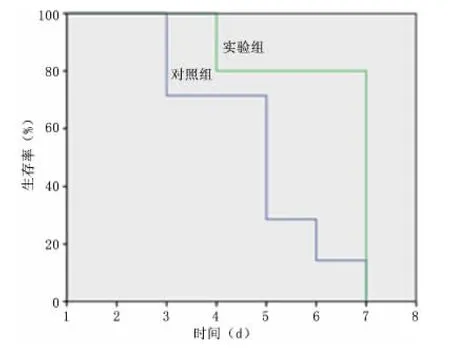
图1 2组大鼠移植心脏存活时间比较Figure 1 Comparison of the survival time of the transplanted heart in rats
2.2 移植心脏功能评分 移植后实验组移植心脏的功能评分较对照组明显提高[(3.67±0.21)分 vs(2.44±0.29)分],差异有统计学意义(P <0.05)。见表1。
2.3 心肌组织中Caspase-3蛋白的表达 对照组大量的心肌细胞细胞质呈阳性染色,且染色较深;实验组细胞质呈阳性染色较浅,见图2。与对照组相比,实验组大鼠心脏组织中Caspase-3蛋白免疫组化评分明显下降[(1.38 ±0.14)分 vs(2.03 ±0.21)分,P=0.039],见表1。

图2 移植24h后2组大鼠心肌组织中Caspase-3蛋白的表达(IHC ×200)Figrue 2 Expression of Caspase-3 in myocardium tissues at 24h after heart transplantation in rats(IHC×200)
2.4 心肌细胞凋亡指数 对照组大量的心肌细胞核染成褐色或棕褐色,可见大量的凋亡细胞;实验组凋亡细胞明显减少。见图3。移植24 h后,实验组供心心肌细胞凋亡指数较对照组显著降低(0.56±0.04 vs 0.78 ±0.01,P <0.05),见表1。
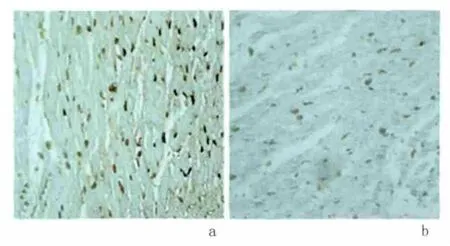
图3 移植24h后2组大鼠心肌细胞凋亡比较(TUNEL ×400)Figure 3 Myocardial apoptosis at 24 h after heart transplantation in rats(TUNEL×400)
表1 大鼠移植心脏功能评分、Caspase-3蛋白的表达及心肌细胞凋亡指数比较()Table 1 Comparison of cardiac function scores,the expression of Caspase-3 and the apoptosis index of myocardial cells at 24 h after heart transplantation in rats()

表1 大鼠移植心脏功能评分、Caspase-3蛋白的表达及心肌细胞凋亡指数比较()Table 1 Comparison of cardiac function scores,the expression of Caspase-3 and the apoptosis index of myocardial cells at 24 h after heart transplantation in rats()
与对照组相比,*P<0.05,**P <0.01
指 标 对照组(n=20) 实验组(n=20)移植心脏功能评分(分) 2.44 ±0.29 3.67 ±0.21*Caspas-3 蛋白表达(分) 2.03 ±0.21 1.38 ±0.14*心肌细胞凋亡指数 0.78 ±0.01 0.56 ±0.04**
3 讨 论
心肌缺血和再灌注损伤中存在2种不同的细胞死亡方式,即凋亡和坏死。心肌缺血损伤中以坏死为主,而IRI中以凋亡为主。研究表明,细胞凋亡在心肌IRI中占有重要地位[1]。Caspsase-3是调亡蛋白酶级联反应的必经之路[6],被认为是导致细胞凋亡的关键酶,被称作死亡蛋白酶,它的激活标志着细胞凋亡的开始[7]。
近年来研究表明,SFN能直接作用于Keap1,使Keap1与 Nrf2分开,后者与 ARE结合从而激活Nrf2-ARE信号通路,诱导内源性II相酶(phase II enzyme)的表达,清除缺血再灌注或外来物产生的活性氧自由基[4,8],减轻 IRI[9]。Angeloni等[10]给予幼鼠的心室肌细胞不同时间(30 min~48 h)SFN(5 μmol/L)的预处理,发现SFN能明显提高Ⅱ期酶的活性、蛋白及基因的表达,说明SFN通过诱导二期酶的产生,发挥抗氧化作用,增强细胞对氧化应激的防御能力,发挥其保护心肌的作用。Piao等[11]在大鼠的离体心脏的IRI同样发现SFN通过抗氧化作用减轻心肌的组织损伤。而SFN是否通过抗凋亡作用减轻IRI未见报道。
本实验的结果显示:与对照组相比,SFN预处理能明显抑制 Caspase-3 蛋白的表达(2.03 ±0.21 vs 1.38 ±0.14,P <0.05);同样 Tunel结果显示:与对照组相比,经SFN预处理组移植心脏的细胞凋亡指数明显降低(0.78 ±0.01 vs 0.56 ±0.04,P <0.05)。我们考虑 SFN在心肌的冷IRI中同样起作用,SFN预处理能明显降低由于IRI引起的Caspase-3水平的升高,从减轻心肌细胞的凋亡,减轻心肌的组织损伤。与Piao等[11]的研究结果相一致。同样我们研究发现SFN能提高移植心脏的中位生存期(7d vs 5d,P<0.05)和改善移植心脏功能(3.67 ±0.21 vs 2.44 ±0.29,P <0.05),SFN 能够减轻心脏移植中IRI,提高移植心脏的存活时间和功能。这与 Sołowiej等[12]研究相一致。
总之,SFN能减轻移植心脏心肌IRI,其保护作用可能与其抑制Caspase-3蛋白的表达,同时减少心肌细胞凋亡有关,但其具体机制尚需进一步探讨。
[1]吴锦波,吴平生.心肌缺血/再灌注损伤与细胞凋亡[J].医学综述,2011,17(19):2961-2963.
[2]Mukherjee S,Lekli I,Ray D,et al.Comparison of the protective effects of steamed and cooked broccolis on ischaemia-reperfusioninduced cardiac injury[J].Br J Nutr,2010,103(6):815-823.
[3]李占清,崔翔宇,伊 雪,等.N-乙酰半胱氨酸对大鼠心脏移植缺血再灌注损伤的保护作用[J].中华实验外科杂志,2013,30(5):995-998.
[4]Kuznetsov AV,Schneeberger S,Seiler R,et al.Mitochondrial defects and heterogeneous cytochrome c release after cardiac cold ischemia and reperfusion[J].Am J Physiol Heart Circ Physiol,2004,286(5):1633-1641.
[5]Gross ML,Ritz E,Schoof A,et al.Comparison of renal morphology in the Streptozotocin and the SHR/N-cp models of diabetes[J].Lab Invest,2004,84(4):452-464.
[6]张 煜,邱朝晖,郭新贵,等.Caspase-3特异性抑制剂对缺血再灌注损伤诱导的大鼠心肌细胞凋亡的作用[J].中国临床医学,2009,16(1):12-15.
[7]Horrevoets AJ.Kallikrein teams up with GSK-3beta in heart failure prevention[J].Cardiovasc Res,2008,80(3):328-329.
[8]刘 宇,曹清心,张 燕,等.高迁移率族蛋白B1对心肌缺血再灌注损伤保护作用的初步临床研究[J].医学研究生学报,2012,25(5):499-502.
[9]Hong F,Freeman ML,Liebler DC.Identification of sensor cysteines in human Keap1 modified by the cancer chemopreventive agent sulforaphane[J].Chem Res Toxicol,2005,18(12):1917-1926.
[10]Angeloni C,Leoncini E,Malaguti M,et al.Modulation of phase II enzymes by sulforaphane:implications for its cardioprotective potential[J].J Agric Food Chem,2009,57(12):5615-5622.
[11]Piao CS,Gao S,Lee GH,et al.Sulforaphane protects ischemic injury of hearts through antioxidant pathway and mitochondrial K(ATP)channels[J].Pharmacol Res,2010,61(4):342-348.
[12]Sołowiej E,Sołowiej J,Kasprzycka-Guttman T.Application of sulforaphane--does it lead to improvement of islet graft survival after warm and/or cold ischemia[J].Ann Transplant,2004,9(3):68-71.

