miR-150与临床疾病研究的新进展
刘付梅,李祥勇综述,周克元审校
0 引 言
miRNA是一种在进化过程中高度保守的内源性非编码小RNA,成熟miRNA长度约为19 nt~23 nt,由茎环结构的转录前体加工而成,主要通过转录后的基因沉默的方式调控细胞的发生、增殖、分化、凋亡、新陈代谢等多种生物过程[1-2]。到目前为止,最新miRNA数据库收录的动植物和病毒中的miRNAs有近20000个,人类基因中的miRNAs预计总数超过1000个,虽仅占人类基因总数的2%,却调控约30%的人类基因[3]。miRNAs起源于蛋白编码基因序列或蛋白编码基因间序列,主要通过5'端的“种子序列(Seed Sequence)”与靶mRNA 3'端非翻译区(3'untranslated regions,3'UTRs)相互作用,完全互补配对诱导靶mRNA降解,不完全互补配对则阻遏靶基因的翻译,从而最终达到抑制特定基因表达的作用。
miR-150是一个长度为22个核苷酸的单链小分子RNA,定位于人类染色体19q13.33,在淋巴结和脾脏中显著高表达,并参与免疫系统和造血系统发生、胚胎发育以及干细胞分化的调节,其异常表达会导致免疫系统及造血系统疾病的发生。进一步的研究表明,miR-150也参与了其他疾病包括肿瘤的发生发展过程。本文就miR-150在人体正常生理过程中的作用以及异常表达引起的机体变化和可能的作用机制作一综述。
1 miR-150的生物学功能
1.1 miR-150的形成 miR-150是在包括人类在内的哺乳动物中发现的一类miRNA,定位于人类染色体19q13.33,长度为22nt,见图1。其形成首先是在RNA聚合酶Ⅱ的作用下,转录生成pri-miR-150,再通过进一步的RNaseⅢ内切酶-Drosha酶切,形成约70 nt的茎环结构pre-miR-150。pre-miR-150在核转运因子Exportin-5的作用下,进入细胞质,由Dicer剪切,形成一个不完全配对的RNA双螺旋-miR-150/miR-150*。该结构进一步转入RNA诱导的沉默复合体(RISC)中,miR-150*由螺旋结构中分离并被降解,而miR-150与RNA诱导的沉默复合体结合,则可以同靶基因mRNA的3'UTR结合,阻遏靶基因的翻译或诱导靶mRNA降解。
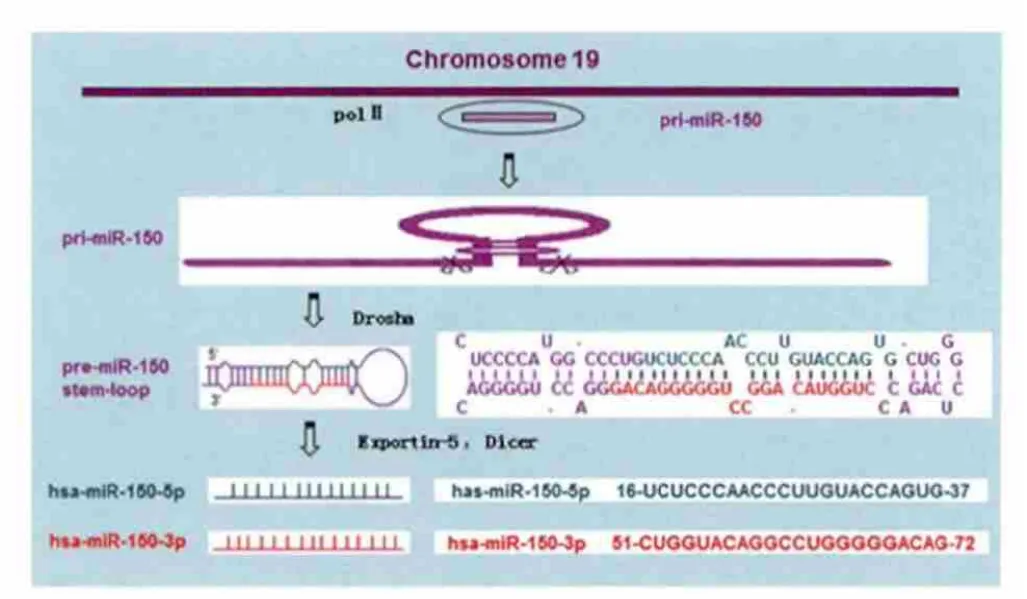
图1 人类miR-150的合成及序列信息Figure 1 Synthesis of hsa-miR-150 and sequence message
1.2 miR-150的靶基因及生物学功能 在人体正常生理状态下,miR-150在淋巴结和脾脏中高表达,它通过调控靶基因的表达直接或间接地参与细胞的生理调控过程,参与机体免疫系统和造血系统发生、胚胎发育以及干细胞的分化,影响生物体的生长和发育。
1.2.1 miR-150与免疫系统发生 miR-150是在淋巴结和脾脏中主要表达的miRNA,它通过调控其靶基因的表达,参与机体免疫系统调节,调控T细胞和B细胞的分化。Zhou等[4]在研究中发现,miR-150在成熟T细胞和B细胞的发展中呈现明显的上调表达,特别是在pro-B到pre-B的过渡阶段起着重要作用。
1.2.2 miR-150与造血系统发生 miR-150在造血系统发生过程中具有重要的作用,可以调节靶基因表达,引起下游基因表达的变化,进而参与机体造血系统发生。miRNA可以通过微泡分泌到细胞外环境中,作为分泌性的细胞调控分子调控生命活动。Li等[5]在研究中发现,单核细胞分泌的微泡介导的miR-150向内皮细胞迁移可以有效的促进毛细血管生成和血管再生,从而参与造血系统发生过程。
1.2.3 miR-150与胚胎发育 miR-150对胚胎发育具有极为重要的作用。c-Myb转录因子对于健康成年人造血系统是必需的,胚胎发生中Myb缺失突变可以妨碍淋巴细胞发展过程中c-Myb的作用。2008年,Lin等[6]的研究发现,c-Myb是 miR-150的一个进化保守的靶点,miR-150的异常表达可以抑制内源性c-Myb的mRNA和蛋白水平的表达,从而影响胚胎发育过程。
1.2.4 miR-150与干细胞分化 miRNA是干细胞功能的关键调控者,参与了干细胞向不同细胞谱系的生存和分化的调控。4型趋化因子受体(chemokine receptor type 4,CXCR4)和间质细胞衍生因子1相互作用在局部缺血组织的干细胞动员和迁移中具有重要作用,miR-150可以通过靶向CXCR4基因从而降低CXCR4水平。Tano等[7]的研究中发现,局部缺血可以通过抑制骨髓单核细胞中miR-150的表达而促进基因CXCR4的表达,进而增强骨髓干细胞的动员(单核细胞数目增多)和迁移,miR-150可能成为干细胞迁徙到局部缺血组织的一个新的治疗靶点。还有研究发现,miR-150在造血干细胞分化为T淋巴细胞过程中过表达。Fallah等[8]在其2013年的研究中表明,miR-146和miR-150可以促进人脐带血中的CD133+细胞分化为T淋巴细胞,从而介导了人造血干细胞的分化。
另外,通过对比许多疾病和正常组织中miRNA表达谱发现,miR-150在许多疾病组织中发生了异常表达,对应的某些特异性基因也发生了表达量的变化,这表明miR-150极有可能通过调控这些靶基因参与了疾病的发生发展过程。2010年,Wu等[9]报道中发现肿瘤抑制因子早期生长反应因子2(Early growth response 2,EGR2)是miR-150的一个直接靶基因,miR-150在胃癌中的过表达可以通过抑制EGR2来促进癌细胞的增殖和生长,促进肿瘤发生和胃癌细胞增殖。先天性角化不良基因1(dyskeratosis congenita 1,DKC1)和丝氨酸/苏氨酸蛋白激酶 2(serine/threonine kinase2,AKT2)是 PI3KAKT通路的重要组成部分,Watanabe等[10]的研究发现在NK/T细胞系淋巴瘤和基本淋巴瘤样品中,miR-150可以通过靶向DKC1和AKT2,引起PI3KAKT通路的持续激活,导致癌细胞的端粒酶活性永久化,引起癌症的进一步恶化。跨膜黏蛋白4型黏蛋白(mucin 4,MUC4)也是 miR-150的一个靶基因,Srivastava等[11]在研究中发现,miR-150 与 MUC4的3'UTR直接相互作用,可以下调细胞内的MUC4蛋白水平,降低人表皮生长因子受体2及其磷酸化的水平,同时减少下游信号的激活,从而进一步抑制胰腺癌细胞的生长、克隆形成能力、转移和侵袭能力,并增强其细胞间黏附。Tan等[12]的研究中发现,miR-150还通过 Survivin、Foxp1介导 B细胞的发育。
2 miR-150表达异常与疾病
2.1 miR-150表达异常与肿瘤 恶性肿瘤死亡率高,易于复发和转移,并且难以早期诊断,随着miRNA相关研究技术的逐渐成熟,针对miR-150与肿瘤的关系的相关研究成为热门。miR-150在多种不同癌症中发生异常表达,可能介导多种肿瘤的发生、发展及转移。
2.1.1 miR-150 上调表达 研究发现,miR-150 在少数淋巴瘤及多种实体瘤组织中异常高表达,可能通过特定的信号通路和靶基因参与了肿瘤的发生和发展过程。Zhang等[13]的研究认为miR-150在肝癌肿瘤干细胞中高表达,它可以通过负性调节原癌基因c-Myb抑制CD133+肝癌肿瘤干细胞的活性。Cai等[14]通过miRNA表达谱分析发现miR-150在结膜淋巴瘤中异常高表达。Wang等[15]的研究发现,miR-150在肺癌细胞株A549中上调表达,并可能作为一种癌基因miRNA调控下游p53基因的表达而进一步影响细胞的表型改变。Zhang等[16]在肺癌组织的研究中也证实了这一结论,miR-150在肺癌组织中异常高表达,并可以通过特异性靶向p53基因的3'-UTR而调控细胞的增殖和凋亡。2010年,Wu等[9]发现miR-150在胃癌细胞系和组织中高表达,其异常高表达可以通过直接靶向肿瘤抑制因子EGR2促进肿瘤发生和胃癌细胞的增殖。2012年,Inoue等[17]的研究基于miRNA表达谱结果,并对其中异常表达的部分miRNA进行实时定量PCR验证,也发现miR-150在胃癌中异常高表达。我们的实验研究通过对比正常鼻咽上皮细胞和鼻咽癌细胞miRNA表达谱发现,miR-150在鼻咽癌细胞株CNE1、CNE2中上调最为明显,表达量可上调300~500倍,miR-150极有可能参与了鼻咽癌的发生发展过程。
2.1.2 miR-150 下调表达 研究发现,miR-150 几乎在所有的淋巴及造血系统肿瘤中表达量降低,另外在某些实体瘤中也异常低表达,miR-150极有可能作为一种有效的治疗靶点应用于临床。2011年,Watanabe等[10]报道了miR-150在恶性淋巴瘤中可能的作用机制,miR-150可能作为一种肿瘤抑制物,通过其异常下调引起PI3K-AKT通路的持续激活,导致癌细胞的端粒酶永久性活化,进而导致恶性淋巴瘤的发生。Sun等[18]的研究表明,miR-150在非小细胞肺癌中低表达,并与临床病理学特征具有明显相关性。2011年,Srivastava等[11]在研究中发现,miR-150在胰腺癌中表达下调,能负性调节癌基因MUC4而抑制癌细胞增殖、迁移及侵袭,miR-150在肝癌及胰腺癌中作为肿瘤抑制因子发挥抑癌基因的作用。
2.2 miR-150表达异常与其他疾病
2.2.1 miR-150与炎症 血循环中miR-150的下调与细菌感染和炎症反应密切相关,miR-150可介导炎症反应过程,一定程度上可以作为判断疾病的严重程度及预后。曾小莉等[19]的研究中发现,miR-150在脓毒症患者外周血白细胞中表达降低,而靶基因肿瘤坏死因子-α、白细胞介素-10等含量上升,且miR-150含量越低,炎症反应越严重,预后越差。
2.2.2 miR-150与组织纤维化 miR-150可通过影响组织中胶原的分泌参与不同组织纤维化的发生。崔云霞等[20]的研究在糖尿病大鼠模型中发现miR-150低表达,而Elisa则检测到其心肌细胞和心肌成纤维细胞中胶原Ⅰ发生高表达。转染miR-150 mimics后,胶原Ⅰ分泌降低。故miR-150可能通过靶向胶原Ⅰ参与糖尿病心肌纤维化的发生。Zheng等[21]的研究中发现,miR-150可以通过抑制c-Myb的表达抑制肝星形细胞激活,通过靶向 Sp1和Col4A4基因降低Ⅰ型胶原和Ⅲ型胶原的合成而抑制肝纤维化的发生。
2.2.3 miR-150与肺动脉高血压 miR-150含量与肺动脉高血压的生存期直接相关。Rhodes等[22]通过基因表达谱分析研究发现,在肺动脉高血压患者血浆中miR-150表达降低最为明显,而且miR-150降低越多,患者的预后生存期越差。这说明miR-150与肺动脉高血压患者的生存期具有很强的相关性,血浆中循环miR-150的水平可以作为患者生存期预测的重要标志。
2.2.4 miR-150与高糖诱导的心肌细胞肥大miR-150可以通过靶向转录共激活因子p300调节高糖诱导的心肌肥大。Duan等[23]的研究中发现,在高糖诱导的心肌肥大患者体内,miR-150表达急剧降低,而且p300表达量则明显升高。miR-150 mimics可以抑制p300 3'-UTR荧光报告酶活性及p300內源表达含量,而共转染p300表达载体和miR-150 mimics则可以逆转miR-150对心肌肥大的调控作用。这说明miR-150与高糖诱导的心肌肥大密切相关,miR-150参与了p300介导的心肌肥大调控。
2.2.5 miR-150与系统性硬化病 皮肤成纤维细胞中整合素的过表达在系统性硬化病的发病机理中具有重要作用,miR-150可参与细胞中整合素β3的调控而参与系统性硬化病的发病过程。Honda等[24]在研究中发现,无论是在系统性硬化病病人成纤维细胞石蜡切片中,还是在患者血清中,miR-150都发生低表达,并且进一步证实该情况是由上游的DNA甲基化引起的。这说明miR-150与系统性硬化病关系密切,检测血清miR-150的水平可能成为临床上一种新的诊断和治疗方法。
3 miR-150在诊断和临床治疗中的应用
随着生物化学和分子生物学的发展,如何能更早、更准确的诊断疾病,并在发病早期及时治疗成为目前的一个研究热点,所以寻找一个有效且稳定的生物学标记用于临床应用则成为我们亟待解决的问题。鉴于miR-150可介导多种疾病,并与疾病的发生发展具有较为明确的相关性,我们可以着眼于开发miR-150作为疾病治疗及预后的判断指标。
研究发现,在全血、血清、血浆及尿液中均可检测到 miRNAs的存在,即循环 miRNAs[25]。循环miRNAs存在于血清及血浆中并表达稳定,这为临床检测miRNAs的表达及其含量变化提供了可能。鉴于miR-150在不同疾病中可能上调或下调,诊断时可以结合患者的具体情况进行诊断,比如结合检测血清中其他细胞因子的含量变化,或是结合患者具体的疾病表征进行诊断,故检测血清中miR-150的变化可作为一种有效的辅助诊断手段;而对于某些已经确诊的疾病,且miR-150有明显变化的情形,可将miR-150作为一种疾病预后的指标,或是疾病严重程度的指标[26]。
某些研究发现,miR-150可以靶向特异性的目标基因,进而调控下游的基因表达变化,引起相应的机体应答,这为我们通过调节miR-150而改善患者的疾病反应提供了依据。如耶鲁大学干细胞中心与癌症中心Adams等[27]的研究发现阻断miR-150可促进化疗后的血细胞再生,缺失miR-150小鼠能够更加有效地再生化疗所破坏的白细胞和血小板,据此我们可以设计miR-150阻断物促进化疗后患者体内的血细胞再生,进而改善患者机体状况;又如曾小莉等[19]的研究中发现炎症反应中miR-150的含量与炎症严重程度成反比,我们则可以使用miR-150 mimics导入人体细胞,再转入患者体内,或是合成has-miR-150前体转入人体,提高机体中miR-150的含量,降低下游靶基因的表达量,减轻炎症反应。
4 结语和展望
随着生物科学技术的高速发展,新的实验方法和生物学手段让我们发现了越来越多的参与机体生物学功能调节的各种调控因子,如 ssiRNAs、piwiRNAs、tiny RNAs、隐蔽的不稳定转录本(cryptic unstable transcripts)[28],以及近几年热门的miRNAs,而miRNAs的组织特异性让我们可以更有针对性的研究其在临床中的实际应用,开发其在疾病治疗中的应用方案。所以,组织特异性miRNA的研究正是我们目前的研究趋势。
目前,也有一些研究着力于miRNA作为生物标志物的开发研究。基于血清中miRNA表达含量和表达特异性极具稳定性的特点,开发miRNA特异性疾病标志也成为了目前的一个研究热点。
虽然miR-150在造血系统和免疫系统发生过程中有了一些初步的研究,部分靶点和作用机制也已得到初步的探讨,但关于其在不同疾病特别是恶性肿瘤中的致病机制,以及引起疾病发生发展的机制有待进一步的探讨和证实。同时,在不同的研究中,我们也发现miR-150的作用靶点并不是唯一的,其代谢调控机制到底如何,调控单一代谢途径还是代谢调控网络,这些都是值得探讨的问题。对miR-150的研究将有助于进一步理解miR-150与有关疾病的发生机制,更好将研究结果应用于临床,为临床诊断和治疗提供科学依据。
[1]Tokarz P,Blasiak J.The role of MiRNA in metastatic colorectal cancer and its significance in cancer prognosis and treatment[J].Acta Biochim Pol,2012,379(59):1-8.
[2]Varma SD,Kovtun S.Protective effect of caffeine against high sugar-induced transcription of microRNAs and consequent gene silencing:A study using lenses of galactosemic mice[J].Mol Vis,2013,19:493-500.
[3]张向君,王加林.MicroRNA-143在肥胖及胰岛素抵抗中的研究进展[J].医学研究生学报,2013,26(6):666-668.
[4]Zhou B,Wang S,Mayr C,et al.MiR-150,a microRNA expressed in mature B and T cells,blocks early B cell development when expressed prematurely[J].Proc Natl Acad Sci USA,2007,104(17):7080-7085.
[5]Li J,Zhang Y,Liu Y,et al.Microvesicle-mediated transfer of miR-150 from monocytes to endothelial cells promotes angiogenesis[J].J Biol Chem,2013,288(32):23586-23596.
[6]Lin YC,Kuo MW,Yu J,et al.c-Myb is an evolutionary conserved miR-150 target and miR-150/c-Myb interaction is important for embryonic development[J].Mol Biol Evol,2008,25(10):2189-2198.
[7]Tano N,Kim HW,Ashraf M.MicroRNA-150 Regulates Mobilization and Migration of Bone Marrow-Derived Mononuclear Cells by Targeting Cxcr4[J].PloS One,2011,6(10):e23114.
[8]Fallah P,Arefian E,Naderi M,et al.miR-146a and miR-150 promote the differentiation of CD133(+)cells into T-lymphoid lineage[J].Mol Biol Rep,2013,48(8):4713-4719.
[9]Wu Q,Jin H,Yang Z,et al.MiR-150 promotes gastric cancer proliferation by negatively regulating the pro-apoptotic gene EGR2[J].Biochem Biophys Res Commun,2010,392(3):340-345.
[10]Watanabe A,Tagawa H,Yamashita J,et al.The role of microRNA-150 as a tumor suppressor in malignant lymphoma[J].Leukemia,2011,25(8):1324-1334.
[11]Srivastava SK,Bhardwaj A,Singh S,et al.MicroRNA-150 directly targets MUC4 and suppresses growth and malignant behavior of pancreatic cancer cells[J].Carcinogenesis,2011,32(12):1832-1839.
[12]Tan LP,Wang M,Robertus JL,et al.MiRNA profiling of B-cell subsets:Specific miRNA profile for germinal center B cells with variation between centrob lasts and centrocytes[J].Lab Invest,2009,89(6):708-716.
[13]Zhang J,Luo N,Luo Y,et al.MicroRNA-150 inhibits human CD133-positive liver cancer stem cells through negative regulation of the transcription factor c-Myb[J].Int J Oncol,2012,40(3):747-756.
[14]Cai J,Liu X,Cheng J,et al.MicroRNA-200 is commonly repressed in conjunctival MALT lymphoma,and targets cyclin E2[J].Graefes Arch Clin Exp Ophthalmol,2012,250(4):523-531.
[15]Wang PY,Li YJ,Zhang S,et al.Regulating A549 cells growth by ASO inhibiting miRNA expression[J].Mol Cell Biochem,2010,339(1-2):163-171.
[16]Zhang N,Wei X,Xu L.miR-150 promotes the proliferation of lung cancer cells by targeting P53[J].FEBS Lett,2013,587(15):2346-2351.
[17]Inoue T,Iinuma H,Ogawa E,et al.Clinicopathological and prognostic significance of microRNA-107 and its relationship to DICER1 mRNA expression in gastric cancer[J].Oncol Rep,2012,27(6):1759-1764.
[18]Sun Y,Su B,Zhang P,et al.Expression of miR-150 and miR-3940-5p is reduced in non-small cell lung carcinoma and correlates with clinicopathological features[J].Oncol Rep,2013,29(2):704-712.
[19]曾小莉,张韶岩,张京岚,等.微小RNA-150在脓毒症患者外周血白细胞的表达及其临床意义[J].中国呼吸与危重监护杂志,2011,10(4):360-364.
[20]崔云霞,毕慧梅,闫俊霞,等.MicroRNA-150在糖尿病心肌纤维化中的变化及对胶原Ⅰ的影响[J].中国卫生检验杂志,2012,22(2):208-210.
[21]Zheng J,Lin Z,Dong P,et al.Activation of hepatic stellate cells is suppressed by microRNA-150[J].Int J Mol Med,2013,32(1):17-24.
[22]Rhodes CJ,Wharton J,Boon RA,et al.Reduced miR-150 is Associated with Poor Survival in Pulmonary Arterial Hypertension[J].Am J Respir Crit Care Med,2013,187(3):294-302.
[23]Duan Y,Zhou B,Su H,et al.miR-150 regulates high glucoseinduced cardiomyocyte hypertrophy by targeting the transcriptional co-activator p300[J].Exp Cell Res,2013,319(3):173-184.
[24]Honda N,Jinnin M,Kira-Etoh T,et al.miR-150 Down-Regulation Contributes to the Constitutive TypeⅠCollagen Overexpression in Scleroderma Dermal Fibroblasts via the Induction of Integrinβ3[J].Am J Pathol,2013,182(1):206-216.
[25]李翰卿,汪俊军.microRNAs与心肌损伤[J].医学研究生学报,2011,24(10):1091-1094.
[26]Roderburg C,Luedde M,Vargas Cardenas D,et al.Circulating microRNA-150 serum levels predict survival in patients with critical illness and sepsis[J].PLoS One,2013,8(1):e54612.
[27]Adams BD,Guo SQ,Bai HT,et al.An In Vivo Functional Screen Uncovers miR-150-Mediated Regulation of Hematopoietic Injury Response[J].Cell Rep,2012,2(4):1048-1060.
[28]Mercer TR,Dinger ME,Mattick JS.Long non-coding RNAs:insights into functions[J].Nat Rev Genet,2009,10(3):155-159.

