锰对比剂在MRI中的应用
曾庆斌,郭茜旎,罗晴,吴光耀,周欣*
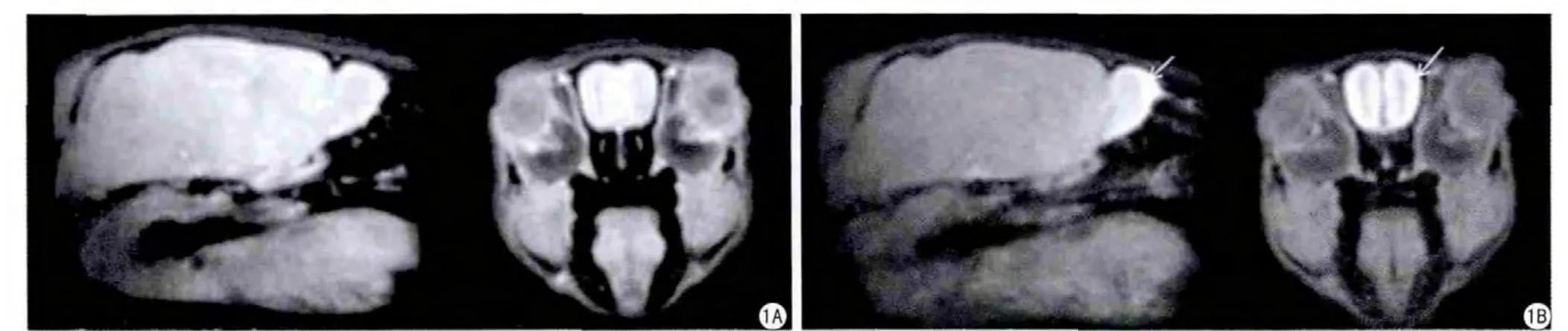
图1 锰离子增 强的小鼠嗅球MRI。A:灌注MnCl2前,(左)矢状图,(右)冠状图;B:灌注MnCl2后,(左)矢状图,(右)冠状图[11]Fig.1 Manganese-enhanced imaging (MEMRI) of mouse olfactory bulb.A: Pre-infusion MnCl2, (left) sagittal image, (right) coronal image.B: Postinfusion MnCl2, (left) sagittal image, (right) coronal image [11].
自从1973年Lauterbur[1]首次实现MRI,1977年Mans fi eld[2]利用回波平面成像(echo planar imaging,EPI)提高了成像效率以来,MRI这项技术在世界范围内的生物、医学等领域获 得很好的发展和广泛应用。因其优势明显使其成为目前活体状态下,显示人体结构的一种主要的临床影像技术。其中,功能MRI(fMRI)更是在研究大脑的功能结构、大脑活动以及病理状态中起着中流砥柱的作用[3]。在医学诊断中,为了得到更高的信号对比度,往往就要用到MRI对比剂(contrast agent, CA)。调查表明, 在现如今的MRI实验中,有40%~50%的实验都要用到对比剂[4]。目前临床上正在使用和研发的对比剂按照其作用原理来说,可以分为T1对比剂和T2对比剂两类。一种合格的可供临床使用的MRI对比剂需要同时满足以下几个条件:(1)足够的稳定性;(2)低毒性;(3)高弛豫率;(4)靶向性;(5)在体内既有足够的停留时间又易于排出[5]。理论上来说多种过渡金属和镧系金属都可以用作磁共振对比剂,但钆一直以来就是顺磁性对比剂的首选金属,因为三价态的钆外层有7个未成对电子,具有很强的顺磁弛豫增强能力。虽然含钆类对比剂使用较为广泛,但是含钆类对比剂有可能引起一种虽然罕见却极 其严重的疾病——肾源性系统性纤维化(nephrogenic systemic fibrosis, NSF)[6],因此含钆类对比剂的使用也具有一定的局限性。过渡态金属锰是一种生物体内必须的微量元素,毒性非常低。二价态的锰外层有5个未成对电子,也具有很强的顺磁弛豫增强能力,这些特殊的性质使得锰在磁共振成像中也得到了一定的应用,是一种较早期的用于MRI的顺磁性对比剂。笔者将对锰对比剂最近的最新研究进展及应用进行综述。
1 锰对比剂的特性
锰因其良好的电子排布以及独特的生物化学性质,使其在磁共振对比剂领域也占有一席之地。锰对比剂相对于其他对比剂来说,特征比较明显:一是存在形势比较多样,如有锰盐、小分子有机螯合物、大分子螯合物、氧化物纳米粒子等多种类型;二是锰对比剂毒性较低;三是锰对比剂可以用于神经影像的研究,因Mn2+是Ca2+的类似物,Mn2+可通过在神经活动时打开的电压门控Ca2+通道进入神经细胞,并且可以通过基于微管道的传输系统在神经细胞内传递,因此Mn2+可以运用于神经影像学的研究。
2 锰对比剂的相关研究及应用
2.1 锰无机盐的研究进展及应用
Mn2+是最早用于MRI的顺磁 性对比剂,早在1973年,Lauterbur[1]在其发表的文章中就用到了MnSO4作为MRI对比剂来提高信号对比度。1997年,Lin等[7]提出了锰离子增强磁共振成像(MEMRI)技术,该方法 通过在生物体内直接引入外源性的Mn2+作为对比剂来直接或者动态的研究神经细胞的功能活动。目前MEMRI在动物神经影像研究中的应用可以概括为三个方面:(1)神经纤维追踪,(2)大脑形态学研究,(3)脑功能成像[8]。锰曾作为对比剂来提高信号对比度从而研究大脑的局部缺血,Aoki等[9]在2003年利用MEMRI技术来研究大鼠中风模型中的神经兴奋性毒性影像,该方法对大脑动脉栓塞脑缺血具有较好的诊断作用。李英霞等[10]利用MEMRI技术成功的显示了大鼠急性脑缺血过程中的Ca2+超载过程。2007年,Bock等[8]以MnCl2·4H2O作为对比剂来研究大鼠脑部结构。2013年,Gutman等[11]利用MEMRI及DTI技术对小鼠的嗅觉系统进行了相关研究,在小鼠鼻腔灌注MnCl2后,小鼠的嗅球信号得到了明显的加强(图1)。
锰不仅可以用于神经影像的研究还可以运用于肝脏的影像研究。以前已有的对肝脏具有特异性的锰对比 剂的给药方式都是通过静脉注射的方式,然而这种方法会导致不必要的副作用和并发症,为了解决这个问题,2006年,Elizaveta等[12]通过给病人口服CMC-001对比剂(该对比剂包含1.6 g MnCl2·4H2O,1 g丙氨酸,1600IU维生素D3),利用这种方法不但能够解决静脉注射会产生的副作用,而且成功的监测到肝癌细胞转移过程。

图2 大鼠脑部MR T1WI (A、B、C)、T2WI (D、E、F)、注射对比剂后15 h (A、D)、注射对比剂后24 h(B、E),注射对比剂后72 h (C、F)[18]Fig.2 The MRI of rat brain, T1-weighted image (A, B, C), T2-weighted image (D, E, F), post- injected 15 h(A, D), post-injected 24 h, (c, f) post-injected 72 h (B, E) [18].
MEMRI技术在糖尿病的诊断中也有一定的应用。2013年,Antkowiak等[13]利用MEMRI技术,在环磷酰胺加速诱导的1型糖尿病小鼠模型中成功的监测到了胰腺β细胞的减少。
2.2 锰有机小分子螯合物的研究进展及应用
降低锰的毒性,通常有两种方案[14]:一是利用一些化合物和锰进行螯合,进而除去自由的锰,可以有效降低毒性;二是加入能和锰竞争的钙离子,从而降低由钙通道进入细胞的锰的量。这两种方案都能够有效的降低锰的毒性。目前与锰螯合的有机小分子主要是卟啉和羧酸类化合物,锰卟啉对比剂具有比较好的信号对比增强效果,并且具有靶向功能。常见的用于与锰螯合的羧酸类化合物基本上都是DTPA和DOTA的系列衍生物。
2004年,Troughton等[15]合成出了一种基于EDTA衍生物的锰对比剂,该类对比剂在动物实验时没有表现出明显的毒性。在兔子血管损伤模型中显示出了较高的对比度。在注射该对比剂后,模型兔的正常部位和因损伤造成的炎症部位形成了明显的对比。
通过MRI进行离子识别并且对一些离子的分布进行测定逐渐成为一个重要的研究领域。Zhang等[16]2007年发表了一篇关于可特异性识别Zn2+的锰(Ⅲ)卟啉荧光/MRI双模态探针的文章,该作者预测这种卟啉探针可以实现对生物体内Zn2+的探测以及对Zn2+的分布进行成像。在其后续的研究工作中[17],成功的实现了对大鼠海马区内Zn2+的探测和对Zn2+的分布进行磁共振成像,在将来有可能用于研究与锌异常引起的精神疾病。
Bertin等[18]2009年合成出了一种新型的树枝状DTPA锰螯合物,4.7 T成像仪和20℃条件下,测得其T1弛豫率为1.3 mMM-1s-1,T2弛豫率为17.41 mM-1s-1。经研究发现该种对比剂毒性很低,并且在大鼠模型中,当注射对比剂24 h后,大鼠脑部的对比剂分布出现了差别,可以清晰的看出组织结构(图2)。此研究结果表明此对比剂不仅可以应用于神经科学的基础研究,还有可能用于诊断帕金森综合征(PD)或者阿尔茨海默综合征(AD)。该类树枝状DTPA锰螯合物对比剂T1弛豫率(1.3 mM-1s-1)与MnCl2的T1弛豫率(6.9 mM-1s-1)相比低了很多,主要是因为该类树枝状DTPA锰螯合物不含结合水。有相关文献[19]对金属 结合水的个数与 弛豫率的关系进行了论述,感兴趣 的读者可对其进行参阅。
2.3 锰高分子螯合物的研究进展及应用
高分子材料因其合成技术成熟、化学结构可控、易于化学修饰以及具有比较高的稳定性等特点,得到了科学家们的广泛关注。将顺磁性金属和高分子材料进行结合得到磁共振对比剂是对比剂的一个重要发展方向。
2009年,Zhang等[20]通过葡聚糖和锰卟啉反应得到了一种可以选择性靶向癌细胞的锰卟啉高分子对比剂,其Mn-porphyrin-dextran T1弛豫率(8.9 mM-1s-1)比Gd-DTPA弛豫率(5.12 mM-1s-1)还高,在活体实验中,注射对比剂后,肿瘤部位信号增强明显,可以用于对癌症的诊断。这种含有卟啉类化合物的对比剂一般弛豫率都比较高,主要是因为卟啉是一个平面结构,这种结构可以使水分子和顺磁性金属中心进行充分的接触,能量传递的将会更加有效,使得水分子的弛豫变快[20]。

图3 小鼠脑部T1WI。A:功能化的MnO纳米粒子选择性的对小鼠脑部乳腺癌部位的信号加强;B:非功能化的MnO纳米粒子对小鼠脑部的肿瘤部位和正常部位的信号均加强[28]Fig.3 The T1-weighted MRI of mouse brain.A: The functionalized MnO nanoparticles selectively enhanced the breast cancer cells.B: The nonfunctionalized MnO nanoparticles enhanced both the tumor and the normal brain tissue[28].
蛋白质是生物体的重要组成部分,其兼容性高。近几年,顺磁性金属与蛋白质螯合的对比剂引起了科学家们的特别关注。2008年,Sotak等[21]合成出了一种锰(Ⅲ)-转 铁蛋白螯合物,该种对比剂可以标记小鼠肝细胞,在肝细胞中其弛豫率和锰离子的差不多,虽然弛豫率很低,但是却提供了一种新的对比剂设计思路:利用一种生物学过程来释放对比剂,即利用受体结合、内吞作用、内酸化等过程来达到释放对比剂的目的。这种想法为药物载体以及药物释放提供了一种设计思路。2011年,Geninatti等[22]合成出了一种锰螯合去铁铁蛋白的对比剂(Mn-Apo),这种对比剂一个去铁铁蛋白的空穴中含有300~400个锰原子,其T1弛豫率可以达到7000mM-1s-1(以去铁铁蛋白的量算,7 T成像仪上测得),经实验研究发现这种对比剂可以对肝癌进行很好的诊断,这种将锰离子封装在去铁铁蛋白内腔中的方法是一种有效的降低毒性和提高弛豫率的方法,并且去铁铁蛋白不会引起任何生物体内的免疫反应,可以使对比剂有较长的保留时间,为有效的进行疾病诊断提供了保障。Winter等[23]最近合成出了一种锰卟啉取代硝酸亚铁血红素(H-NOX)的高弛豫率对比剂,其T1弛豫速率12 mM-1s-1,T2弛豫速率16.8 mM-1s-1(1.4 T成像仪,37 ℃测得)。这种新型的对比剂可以通过基因或者化学手段进一步修饰从而增强MRI信号和提高生物兼容性。蛋白质在水溶液中表面一般都会有一个结合水层,这些结合的水分子自由度降低,这样这些水分子的自由运动频率变得接近拉莫频率,就可以产生比较有效的能量传递,使得T1弛豫时间缩短,另外顺磁性金属的存在也会进一步的缩短T1弛豫时间,这两种因素一起造成了顺磁性金属螯合蛋白质的对比剂T1弛豫速率很大。
2.4 锰纳米粒子的研究进展及应用
纳米粒子材料因其特有的物化性质,近几年来一直是广大科研工作者们的研究热点,将顺磁性金属与纳米粒子材料结合起来不仅可以增加其生物兼容性,还可以提高其弛豫率,是一个很有前景的发展方向。近年来,纳米粒子对比剂越来越得到科研工作者的关注。
早在1993年,就有文献[24]报道了基于脂质体的锰纳米粒子对比剂,该类对比剂是由脂质体包裹的烷基化的锰组成,其毒性低、稳定,并且其弛豫率比自由的锰更高,在活体成像实验中显示该类对比剂可以特异性的提高肝脏病变部位和正常部位的对比度。2008年,Pan等[25]首次通过具有两亲性质的超支化聚乙烯亚胺(PEI)分子和Mn(Ⅲ)卟啉以及生物素的自组装得到了粒径在180~200nm之间的形如红细胞的纳米粒子对比剂,细胞实验显示,该类对比剂具有潜在的靶向能力。
Tan等[26]于2010年首次用Mn-DOTA与以硅三氧烷为核心的第三代赖氨酸树状高分子相互作用,然后再使之与具有靶向性的CLT1肽链作用,得到了可以靶向癌细胞的锰纳米球对比剂,该种对比剂对比增强效果明显,少量的注射量就可以得到足够的信号对比度,将来可能应用于癌症诊断的分子影像中。在Tan等[27]的后续工作中,又通过NOTA或者DOTA与以硅三氧烷为核心的第二、三、四代赖氨酸树枝状高分子相互作用,然后再螯合Mn2+形成了一种新型的锰纳米球对比剂。经研究发现,不同的锰螯合物,弛豫速率不同,并且随着代数的增长,弛豫率增加。在动物实验中发现,很少量的注射对比剂,在动物模型的肿瘤部位就可以得到对比明显的信号。该类对比剂因其热力学稳定性、在水中的高溶解度以及均匀的粒径使其具有很广阔的应用前景。
锰氧化物纳米粒子对比剂是另一个较重要的研究方向,2007年Na等[28]由油酸锰在300℃下热分解得到球状MnO纳米粒子后,再将之包裹在聚乙二醇(PEG)或者磷脂壳膜中,即可得到具有水溶性的MnO纳米粒子对比剂。该种对比剂生物兼容性较好,粒径在10~30nm之间,在小鼠模型实验中,T1WI可以得到对比明显的图像(图3),并且该种对比剂对乳腺癌细胞具有靶向性,可以对脑部转移瘤的乳腺癌细胞进行选择性成像。2011年,Kim等[29]开发出了一种新型的介孔二氧化硅涂层空心氧化锰纳米粒子(HMnO@mSiO2)对比剂,这种含有介孔的纳米壳可以使水分子充分接近磁性中心,进而可以有效增强水中质子的T1弛豫速率,在11.7 T谱仪上的弛豫速率为0.99 mM-1s-1,实验发 现该种纳米粒子可以被脂肪间充质干细胞(MSCs)很好的吸收。在小鼠模型实验中,注射该对比剂14 d后,仍然可以得到具有一定对比度的图像。因干细胞倾向于转移到肿瘤位置,因此该对比剂可以用来检测癌细胞并且可以追踪癌细胞的转移过程。该研究结果使利用MRI技术追踪细胞转移过程成为了可能。2013年,Xiao等[30]开发出了一种超高弛豫率的Mn3O4纳米粒子对比剂,在3.0T成像仪上,水溶液质子的T1弛豫率为8.26 mM-1s-1,PBS中质子的T1弛豫率为6.79 mM-1s-1,该锰氧化物纳米粒子的T1弛豫率为目前所见报道的所有锰氧化物纳米粒子T1弛豫率的最高值。在细胞实验及活体实验中均未发现明显的毒性,并且在活体成像实验中,肿瘤部位的成像对比效果明显。该研究结果为锰氧化物纳米粒子在临床中的应用铺平了道路。
3 小结与展望
由于锰具有良好的电子排布和丰富的生物化学特性,以其作为对比增强对比剂相对于其他顺磁性金属对比剂来说具有很大的优势。然而自由的锰又是具有毒性的,超剂量的使用Mn2+,会导致Mn2+在大脑基底节、黑质等脑区沉积,进而引起脑细胞死亡,出现类似帕金森综合症的临床症状,因此在利用锰作为对比剂之前需要将之进行一定的修饰,比如将之包裹在脂质体之内或者用一些有机化合物与锰进行螯合使之形成稳定的化合物,这样就可以有效的降低锰的毒性。因此寻找可以有效降低锰的毒性,又能和锰形成稳定的化合物,并且生物兼容性好的配体就显得尤为重要。聚合物、纳米粒子材料都是很重要的研究方向,虽然目前在这方面的研究工作已经很多,但是目前还没有被批准使用的锰对比剂,因此在锰造影的研发上还有很大的发展空间,还需要广大的科研工作者做出更多的努力。
[References]
[1]Lauterbur PC.Image formation by induced local interactions:examples employing nuclear magnetic resonance.Nature, 1973,242(5394): 190-191.
[2]Mans fi eld P.Multi-planar image formation using NMR spin echoes.J Physics C: Solid State Physics, 1977, 10(3): L55-L58.
[3]Song WM, Chen NK.fMRI: a brief review and outlook on the stateof-the-art methodology.Chin J Magn Reson Imaging, 2013, 5(1):361-372.宋无名, 陈南圭.功能MRI:最先进方法的简要回顾和展望.磁共振成像, 2013, 5(1): 361-372.
[4]Shellock FG, Kanal E.Safety of magnetic resonance imaging contrast agents.J Magn Reson Imaging, 1999, 10(3): 477-484.
[5]Yan GP, Zhuo RX.Research progress of magnetic resonance imaging contrast agents.Chin Science Bulletin, 2001, 46(7): 531-538.鄢国平, 卓仁禧.磁共振成像造影剂的研究进展.科学通报, 2001,46(7): 531-538.
[6]Kuo PH, Kanal E, Abu-Alfa AK, et al.Gadolinium-based MR con trast agents and nephrogenic systemic fibrosis.Radiology, 2007, 242(3):647-649.
[7]Lin YJ, Koretsky AP.Manganese ion enhances T1- weighted MRI during brain activation: an approach to direct imaging of brain function.Magn Reson Med, 1997, 38(3): 378-388.
[8]Bock NA, Paiva FF.Fractionated manganese-enhanced MRI.NMR Biomed, 2008, 21(5): 473-478.
[9]Aoki I, Ebisu T, Naruse S, et al.Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI.Magn Reson Med,2003, 50(1): 7-12.
[10]Li YX, Fang K, Tang SM, et al.Mn2+ enhanced magnetic resonance molecular imaging.Chin J Interventional Imaging and Therapy, 2004,1(1): 65-70.李英霞, 方可, 唐山民, 等.以Mn2+为探针的磁共振分子影像技术.中国介入影像与治疗学, 2004, 1(1): 65-70.
[11]Gutman DA, Magnuson M, Majeed W, et al.Mapping of the mouse olfactory system with manganese-enhanced magnetic resonance imaging and diffusion tensor imaging.Brain Struct Funct, 2013,218(2): 527-537.
[12]Elizaveta C, Vibeke L, Moller JM, et al.Imaging liver metastases with a new oral manganese-based contrast agent.Acad Radiology, 2006,13(7): 827-832.
[13]Antkowiak PF, Stevens BK, Nunemaker CS, et al.Manganeseenhanced magnetic resonance imaging detects declining pancreatic β-cell mass in a cyclophosphamide-accelerated mouse model of type 1 diabetes.Diabetes, 2013, 62(1): 44-48.
[14]Schaefer S, Lange RA, Gutekunst DP, et al.Contrast-enhanced magnetic resonance imaging of hypoperfused myocardium.Invest Radiology, 1991, 26(6): 551-556.
[15]Troughton JS, Greenfield MT, Greenwood JM, et al.Synthesis and evaluation of a high relaxivity manganese (II)- based MRI contrast agent.Inorg Chem, 2004, 43(20): 6313-6323.
[16]Zhang XA, Lovejoy KS, Jasanoff A, et al.Water-soluble porphyrins as a dual- function molecular imaging platform for MRI and fl uorescence zinc sensing.Proc Natl Acad Sci U S A, 2007, 104(26): 10780-10785.
[17]Lee T, Zhang XA, Dhar S, et al.In vivo Imaging with a cell-permeable porphyrin-based MRI contrast agent.Chem Biol, 2010, 17(6):665-673.
[18]Bertin A, Steibel J, Michou-Gallani AI, et al.Development of a dendritic manganese- enhanced magnetic resonance imaging (MEMRI)contrast agent: synthesis, toxicity (in vitro) and relaxivity (in vitro, in vivo) studies.Bioconjugate chem, 2009, 20(4): 760-767.
[19]Caravan P, Ellison JJ, McMurry TJ, et al.Gadolinium (III) chelates as MRI contrast agents: structure, dynamics, and applications.Chemical Rev, 1999, 99(9): 2293-2352.
[20]Zhang Z, He R, Yan K, et al.Synthesis and in vitro and in vivo evaluation of manganese (Ⅲ) porphyrin-dextran as a novel MRI contrast agent.Bioorg Med Chem Lett, 2009, 19(23): 6675-6678.
[21]Sotak CH, Sharer K, Koretsky AP.Manganese cell labeling of murine hepatocytes using manganese (Ⅲ)- transferrin.Contrast Media Mol Imaging, 2008, 3(3): 95-105.
[22]Geninatti CS, Cutrin JC, Lanzardo S, et al.Mn-loaded apoferritin:a highly sensitive MRI imaging probe for the detection and characterization of hepatocarcinoma lesions in a transgenic mouse model.Contrast Media Mol Imaging, 2012, 7(3): 281-288.
[23]Winter MB, Klemm PJ, Phillips-Piro CM, et al.Porphyrin-substituted H-NOX proteins as high-relaxivity MRI contrast agents.Inorg Chem,2013, 52(5): 2277-2279.
[24]Unger E, Fritz T, Kang S, et al.Manganese-based liposomes comparative approaches.Radiology, 1993, 28(10): 933-938.
[25]Pan D, Caruthers SD, Hu G, et al.Ligand-directed nanobialys as theranostic agent for drug delivery and manganese-based magnetic resonance imaging of vascular targets.J Am Chem Soc, 2008, 130(29):9186-9187.
[26]Tan M, Wu X, Jeong EK, et al.An effective targeted nanoglobular manganese (II) chelate conjugate for magnetic resonance molecular imaging of tumor extracellular matrix.Mol Pharm, 2010, 7(4):936-943.
[27]Tan M, Ye Z, Jeong EK, et al.Synthesis and evaluation of nanoglobular macrocyclic Mn (Ⅱ) chelate conjugates as non-gadolinium (Ⅲ) MRI contrast agents.Bioconjugate Chem, 2011, 22(5): 931-937.
[28]Na HB, Lee JH, An K, et al.Development of a T1 contrast agent for magnetic resonance imaging using MnO nanoparticles.Angew Chem,2007, 119(28): 5397-5401.
[29]Kim T, Momin E, Choi J, et al.Mesoporous silica-coated hollow manganese oxide nanoparticles as positive T1 contrast agents for labeling and MRI tracking of adipose derived mesenchymal stem cells.J Am Chem Soc, 2011, 133(9): 2955-2961.
[30]Xiao J, Tian XM, Yang C, et al.Ultrahigh relaxivity and safe probes of manganese oxide nanoparticles for in vivo imaging.Sci Rep, 2013, 3:3424.

