MRI对宫颈癌宫旁浸润的诊断价值
张洁,薛华丹,李烁,张海波,周海龙,侯波,孙照勇,金征宇
宫颈癌是妇科常见恶性肿瘤,其发病率在世界范围内居女性肿瘤的第二位。宫旁浸润与否是宫颈癌治疗方案选择的重要依据及影响预后的独立因素[1-2]。目前宫颈癌的术前分期仍采用2009年国际妇产科联盟分期标准,该方法无法全面显示病变浸润范围和深度,且与检查者的临床经验密切相关,已有多项研究表明该分期与病理结果相比准确率较低[3-4]。MRI具有较高的软组织分辨率且可以多平面成像,尤其近年来DWI及增强扫描等序列的发展,MRI在宫颈癌术前评估中的作用日益显现,以往研究多采用常规MRI序列,其判断宫旁浸润的敏感性及特异性差异较大,本研究旨在明确DWI及MRI增强扫描对宫颈癌术前宫旁浸润的准确性。
1 材料与方法
1.1 研究对象
连续入组2013年6月至2013年12月在我院手术治疗且经病理证实的宫颈癌患者58例,年龄35~65岁,平均年龄(53.5±13.1)岁,其中宫颈鳞癌51例(87.9%),腺癌7例(12.1%)。所有患者均在术前2周内行盆腔常规MRI平扫加DWI加增强检查,患者MRI检查后至术前未经任何抗肿瘤治疗。
1.2 MRI检查方法
采用GE 3.0T MR扫描仪(MR Discovery 750,GE Healthcare,Waukesha,WI),检查序列包括:矢状面FSE-T2WI:TR 4106 ms,TE 78 ms,层厚4 mm,间隔为0,FOV 26 cm×32 cm,矩阵320×320,NEX为1;横轴面FSE-T2WI:TR 3650ms,TE 102 ms,层厚4 mm,间隔为0,FOV 26 cm×32 cm,矩阵320×256,NEX为1;横轴面FSE-T1WI:TR 547 ms,TE 8 ms,层厚4 mm,间隔为0, FOV 26 cm×32 cm,矩阵320×256,NEX为1;横轴面DWI采用单次激发平面回波(SS-EPI)序列轴面成像,参数:TR 2500ms,TE 63.5 ms,层厚4 mm,间隔为0,FOV 26 cm×32 cm,矩阵128×96,NEX为8;增强扫描参数:轴面T1WI+C:TR 4 ms,TE 1.8 ms,层厚4 mm,间隔为0,FOV 30cm×24 cm,矩阵256×160,NEX为0.7,冠状面T1WI+C:TR 275 ms,TE 1.85 ms,层厚4 mm,间隔为0,FOV 49.1 cm×32 cm,矩阵224×320,NEX为1,矢状面T1WI+C:TR 175 ms,TE 1.90ms,层厚4 mm,间隔1 mm,FOV 26 cm×26 cm,矩阵224×320,NEX为1。
1.3 图像分析及标准
由2名3年工作经验的放射科医师在不知道手术病理结果的前提下,共同分析所有患者的MRI图像,观察宫颈基质环是否完整,宫颈外缘是否光整,对宫旁浸润与否采用以下4个组别进行判断:(1)T2WI;(2)T2WI+DWI;(3)T2WI+增强;(4)T2WI+DWI+增强。2名医师存在争议的图像,由更高年资的医师进行裁定并最终达成共识。
1.4 统计学处理
采用SPSS 18.0软件进行统计学分析。以手术病理结果作为金标准,采用四格表法,计算T2WI、T2WI+DWI、T2WI+增强及T2WI+DWI+增强四组判断宫旁浸润的敏感度、特异度、阳性预测值、阴性预测值及准确度,敏感度表示MRI序列正确诊断宫旁浸润的例数与病理诊断宫旁浸润的例数的比值,特异度表示MRI序列正确诊断无宫旁浸润的例数与病理诊断无宫旁浸润的例数的比值,阳性预测值表示MRI序列诊断为宫旁浸润的病例病理上存在宫旁浸润的概率,阴性预测值表示MRI序列诊断为无宫旁浸润的病例病理上无宫旁浸润的概率,准确度表示MRI序列正确诊断宫旁浸润有无的例数与所有病例数的比值。
2 结果

图1 女,53岁,宫颈中分化鳞癌,术后病理未见宫旁浸润。A:T2WI显示宫颈后壁占位伴左侧宫旁浸润;B:DWI示病变呈明显高信号,左侧可疑宫旁浸润;C:T1WI增强扫描示病变强化程度低于周围组织,未见明确宫旁浸润Fig.1 Female, 53 years old with moderately differentiated squamous cell carcinoma of cervix, no pathological parametrial invasion.A: T2WI image shows tumor in posterior wall of cervix with left parametrial invasion.B: DWI image the lesion shows high signal with suspicious parametrial invasion.C:T1WI enhanced scan shows lower enhancement than surrounding tissues without parametrial invasion.
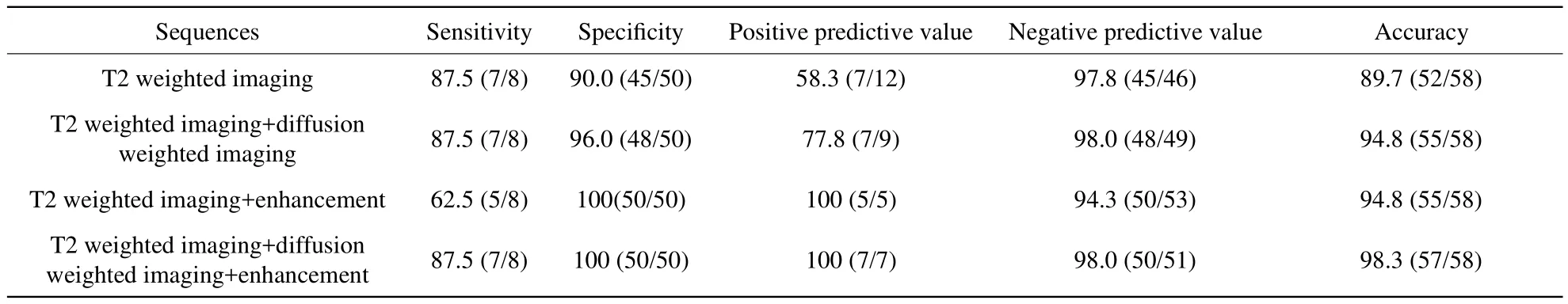
表1 磁共振成像诊断宫旁浸润的能力(%)Tab.1 Diagnostic ability of magnetic resonance imaging in identifying cervical parametrical invasion (%)
MRI术前评估结果与病理结果比较,所有患者术前2周内行MRI平扫加DWI加增强检查,T2WI、T2WI+DWI 、T2WI+增强及T2WI+DWI+增强诊断宫旁浸润的宫颈癌患者分别为7、7、5、7例。所有患者均行根治性子宫或宫颈切除术+盆腔淋巴结清扫。手术病理见宫旁浸润8例。在58例宫颈癌患者中,T2WI正确判断宫旁浸润的共52例,错误诊断6例(图1),T2WI+DWI正确判断宫旁浸润的共55例,错误诊断3例,T2WI+增强正确判断宫旁浸润的共55例,错误诊断3例,T2WI+DWI+增强正确判断宫旁浸润57例,错误诊断1例。各组判断宫旁浸润的敏感度、特异度、阳性预测值、阴性预测值、准确度结果见表1。
3 讨论
本研究结果显示T2WI+DWI+增强序列能更准确的判断宫旁浸润,T2WI+DWI、T2WI+增强判断宫旁浸润的准确度相当,均高于单独应用T2WI序列,其中T2WI+DWI序列较T2WI+增强序列有更高的敏感性及阴性预测值,T2WI+增强序列较T2WI+DWI序列有更高的特异性及阳性预测值。
宫旁浸润是影响宫颈癌患者预后的独立危险因素,与肿瘤复发及患者的生存期密切相关[5-6]。术前判断宫颈癌宫旁浸润深度对治疗方法的选择具有重要意义,已有多项研究表明对于宫旁浸润风险较低的患者可以适当缩小手术范围,以减少清扫宫旁组织引起的尿道损伤、膀胱功能障碍及尿瘘等术后并发症,尤其对于渴望保留生育能力的年轻女性,可以只行宫颈切除术[7-8]。以往研究多采用常规MRI评估宫颈癌术前分期,同时采用DWI及增强MRI评估术前分期研究相对较少。
宫旁组织的具体范围定义困难,从病理学的角度是指宫颈阴道上部至阴道上段两旁的组织,结构成分比较复杂,包括主韧带、子宫动静脉、淋巴管、输尿管、髂内外及闭孔淋巴结、神经丛以及填充其间的疏松结缔组织[9]。宫旁组织与宫颈壁交界面不规则,其病理学复杂性使正确判断宫旁浸润具有一定挑战性。
常规MRI平扫通过T2WI判断肿瘤范围,宫颈癌在T2WI上表现为稍高信号,宫颈基质在T2WI上呈低信号,当宫颈基质的低信号环中断时,宫旁浸润的可能性明显增加[10]。鉴于宫旁组织的复杂性,当肿瘤引起宫旁组织炎性反应时,肿瘤的T2稍高信号与宫旁组织的稍高信号区分困难。研究表明,常规MRI平扫判断宫旁浸润的敏感性及特异性差异较大,Giuliano等[11]对多项MRI术前分期准确性的研究进行总结表明,MRI的敏感性、特异性分别为66.2%、83.8%,本研究结果显示常规T2WI判断宫旁浸润的敏感性、特异性分别为87.5%、90.0%,均高于以往研究,可能与本研究采用的是3.0T高场强MR扫描仪分辨率较高有关,另一方面本研究设置的层厚是4 mm,较以往研究的5~6 mm薄,可能对准确诊断宫旁浸润存在一定帮助。
本研究采用DWI及增强扫描判断宫旁浸润。DWI是目前惟一能够活体观察水分子微观运动的成像方法,肿瘤组织因细胞密度大水分子扩散受限,在DWI上表现为明显高信号,与周围组织形成良好对比。宫颈癌与周围正常组织的强化方式不同,使病变与正常组织较易区分。本研究T2WI结合DWI判断宫旁浸润的敏感性、特异性、阳性预测值及阴性预测值、准确率分别为87.5%、96.0%、77.8%、98.0%、94.8%,以往DWI评价宫颈癌术前分期的文献少见,多局限于用ADC值对宫颈癌与宫颈正常组织进行鉴别,均未对宫旁浸润情况进行评估[12-14]。本研究将常规T2WI与DWI序列结合发现,在不降低敏感性的情况下,可以提高诊断宫旁浸润的特异性。在误诊的3例患者中,2例存在过度诊断,可能与DWI的b值取值较低,宫旁组织炎性反应的T2穿透效应未被完全抑制有关,1例为漏诊,病理结果表明存在宫旁微浸润,目前MRI的分辨率尚不能精确到细胞水平,对判断宫旁微浸润的准确性较差。目前有关增强MRI判断宫颈癌宫旁浸润的研究较少且结论不一[15-20],Akita等[15]研究表明,T1WI增强扫描序列较单独T2WI序列能更准确判断宫颈癌术前分期,而Tsuda等[16]对20例宫颈癌患者行MRI增强扫描发现,T2WI在判断间质浸润深度方面准确性最高。本研究T2WI结合增强扫描判断宫旁浸润的敏感性、特异性、阳性预测值、阴性预测值及准确率分别为62.5%、100.0%、100%、94.3%、94.8%,虽然特异性明显提高,但敏感性反较单独T2WI时降低。在错误诊断的3例患者中,3例均为漏诊,增强扫描的缺点之一是肿瘤边缘的强化与周围正常组织的强化区分困难,使T1WI增强序列所示肿瘤范围较实际范围减小,因此应与多个序列联合进行评估,本研究将T2WI、DWI及增强扫描三者结合恰好证明了这点。但是即便将三者进行联合评估,也仍然存在漏诊的情况,1例漏诊的患者病理为宫旁微浸润,与DWI序列漏诊病例相同,可能需要进一步提高MRI的分辨率来解决此难题。
本研究的局限性包括:(1)病例数较少,发生宫旁浸润的患者比例较低;(2)因ⅡB及以上的患者无法获得病理结果作为对照,因此只能评估ⅡB期以前的宫颈癌患者。
综上所述,常规MRI联合DWI及增强扫描较常规MRI能更准确判断宫颈癌宫旁浸润情况,有望为宫颈癌治疗方案的制定提供更多帮助。
[References]
[1]Kodama J, Kusumoto T, Nakamura K, et al.Factors associated with parametrial involvement in stage IB1 cervical cancer and identi fi cation of patients suitable for less radical surgery.Gynecol Oncol, 2011,122(3): 491-494.
[2]Van de Putte G, Lie AK, Vach W, et al.Risk grouping in stage IB squamous cell cervical carcinoma.Gynecol Oncol, 2005, 99(1): 106-112.
[3]Choi HJ, Ju W, Myung SK, et al.Diagnostic performance of computer tomography, magnetic resonance imaging, and positron emission tomography or positron emission tomography/computer tomography for detection of metastatic lymph nodes in patients with cervical cancer: Meta-analysis.Cancer Sci, 2010, 101(6): 1471-1479.
[4]Chung HH, Kang SB, Cho JY, et al.Can preoperative MRI accurately evaluate nodal and parametrial invasion in early stage cervical cancer?Jpn J Clin Oncol, 2007, 37(5): 370-375.
[5]Jemal A, Siegel R, Ward E, et al.Cancer statistics, 2007.CA Cancer J Clin, 2007, 57(1): 43-66.
[6]Kato T, Watari H, Takeda M, et al.Multivariate prognostic analysis of adenocarcinoma of the uterine cervix treated with radical hysterectomy and systematic lymphadenectomy.J Gynecol Oncol, 2013, 24(3):222-228.
[7]Jung DC, Kim MK, Kang S, et al.Identification of a patient group at low risk for parametrial invasion in early-stage cervical cancer.Gynecol Oncol, 2010, 119(3): 426-430.
[8]Rob L, Charvat M, Robova H, et al.Less radical fertility-sparing surgery than radical trachelectomy in early cervical cancer.Int J Gynecol Cancer, 2007, 17(1): 304-310.
[9]Shin SJ, Kim KR, Song DE, et al.Recognition of parametrial invasion,an important landmark when treating cervical cancer.Gynecol Oncol,2012, 124(3): 502-507.
[10]Sala E, Wakely S, Senior E, et al.MRI of malignant neoplasms of the uterine corpus and cervix.AJR Am J Roentgenol, 2007, 188(6): 1577-1587.
[11]Giuliano R, Cristina V, Andrea S, et al.Diagnostic accuracy of MRI in primary cervical cancer.Open J Radiology, 2012, 2(1): 14-21.
[12]Chen YB, Hu CM, Chen GL, et al.Staging of uterine cervical carcinoma: whole- body diffusion-weighted magnetic resonance imaging.Abdom Imaging, 2011, 36(5): 619-626.
[13]Hoogendam JP, Klerkx WM, de Kort GA, et al.The influence of the b-value combination on apparent diffusion coefficient based differentiation between malignant and benign tissue in cervical cancer.J Magn Reson Imaging, 2010, 32(2): 376-382.
[14]Charles-Edwards EM, Messiou C, Morgan VA, et al.Diffusionweighted imaging in cervical cancer with an endovaginal technique:potential value for improving tumor detection in stage Ia and Ib1 disease.Radiology, 2008, 249(2): 541-550.
[15]Akita A, Shinmoto H, Hayashi S, et al.Comparison of T2-weighted and contrast-enhanced T1-weighted MR imaging at 1.5 T for assessing the local extent of cervical carcinoma.Eur Radiol, 2011, 21(9):1850-1857.
[16]Tsuda K, Murakami T, Kurachi H, et al.MR imaging of cervical carcinoma: comparison among T2-weighted, dynamic, and postcontrast T1-weighted images with histopathological correlation.Abdom Imaging, 1997, 22(1): 103-107.
[17]Seki H, Azumi R, Kimura M, et al.Stromal invasion by carcinoma of the cervix: assessment with dynamic MR imaging.AJR Am J Roentgenol, 1997, 168(6): 1579-1585.
[18]Nicolet V, Carignan L, Bourdon F, et al.MR imaging of cervical carcinoma: a practical staging approach.Radiographics, 2000, 20(6):1539-1549.
[19]Iwata S, Joja I, Okuno K, et al.Cervical carcinoma with full-thickness stromal invasion: ef fi cacy of dynamic MR imaging in the assessment of parametrial involvement.Radiat Med, 2002, 20(5): 247-255.
[20]Haider MA, Sitartchouk I, Roberts TP, et al.Correlations between dynamic contrast-enhanced magnetic resonance imaging-derived measures of tumour microvasculature and interstitial fluid pressure in patients with cervical cancer.J Magn Reson Imaging, 2007, 25(1):153-159.

