EPCs示踪大鼠脑原位胶质瘤的动态MRI研究
李然,方靖琴,陈晓,郭宇,艾华,张伟国*
内皮祖细胞(EPCs)是一种可以在体内参与新生血管生成的多能干细胞,能游走到新生肿瘤区域从生理和病理上参与血管的重建。但目前内皮祖细胞在肿瘤内部的迁移特点及机制仍不明确,笔者将超微型超顺磁氧化铁(USPIO)标记过的EPCs经尾静脉移植入大鼠体内,采用MRI动态观察活体条件下EPCs在肿瘤组织中的分布及迁移特点,并通过病理证实,为利用磁性标记的EPCs作为MRI示踪细胞载体提供可行性实验依据。
1 材料与方法
1.1 材料与试剂
清洁级健康SD大鼠:第三军医大学大坪医院野战外科研究所动物中心提供;C6胶质瘤细胞来源于中科院细胞库。超微型超顺磁氧化铁(USPIO):四川大学生物材料工程学院艾华实验室赠送,DMEM培养基(美国Gibco公司),胎牛血清、0.25%胰蛋白酶、杜氏磷酸盐缓冲液DPBS(美国Hyclone公司)、大鼠淋巴细胞分离液(sigma),大鼠抗VEGF抗体、抗SDF-1抗体、抗MMP-9抗体、大鼠抗F4/80抗体(美国Santa Cruz公司)。
1.2 内皮祖细胞(EPCs)的培养、鉴定和标记
内皮祖细胞采用差速贴壁法培养,鉴定工作我科以往的研究生已完成,标记EPCs采用四川大学华西医院的实验方法,分别取20μl USPIO液体和0.6μl PLL液体,加入2 ml无血清培养基内,室温下振荡混匀60min;吸弃EPCs培养瓶内培养基,加入上述USPIO-PLL复合标记物,37 ℃,5%CO2孵育24 h。
1.3 建立大鼠胶质瘤模型
将清洁级健康SD大鼠[雄性,体重(150±10) g]分为假肿瘤组、肿瘤组、对照组三组,每组16只。刺破大鼠颅骨与脑膜将1×106C6细胞种入脑组织内。待肿瘤生长至第8天时,向肿瘤组和假肿瘤组尾静脉内注射2×106EPCs,对照组仅注射等量DPBS,不移植EPCs。
1.4 胶质瘤模型大鼠MRI扫描
(1)扫描时间点:3组均在EPCs移植前、移植后1、3、5、7 d进行扫描。(2)气体麻醉大鼠,采用7.0T磁共振扫描仪(德国Bruker公司,Biospec 70/20USR),将其固定于三英寸环形线圈进行扫描。(3)扫描序列及参数SE-T1WI序列:TR 800ms,TE 8 ms;FOV 35 mm×35 mm,层厚0.5 mm,层间距0.5 mm,Matrix 256×256,NEX 4。FRFSE-T2WI序列:TR 2500ms,TE 45.0ms;FOV 35 mm×35 mm,层厚 0.5 mm,层间距 0.5 mm,Matrix 256×256,NEX 4。SWI扫描序列:对照T2WI序列定位线,Matrix 384×380;NEX 4,反转角40°。T2 map序列:TR 3800ms,TE 45.0ms,FOV 25 mm×25 mm,层厚 0.5 mm,层间距 0.5 mm,Matrix 128×128,NEX 4。T2 map扫描所得原始图像导入PV5.1后处理工作站处理T2 map数据,通过计算产生伪彩图,并选择兴趣区域,保持相同大鼠在不同时间点的图像兴趣区一致,通过计算得到T2值。
1.5 病理组织学观察
按照实验分组,将大鼠脑组织灌注取材后进行固定和石蜡包埋,石蜡标本连续切片7~8张,行HE染色、普鲁士蓝染色和免疫组化检查,包括抗大鼠巨噬细胞抗体(F4/80)、人基质金属蛋白酶9(MMP-9)、基质细胞衍生因子-1 (SDF-1)、血管内皮生长因子(VEGF)检查。
1.6 病理结果分析
(1)普鲁士蓝染色分析:在红染的细胞浆内出现蓝染的颗粒则提示为阳性,高倍(×400)光学显微镜下随机选取5个视野计数阳性细胞,取其平均值作为该组在该时间点的阳性细胞,并对各组各时间点阳性细胞数进行比较分析。(2) F4/80表达阳性分析:在细胞胞浆内出现黄色或棕褐色为染色阳性,与同层普鲁士蓝染色阳性的标本进行对比,观察普鲁士蓝染色阳性的细胞是否呈阳性表达。(3) MMP-9、HIF-1、VEGF表达阳性分析:在细胞胞浆内出现黄色或棕褐色颗粒为阳性染色。
2 结果
2.1 假肿瘤组和肿瘤组的MRI图像分析
假肿瘤组注射EPCs前在T1WI上表现为均匀的低信号,在T2WI上表现为以低信号为主的混杂信号,在注射EPCs后各时间点T2WI上的信号无明显变化(图1)。而肿瘤组在注射EPCs前在T2WI表现为类圆形的均匀较高信号,在SWI(susceptibility weighted imaging)上呈等高信号,内部可见少许蜿蜒的低信号。注射USPIO标记的EPCs第1天后,在T2WI上与注射前无明显变化,但在SWI上肿瘤周边出现少许点状低信号,第3天后在SWI上肿瘤内部蜿蜒的血管信号增多,并可见多发沿血管信号分布的点状低信号,第5天和第7天后肿瘤中心区域出现明显低信号(图2)。而对照组仅可见肿瘤逐渐增大,其内信号未见明显改变(图3)。在T2 map后处理图上选取病变兴趣区测量其T2值,发现假肿瘤组4个时间点的T2值分别为48.3、47.9、47.6 ms和46.3 ms,整体变化不大,而肿瘤组4个时间点的T2值分别为66.1、60.4、51.5、43.7 ms,呈下降趋势。
2.2 病理组织学结果
2.2.1 HE染色
梭形的肿瘤细胞排列密集,与正常脑组织有明显分界,其内可见明显的异型性和细胞核分裂象,肿瘤中心可见新生血管。
2.2.2 普鲁士蓝染色和F4/80染色
经普鲁士蓝染色后发现肿瘤组在移植EPCs后1 d在肿瘤周边区出现大量蓝染细胞,在第3天、5天和第7天在肿瘤内部也可见大量蓝染细胞,且主要集中在肿瘤新生血管区域(图4)。而假肿瘤组脑组织内仅见零星蓝染细胞,未移植过EPCs的对照组则未发现蓝染细胞,将普鲁士蓝染色阳性的同层切片用F4/80染色,其内并未发现阳性结果,证明蓝染的细胞为USPIO标记过的EPCs。计数各组各时间点的普鲁士蓝染色阳性细胞,发现肿瘤组和假肿瘤组在不同时间点的差异有统计学意义(P<0.05;表1)。

表1 两组标本4个时间点普鲁士蓝染色阳性细胞数Tab.1 the number of Prussian blue (PB) staining positive cells and experiment group
2.2.3 CD34+的表达
CD34+主要表达于血管内皮细胞细胞质内,肿瘤组在移植USPIO-EPCs第1天后肿瘤标本内可见CD34+表达,但肿瘤外周区比肿瘤中央区表达得更为显著,其分布与普鲁士蓝染色阳性细胞基本一致,而在移植USPIO-EPCs第7天后CD34+阳性表达区域在肿瘤内外分布较均匀。
2.2.4 SDF-1、MMP-9的表达
SDF-1主要表达于细胞膜和细胞质内,而MMP-9主要表达于肿瘤细胞胞浆及血管基底膜上,呈棕黄色则为阳性。肿瘤组在移植USPIOEPCs第1天后肿瘤外周区可见明显的SDF-1和MMP-9表达,肿瘤中央区也可见SDF-1和MMP-9表达,但不如外周区显著,而在移植后第7天后肿瘤中央区SDF-1和MMP-9表达增多,与肿瘤外周区并无明显差异(图5)。
2.2.5 VEGF的表达
VEGF主要表达于内皮细胞和肿瘤细胞的胞浆内,部分周围结缔组织及血管内皮细胞也可呈阳性染色。肿瘤组在移植USPIO-EPCs第1天后肿瘤外周区未见明显阳性细胞,内部可见少许染色阳性的细胞。而在移植USPIO-EPCs第7天后肿瘤标本内有大量VEGF染色阳性的细胞,其均匀分布于肿瘤内(图6)。
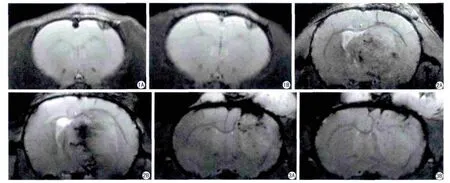
图1 假肿瘤组T2WI横断面。A:为注射EPC后第1天的图像,左侧额叶可见三角形以低信号为主的混杂信号,边界清晰;B:为注射EPCs后第7天的图像,左侧额叶仍可见与注射EPCs前相似的信号 图2 分别为肿瘤组注射EPCs后第1天、第7天2个时间点的SWI图像。A:在注射EPCs第1天后在肿瘤周边出现小片状低信号区;B:注射EPCs第7天后肿瘤内部出现明显的低信号 图3 A,B:分别为对照组相同时间点扫描的SWI图像,肿瘤随着时间的延长逐渐增大,但是其内信号无明显变化Fig.1 T2WI image of fake experimental group.A: There was a triangle Mixed signal consisted of hypointensity signal largely in the left frontal lobe on 1 day after EPCs was transplanted.B: There was the similar signal in the T2WI sequence on 7 day.Fig.2 Changes of SWI image of intracranial glioma model in experiment group on day 1 and 7 day after EPCs transplantation.A: A little hypointensity singal was observed at the periphery of the tumor on SWI image in day 1 after EPCs transplantation.B: SWI shows a large of hypointensity singal in the center of the tumor in day 7 after EPCs transplantation.Fig.3 A, B: Changes of SWI image of intracranial glioma model in control group over time: the signal has no change except for the volume larger.
3 讨论
内皮祖细胞(endothelial progenitor cells,EPCs)是一种可以自我更新、增殖分化为内皮细胞的多能干细胞,其多以静止状态存在于骨髓龛内,可以受到多种细胞因子的趋化作用而释放游走到病变区域参与血管重建[1]。恶性胶质瘤是脑组织内最常见的肿瘤,致死率和复发率很高,其原因主要是由于手术难以全部切除和卫星灶的残存[2]。鉴于EPCs 的归巢特点,有望利用EPCs以载体的方式治疗肿瘤。
为了在MRI能检测到EPCs,笔者利用超小型超顺磁氧化铁粒子(ultrasmall superparamagnetic iron oxide,USPIO)标记EPCs,其敏感性高、无毒,当其分布于组织后,可引起局部磁场改变,缩短组织的T1和T2值,从而使组织信号降低。Lee等[3]用1.5 T磁共振对微凝胶-SPIO标记的EPCs进行示踪,发现其对EPCs的生物学功能没有影响。
我科研究生[4]已证实将EPCs通过尾静脉注射入原位移植的胶质瘤体内后,在病理学上可以检测到EPCs分布于肿瘤内,但原位移植需刺破脑膜和脑组织,造成大鼠脑组织损伤,据相关文献报道[5],EPCs 可以归巢至创伤组织参与组织修复,因此原位移植胶质瘤大鼠脑组织内的EPCs是由于肿瘤趋化所致还是由于创伤趋化所致仍需进一步探讨。笔者将肿瘤组、假肿瘤组和对照组在相同时间点进行MRI扫描,发现假肿瘤组、对照组在各时间点T2WI和SWI上信号变化均不大,而肿瘤组则在注射EPCs后在肿瘤周边出现了明显的点状低信号,并随着瘤龄的增长逐渐增多并迁移入肿瘤内部,为了能够更准确地反应病变内部信号变化的情况,笔者用T2 map序列获得了兴趣区的T2值,假移植组和对照组在5个时间点T2值变化不大,曲线趋于平稳,而肿瘤组5个时间点的T2值逐渐下降,这说明USPIO-EPCs向肿瘤内部大量归巢从而聚集导致T2值下降,而假肿瘤组由于USPIOEPCs归巢较少,T2值变化并不显著。同时,用普鲁士蓝染色后在肿瘤组切片内发现了较多蓝染细胞,主要分布于新生血管周围,而在假移植组脑组织内仅有零星的蓝染细胞,对其各时间点的细胞数量进行计数发现两组之间的差异有统计学意义,证明原位移植时对大鼠颅脑造成的损伤对EPCs归巢影响较小,EPCs的归巢主要是由于该处肿瘤趋化所致。由于巨噬细胞可以吞噬含铁血黄素,其经过普鲁士蓝染色后细胞内也可出现蓝染的颗粒,为了与其鉴别,笔者检测了细胞内F4/80的表达情况,发现普鲁士蓝染色阳性区域的细胞浆内并未出现棕色颗粒,提示之前蓝染的细胞并非巨噬细胞,而是USPIO标记过的EPCs。
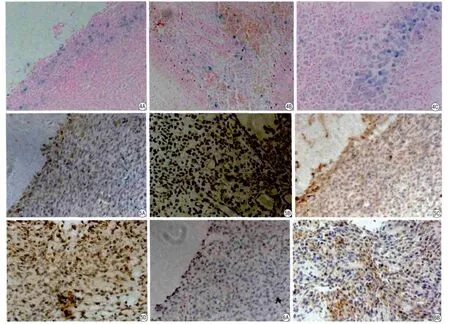
图4 分别肿瘤组移植EPCs后第1天后(A)、第3天(B)和第7天(C)后普鲁士蓝染色:肿瘤细胞区域出现大量蓝染细胞,移植EPCs后第1天染色阳性细胞主要出现在肿瘤表面,第3天和第7天染色阳性细胞逐渐迁移进入肿瘤内部(PB ×200) 图5 A,B:分别为肿瘤组移植USPIO-EPCs后第1天和第7天的MMP-9表达。在移植第1天肿瘤区域即可见明显的MMP-9表达,但肿瘤表面较内部分布较多;而在移植后第7天发现MMP-9在肿瘤内外均有表达,且分布较均匀。C,D:分别为肿瘤组移植USPIO-EPCs后第1天和第7天的SDF-1表达,在移植后第1天肿瘤表面SDF-1表达较内部显著,而在移植后第7天发现SDF-1在肿瘤内外均有表达,且分布较均匀( ×200) 图6 A,B:分别为肿瘤组移植USPIO-EPCs后第1天和第7天的VEGF表达:在移植后第1天肿瘤区域仅见少许零星分布的VEGF表达,表面和内部分布较均匀,在移植后第7天肿瘤内部表达显著增多,染色阳性细胞仍分布较均( ×200)Fig.4 Distribution of Prussian blue (PB) staining-positive cells in experiment group before EPCs transplantation, on day 1 and day 7 after EPCs transplantation.A: Prussian blue staining positive cells were mainly seen at the periphery of the tumor on 1 day after EPCs transplantation.B, C: Prussian blue staining positive cells gradually immigrate in the center of the tumor (PB ×200).Fig 5 A, B: Expression of MMP-9 chemoattractant factors at the sites of migrated USPIO-EPCs in tumors on day 1 and day 7 after EPCs transplantation.MMP-9 staining shows much more obvious expression at the periphery of the tuomr than the centre (A), MMP-9 staining shows generalized expression both in the center and periphery of tumor without obvious discrepancy (B).C, D: Expression of SDF-1 chemoattractant factors at the sites of migrated USPIO-EPCs in tumors on day 1 and day 7 after EPCs transplantation.SDF-1 staining shows much more obvious expression at the periphery of the tuomr than the centre, SDF-1 staining shows generalized expression both in the center and periphery of tumor without obvious discrepancy ( ×200).Fig 6 A, B: Expression of VEGF in the field of the experiment group in tumors on day 1 and day 7 after EPCs transplantation.the number of VEGF stain increases over time , but the distribution is still equality ( ×200).
肿瘤血管生成是微循环网的形成和肿瘤细胞诱发的毛细血管新生,其是实体瘤的后续生长和转移的基础,EPCs可以通过血管发生(vasculogenesis)的方式参与肿瘤血管的形成[6],而EPCs的归巢是一个很复杂的过程,多种化学因子,如SDF-1、HIF-1、VEGF、MMP-9等都是引起EPCs归巢的重要因素[7]。SDF-1是一种对造血干细胞非常有效的化学引诱物,而内皮祖细胞是CD34细胞的一个种属,不管是CD34细胞还是内皮祖细胞都有很明显的CXCR4的表达,这种物质正是SDF1的一个受体,可以促使EPCs向SDF-1表达较多的区域聚集[8]。MMP-9是血管发生启动系统中的成员之一,可以上调和促进肿瘤血管化,并可以动员EPCs从骨髓内释放入外周血[9]。笔者通过免疫组化发现SDF-1和MMP-9在肿瘤早期主要表达在肿瘤外周区,随着瘤龄的增长在肿瘤内部表达增加,且内外分布较均匀,这与EPCs迁移趋势基本一致,因此笔者认为SDF-1和MMP-9在肿瘤内部表达的变化是引起EPCs迁移的原因之一。VEGF是最重要的血管生长刺激因子,可以动员骨髓起源的内皮祖细胞使外周血内的内皮祖细胞增加[10],笔者通过免疫组化发现早期肿瘤VEGF表达不多,且表面和内部分布较均匀,随着瘤龄的增长VEGF表达越来越显著,但内外分布也没有明显差异,因此笔者认为VEGF在EPCs在肿瘤内部由外向内迁移的过程中起到的作用并不大。
总之,利用MRI可以可以对磁性标记的EPCs在体内的分布、归巢和参与血管形成过程进行示踪和定位,其准确性被病理学指标所证实,EPCs在大鼠胶质瘤内的迁移特点可以为转基因内皮祖细胞作为载体携带毒性基因、自杀基因、抗癌药物到达肿瘤微血管区域治疗肿瘤提供相应的依据[11]。
[Rferences]
[1]Kim JY, Ahn HJ, Ryu JH, et al.BH3-only protein Noxa is a mediator of hypoxic cell death induced by hypoxia-inducible factor 1 alpha.J Exp Med, 2009, 199(1): 113-124.
[2]Hu HB, Liu PF.Application of magnetic resonance diffusion tensor imaging and fiber tractography to evaluate the value of diagnostic classifcation of cerebral gliomas.Chin J Magn Reson Imaging, 2011,2(2): 118-122.胡鸿博,刘鹏飞.磁共振弥散张量成像及纤维束成像对脑胶质瘤分级的诊断价值.磁共振成像, 2011, 2(2): 118-122.
[3]Lee ES, Shuter B, Chan J, et al.The use of microgel iron oxide nanoparticles in studies of magnetic resonance relaxation and endothelial progenitor cell labeling.Biomaterials, 2010, 31(2):3296-3306.
[4]Wang B ,Wang Y, Zhang WG, et al.Growth pattern of rat C6 brain gliomas:imaging and histopathologic observation.Acta Academiae Medicinae Militaris Tertiae, 2008, 30(2): 1940-1943.王博, 王毅, 张伟国, 等.大鼠C6脑胶质瘤生长规律的影像学与病理学观察.第三军医大学学报, 2008, 30(2): 1940-1943.
[5]Wu XN,Zhang WG,Fang JQ, et al.Dynamic CT perfusion imaging in rats with traumatic brain injury and its relatingpathophysiological basis: preliminary study.Chin J Trauma, 2011, 27(2): 782-786.吴晓宁, 张伟国, 方靖琴, 等.大鼠颅脑损伤动态CT灌注成像及相关病理生理学基础的初步研究.中华创伤杂志, 2011, 27(2):782-786.
[6]Fang J, Wang S, Chen J, et al.The effects of magnetically labeled rat spleen-originated endothelial progenitor cells on growth of glioma in vivo an experimental study.Acad Radiol, 2011.18(7): 892-901.
[7]Syková E, Jendelová P, Herynek V, et al.MR tracking of stem cells in living recipients.Methods Mol Biol, 2009, 549(1): 197-215.
[8]Wang S, Fang J, Zhang T, et al.Magnetic resonance imaging targeting of intracranial glioma xenografts by Resovist-labeled endothelial progenitor cells.J Neurooncol, 2011, 105(1): 67-75.
[9]Roncalli JG, Tongers J, Renault MA, et al.Endothelial progenitor cells in regenerative medicine and cancer: a decade of research.Trends in Biotechnology, 2008, 26(5): 276-283.
[10]Sathornsumetee S, Rich JN.Antiangiogenic therapy in malignant glioma:promise and challenge.Curr Pharm Des, 2007, 13(35):3545-3558.
[11]Bar J, Onn A.Combined anti-proliferative and anti-angiogenic strategies for cancer.Expert Opin Pharmacother, 2008, 9(5): 710-915.

