1,25-二羟维生素D3对哮喘豚鼠肥大细胞类胰蛋白酶释放的影响
夏 维,石敦义,张桂蓉
(1.重庆市长寿区人民医院呼吸内科 401220;2.重庆医科大学附属第二医院保健科 400010)
1,25-二羟维生素D3是维生素D的活性形式,除了调节钙和骨代谢外,还发挥其他生物活性,如通过多种途径参与免疫调节活动。近期大量研究表明,1,25-二羟维生素D3与哮喘慢性气道炎症呈明显的负相关[1-4],可通过多种途径影响哮喘免疫机制[5-6]。哮喘的发病机制与Ⅰ型变态反应密切相关,而类胰蛋白酶是肥大细胞最多的炎症介质,具有多种生物活性,是肥大细胞激活和介导疾病的标志[7-8]。本研究拟通过1,25-二羟维生素D3对哮喘豚鼠干预治疗后,观察哮喘豚鼠气道反应性及肺组织病理、类胰蛋白酶分布的变化,探讨1,25-二羟维生素D3对哮喘变态反应方面的影响。
1 材料与方法
1.1 材料 (1)实验动物及分组:健康豚鼠30只,雌雄不限,体质量264~362g,由重庆医科大学动物实验中心提供。将30只豚鼠分为对照组(A组)、哮喘组(B组)、1,25-二羟维生素D3组(C组),每组10只。(2)主要试剂:卵清蛋白(OVA)、1,25-二羟维生素D3、氯化乙酰胆碱(Ach)均购自美国sigma公司;速眠新由第三军医大学提供;402型超声雾化器购自上海四菱医疗器械厂;自制密闭有机玻璃箱6L(20cm×20cm×20 cm);抗Tryptase单克隆抗体AA1(一抗)与SP工作试剂盒均由福建迈新公司提供。
1.2 方法
1.2.1 造模及给药方法 哮喘模型的建立:B、C组每只豚鼠腹腔内注射10%OVA溶液1mL致敏,2周后将豚鼠置于密闭有机玻璃箱内,用超声雾化器喷入1%OVA溶液15~30 min。观察豚鼠反应,以出现烦躁、呛咳、呼吸加快等典型的哮喘发作症状为成功动物模型。A组以等量生理盐水进行腹腔注射和雾化,方法同前,上午花生油1mL灌胃,连续15d。B组上午花生油1mL灌胃;C组1,25-二羟维生素D3以2.5μg·kg-1·d-1融入1mL花生油后进行灌胃,均持续15d。第30天按计划取材。
1.2.2 气道反应性测定 豚鼠速眠新麻醉后将其仰卧固定于手术台上,分离暴露出颈内静脉和气管,分别行颈内静脉及气管插管,置于动物肺功能检测分析系统的密闭体积描记箱内,通过动物呼吸机辅助通气,设置呼吸机潮气量6mL/kg,呼吸频率为每分钟70次。先给予生理盐水静脉注射,记录呼气相气道阻力(Re)并作为基础值。而后分次按浓度倍增法依次静脉注射Ach,连续记录Ach注射前、后Re,每次待Re降至正常后再开始下一个剂量,所有动物均给予以下4个剂量:40、80、160、320μg/kg。结果以 Re增高率(Re的实测值/基础值×100%)表示。
1.2.3 肺泡灌洗液(BALF)细胞计数 结扎豚鼠右主支气管,插入连接有注射器的硅胶管,行肺泡灌洗2次,每次4~6 mL,回收率大于80%为成功。回收的BALF予离心机离心(1 500r/min)10min,细胞残渣经稀释滴于血细胞计数板上,40倍光镜下计数细胞总数,HE染色,行细胞分类。
1.2.4 肺组织HE染色及类胰蛋白酶免疫组化染色 取右侧上叶肺组织标本,制成4μm厚的切片,作HE及类胰蛋白酶免疫组化染色,观察气道肺组织的病理改变及肥大细胞类胰蛋白酶颗粒分布情况。
1.3 统计学处理 应用SPSS13.0软件进行统计分析,数据用表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组豚鼠一般情况比较 A组豚鼠雾化吸入生理盐水后呼吸无任何变化,豚鼠行动敏捷,实验过程中无死亡。B组豚鼠雾化吸入OVA后出现呼吸急促,腹式呼吸明显,部分豚鼠可听到哮鸣音,重者出现跌倒,抽搐,实验第1天超敏死亡1只。C组灌胃时误入气管死亡豚鼠1只,豚鼠初期雾化吸入OVA出现哮喘样反应,后期经1,25-二羟维生素D3灌胃后精神饮食逐渐好转,但较A组差。
2.2 气道反应性测定 3组豚鼠气道内阻力基础值比较,差异无统计学意义(P>0.05)。随着Ach浓度的增加,B组Re较A组明显增高(P<0.05),尤其在160~320mg/mL时;C组与A组比较有类似变化。C组Re较B组明显降低(P<0.05),见表1。
2.3 支气管BALF细胞计数及分类 B组BALF细胞总数高于A组,其中以嗜酸性粒细胞增高最为明显(P<0.05)。C组BALF细胞总数及嗜酸性粒细胞比例较B组明显下降(P<0.05),见表2。
2.4 肺组织HE染色 B组气管黏膜组织中大量炎症细胞浸润,以嗜酸性粒细胞为主,其次为中性粒细胞、淋巴细胞等;支气管管腔缩窄,内有大量黏液栓形成,部分气道上皮脱落。气道平滑肌细胞明显增生、肥大,导致平滑肌层增厚。C组气道黏膜非特异性炎症明显减轻,A组则无此病理改变。

表1 3组豚鼠Re比较(x±s,cm H2O/mL·s)
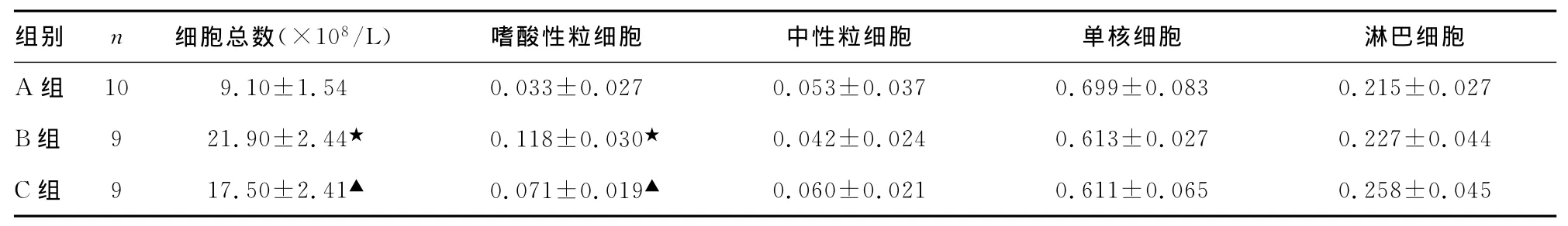
表2 3组豚鼠BALF细胞计数及分类(x±s)
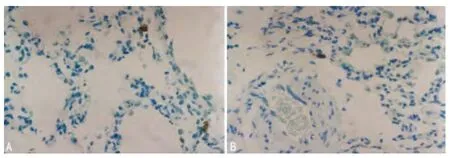
图1 A组Tryptase阳性细胞表达(×400)
2.5 肺组织类胰蛋白酶免疫组化染色 A组Tryptase阳性细胞表达很少,主要散布在黏膜下、肺泡间隔,见图1。B、C组Tryptase阳性细胞表达则明显增多,主要聚集在气管黏膜下、肺泡间隔、血管周围,一些Tryptase阳性颗粒散布在细胞外,见图2、3。B组Tryptase阳性细胞为(17.3±1.19)与 A组(3.2±0.98)比较差异有统计学意义(P<0.05);C组Tryptase阳性细胞(13.9±1.87)较B组(17.3±1.19)明显减少,差异有统计学意义(P<0.05)。

图2 B组Tryptase阳性细胞表达(×400)

图3 C组Tryptase阳性细胞表达(×400)
3 讨 论
哮喘的本质是由多种细胞(如嗜酸性粒细胞、肥大细胞、T淋巴细胞等)和细胞组分参与的慢性气道炎症,这种慢性炎症与气道高反应性密切相关,常表现为Re增高。本实验采用OVA注射致敏、雾化吸入方式诱导复制哮喘动物模型。B组豚鼠在雾化吸入OVA后出现典型的哮喘样反应,Re增高,BALF细胞总数及嗜酸性粒细胞比例增高,肺组织气管上皮细胞肿胀、脱落,管腔变窄,管壁及管腔内有大量炎症细胞浸润,而A组则无上述改变,说明本实验哮喘模型制作成功。
近年来,大量研究表明维生素D与支气管哮喘发病密切相关,可能通过多种途径参与了哮喘的病因学[6]。Brehm等[9]在拉丁美洲哥斯达黎加地区进行横断面调查,回归分析显示1,25-二羟维生素D3缺乏与哮喘发病之间存在明显相关性,且1,25-二羟维生素D3水平越低,哮喘症状越严重。Sutherland等[10]研究发现,在哮喘患者中,维生素D水平与气道反应性、肺功能及糖皮质激素受体密切相关,即患者血清1,25-二羟维生素D3越低,其气道反应性越高(表现为Re增高),糖皮质激素受体敏感越低,肺功能越差。Majak等[11]在给哮喘患者补充维生素D后,发现能明显减低气道炎症反应,从而减少哮喘的急性发作。Boonstr等[12]研究发现,1,25-二羟维生素D3能增加辅助性T淋巴细胞(Th)向Th分化的趋势,Th1下调,Th2上调。在本实验中,C组经1,25-二羟维生素D3处理后,哮喘豚鼠BALF、气管及肺组织中的炎症细胞浸润均明显减轻,Re降低,提示1,25-二羟维生素D3确能减轻哮喘豚鼠的气道炎症反应,降低Re。
在哮喘的变态反应中,肥大细胞的激活至关重要,那么1,25-二羟维生素D3能否对肥大细胞的激活产生影响呢?类胰蛋白酶是一种相对分子质量为134×103的中性丝氨酸蛋白酶四聚体,它高度选择表达于肥大细胞,是肥大细胞激活的产物。在本实验中,B组豚鼠肥大细胞数量及类胰蛋白酶颗粒明显较A组增多,证实类胰蛋白酶参与了哮喘发病过程[13-15]。经1,25-二羟维生素D3处理后,哮喘豚鼠肥大细胞数量及释放的类胰蛋白酶颗粒均明显减少,说明维生素D可能有抑制肥大细胞激活及释放类胰蛋白酶颗粒的作用。
[1]Herr C,Greulich T,Koczulla RA,et al.The role of vitamin D in pulmonary disease:COPD,asthma,infection,and cancer[J].Respir Res,2011,12(1):31.
[2]Camargo CA Jr,Ingham T,Wickens K,et al.Cord-blood 25-hydroxyvitamin D levels and risk of respiratory infection,wheezing,and asthma[J].Pediatrics,2011,127(1):180-187.
[3]Li F,Peng M,Jiang L,et al.Vitamin D deficiency is associated with decreased lung function in Chinese adults with asthma[J].Respiration,2011,81(6):469-475.
[4]Majak P,Olszowiec-Chlebna M,Smejda K,et al.Vitamin D supplementation in children may prevent asthma exacerbation triggered by acute respiratory infection[J].J Allergy Clin Immunol,2011,127(5):1294-1296.
[5]Hansdottir S,Monick MM.Vitamin d effects on lung immunity and respiratory diseases[J].Vitam Horm,2011,86(1):217-237.
[6]Mak G,Hanania NA.Vitamin D and asthma[J].Curr Opin Pulm Med,2011,17(1):1-5.
[7]Bradding P,Walls AF,Holgate ST,et al.The role of the mast cell in the pathophysiology of asthma[J].J Allergy Clin Immunol,2006,117(6):1277-1284.
[8]Hallgren J,Pejler G.Biology of mast cell tryptase.An inflammatory mediator[J].FEBS J,2006,273(9):1871-1895.
[9]Brehm JM,Celedon JC.Serum vitamin D levels and markers of severity of childhood asthma in Costa Rica[J].Am J Respir Crit Care Med,2009,179(8):765-771.
[10]Sutherland ER,Goleva E,Jackson LP,et al.Vitamin D levels,lung function,and steroid response in adult asthma[J].Am J Respir Crit Care Med,2010,181(7):699-704.
[11]Majak P,Olszowiec-Chlebna M,Smejda K,et al.Vitamin D supplementation in children may prevent asthma exacerbation triggered by acute respiratory infection[J].J Allergy Clin Immunol,2011,127(5):1294-1296.
[12]Boonstr A,Barrat FJ,Crain C,et al.lalph 25-Dihydroxy vitamin D3has a direct effect on naive CD4(+)T cells to enhance the development of Th2cells[J].J Immunol,2001,167(9):4974-4980.
[13]Molinari JF,Scuri M,Moore WR,et al.Inhaled tryptase causes bronchoconstriction in sheep via histamine release[J].Am J Respir Crit Care Med,1996,154(3):649-653.
[14]He S,Peng Q,Walls AF,et al.Potent induction of a neutrophil and eosinophil-rich infiltrate in vivo by human mast cell tryptase:selective enhancement of eosinophil recruitment by histamine[J].J Immunol,1997,159(12):6216-6265.
[15]Brown JK,Tyler CL,Jones CA,et al.Tryptase,the dominant secretory granular protein in human mast cells,is a potent mitogen for cultured dog tracheal smooth muscle cells[J].Am J Respir Cell Mol Biol,1995,13(8):227-230.

