利多卡因预处理对颅内肿瘤切除术患者血中丙二醛和内皮素的影响*
傅 洪,周 平△,曲世界,唐 曦,廖 震,罗 超
(重庆市中医院:1.麻醉科;2.肿瘤科;3.神经外科 400021)
颅内肿瘤引起脑组织长时间受压及颅内压增高,导致脑组织局部缺血、缺氧、水肿和坏死等诸多病理生理变化[1]。脑缺血一定时间恢复血液供应后,其功能不但未能恢复,却出现了更加严重的脑功能障碍,称为脑缺血再灌注损伤,其机制较为复杂,目前普遍认为脑缺血再灌注损伤发病机制与自由基过度形成、兴奋性氨基酸毒性作用、脂质过氧化以及细胞内钙超载等多种机制有关[2-3]。已有资料表明利多卡因对脑组织有保护效应[4-5],但将它用于预处理脑保护的临床研究目前报道不多。本实验拟在手术前不同时间使用利多卡因,观察其对颅内肿瘤患者围术期血中丙二醛(MDA)和内皮素(ET)水平及脑功能恢复的影响,探讨利多卡因的脑保护作用及预处理的时机。
1 资料与方法
1.1 一般资料 选取2009年3月至2011年9月本院神经外科60例择期行颅内肿瘤切除术患者,男34例,女26例,平均年龄(48.30±11.04)岁,ASAⅠ~Ⅱ级。术前心、肺、肝、肾功能均大致正常。颅内肿瘤为脑膜瘤48例,胶质瘤12例。将患者随机分为A组(术前48h)、B组(术前24h)、C组(术前12 h)、D组(0h 即诱导时)、E组(对照)、F组(空白对照),每组10例。
1.2 方法 A、B、C、D组均用1%利多卡因1.5mg/kg按预定时间静脉注射预处理后常规诱导麻醉;E组常规诱导麻醉后辅以1%利多卡因2.5mg·kg-1·h-1静脉注射麻醉;F组常规诱导麻醉,术前、术中均不使用利多卡因。患者入手术室后经外周静脉首先予以咪唑安定0.1mg/kg,局部麻醉下经右侧颈内静脉行深静脉置管术(单腔深静脉穿刺包,ARROW公司)及桡动脉穿刺置管,并和测压装置及转换开关等连接。全麻诱导给药顺序为利多卡因(无锡第七制药有限公司)1.5mg/kg、维库溴铵0.1mg/kg、芬太尼3μg/kg、异丙酚(阿斯利康公司,意大利)2.0mg/kg,给氧去氮5min后气管插管。全身麻醉维持为:异丙酚6.0~8.0mg·kg-1·h-1,利多卡因全身麻醉诱导后前20min 11.7mg·kg-1·h-1,之后2.0mg·kg-1·h-1维持,分别经微量泵(Graseby 3500)静脉内给药;手术切皮前静注芬太尼0.1mg,维库溴铵间断静脉注射维持肌松。术中维持潮气量6~8mL/kg,呼吸频率每分钟12~14次,呼气末二氧化碳分压控制在29~31mm Hg。术中根据血流动力学指标判断、调整并控制全身麻醉深度。
1.3 观察指标
1.3.1 术后复苏指标 记录患者术后自主呼吸时间、清醒时间及气管导管拔管时间等。
1.3.2 神经功能缺损评分评估 采用美国国立卫生研究院卒中量表(NIHSS)对患者术前1d和术后14d的神经功能进行评分[6],以评估神经功能缺损程度。
1.3.3 MDA及ET检测 分别于麻醉诱导前,手术结束后即刻取外周静脉血3mL,14 000r/min离心10min,分离血浆,置于-70℃冰箱冻藏待测,ET测定采用放射免疫分析方法(试剂盒由北京科美东雅生物技术有限公司提供),MDA测定采用硫代巴比妥比色法(试剂盒由南京建成生物工程研究所提供)。
1.4 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床复苏指标比较 C组患者的自主呼吸时间、清醒时间和气管导管拔管时间较其他组稍短,但差异无统计学意义(P>0.05)。见表1。
2.2 手术前、后各组患者NIHSS评分比较 术前1dNIHSS评分各组间差异无统计学意义(P>0.05)。术后14dA、B、C、D组与E、F组比较差异有统计学意义(P<0.05)。见表2。
2.3 各组ET和MDA水平比较 麻醉诱导前各组间ET和MDA水平比较,差异无统计学意义(P>0.05);手术后C组与其他组比较,差异有统计学意义(P<0.05),见表3。
表1 各组术后临床复苏指标比较,min)

表1 各组术后临床复苏指标比较,min)
10 5.6±3.6 8.8±3.2 12.5±3.1 B组 10 5.5±4.2 9.6±4.3 13.6±4.6 C组 10 5.1±3.3 8.5±4.8 11.9±3.4 D组 10 6.4±3.5 9.5±4.8 13.4±4.5 E组 10 7.3±4.2 9.9±5.3 12.2±3.8 F组自主呼吸时间 清醒时间 气管导管拔管时间A组组别 n 10 7.5±3.4 9.4±4.3 14.3±4.6
表2 各组手术前、后NIHSS评分比较

表2 各组手术前、后NIHSS评分比较
*:P<0.05,与E、F组比较。
14d A组 10 21.03±6.16 15.13±6.12组别 n 术前1d 术后*B组 10 20.45±8.38 14.25±5.24*C组 10 19.87±5.22 11.84±3.26*D组 10 22.02±7.31 14.43±6.34*E组 10 23.24±5.42 16.57±5.48 F组10 19.21±8.31 17.51±6.29
表3 各组ET和MDA水平比较
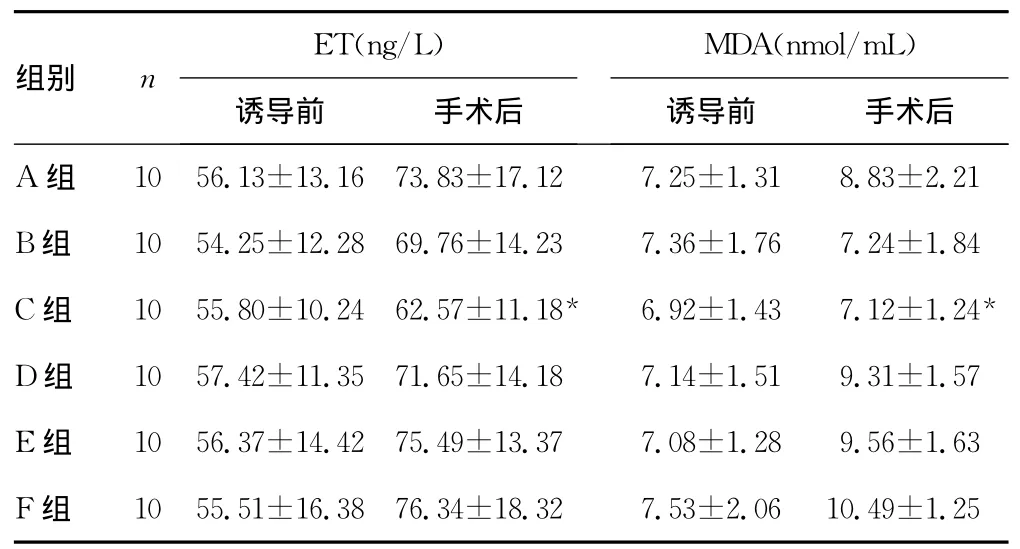
表3 各组ET和MDA水平比较
*:P<0.05,与 A、B、D、E、F组比较。
ET(ng/L)MDA(nmol/mL)组别 n.21 B组 10 54.25±12.28 69.76±14.23 7.36±1.76 7.24±1.84 C组 10 55.80±10.24 62.57±11.18* 6.92±1.43 7.12±1.24*D组 10 57.42±11.35 71.65±14.18 7.14±1.51 9.31±1.57 E组 10 56.37±14.42 75.49±13.37 7.08±1.28 9.56±1.63 F组 10 55.51±16.38 76.34±18.32 7.53±2.06 10.49±诱导前 手术后A组 10 56.13±13.16 73.83±17.12 7.25±1.31 8.83±2诱导前 手术后1.25
3 讨 论
脑缺血再灌注损伤是目前医学研究领域中热点之一。其发病机制仍未阐明,但许多研究者认为,脑细胞内钙超载作用、氧自由基损伤和兴奋性氨基酸的毒性作用与之有关。因此,临床治疗本病还在摸索阶段,尚未取得关键性进展,为打破局面,研究者们提出了一个新的理念:预处理脑保护,其中药物预处理是其中之一。
药物预处理是在脑组织还未受到外界的伤害性刺激之前,事先给机体一定的药物处理,通过药物刺激或模拟人体自身的内源性保护物质而呈现脑保护效果,药物预处理具有安全性好、使用方便、易于控制等优势,成为最流行的脑保护作用的研究途径之一。其他常用的药物有兴奋性氨基酸清除剂、生长因子、能量物质受体激动剂、吸入性麻醉剂等。
目前,利多卡因在实验动物缺血再灌注损伤的脑保护作用方面进行了一些研究,发现在预处理中可产生脑保护作用。
本研究结果显示,C组患者的各项临床复苏指标时间较其他组短,但差异无统计学意义(P>0.05)。在NIHSS评分方面,术前1dNIHSS评分各组间差异无统计学意义(P>0.05);术后14dA、B、C、D组与E、F组比较,差异有统计学意义(P<0.05)。提示术前利多卡因预处理与术中及未使用利多卡因比较,具有一定的神经保护功能。
MDA为脂质过氧化过程中的最终分解产物,当机体处于应激状态时,大量的自由基以及活性氧簇产生,氧化生物膜中的多聚不饱和脂肪酸,引起脂质过氧化反应,产生一些中间产物,并降解成一些小分子终产物,如醛类、酮类及羧酸等,尤以醛类中的MDA最为重要,往往把MDA作为衡量脂质过氧化和氧自由基损害程度的重要指标,其高低可以间接反映细胞受自由基攻击的严重程度[7]。因此,测定MDA水平变化可以反映出机体脑组织脂质过氧化反应的强弱,降低 MDA水平对保护脑缺血再灌注损伤具有重要意义[8-9]。可将其作为观察药物抗脑组织缺血再灌注损伤作用的有效指标。本实验显示,脑缺血再灌注后外周血中MDA水平显著增高,说明脑组织缺血后使脑内脂质过氧化程度明显加剧。而利多卡因预处理能降低脑缺血再灌注损伤时脑组织的MDA水平,从而减少MDA对脑组织的损害,且以术前12h预处理的作用最强,表明氧自由基对多价不饱和脂肪酸的攻击减少,脂质过氧化水平降低,而这种保护作用的高峰出现在给药后12h左右。脂质过氧化水平的降低也提示利多卡因能够降低脑内氧自由基的水平,利多卡因的神经保护作用与降低脂质过氧化水平密切相关。施贤清等[10]对沙土鼠脑缺血再灌注损伤予以利多卡因及异丙酚联合预处理,各个药物预处理组的MDA、乳酸脱氢酶(LDH)、肌酸磷酸激酶(CPK)的水平低于缺血损伤组(P<0.05),而缺血前24h予药物预处理对沙土鼠的脑缺血再灌注损伤均有不同程度的减轻作用,并以联合预处理组的效果最为显著。
ET是目前所知道收缩血管作用最强的神经肽类物质[11]。在生理条件下,ET释放量非常低,主要用于保持血管的张力,当内环境物理化学因素发生变化时,内源性和外源性生物活性物质都可以影响ET的表达和释放。大量的研究表明,脑外科手术后的继发性损伤是许多血管活性物质和神经递质代谢紊乱所造成的,ET代谢紊乱也参与了头颅手术继发性损伤的病理生理过程。脑缺血时,内皮细胞受到强烈刺激,导致ET异常表达和释放增加。在动物实验中也发现脑缺血急性期血浆ET水平增高,且与缺血脑组织中的变化相一致。而且,神经系统损害越严重,血浆ET水平越高,血浆ET水平与疾病严重程度呈正相关趋势。本实验结果表明,利多卡因预处理可明显降低脑缺血后血中ET水平。可能机制是利多卡因能抑制由麻醉及手术所致应激反应,使儿茶酚胺分泌减少,从而使ET分泌减少。由于抑制了交感神经活动,血浆肾素水平降低,而致ET分泌减少,同时利多卡因能减轻脂质过氧化反应,从而保护血管内皮,降低机体内ET水平,达到脑保护作用。唐艳等[12]比较利多卡因和维拉帕米预处理对沙土鼠脑缺血再灌注损伤的保护作用。结果显示利多卡因预处理组ET水平显著低于缺血组(P<0.05),以术前48h最为显著。本实验结果是术前12h最显著,术前48h与对照组比较,差异无统计学意义(P>0.05),这可能与不同物种存在差异有关。
总之,利多卡因预处理能增强脑组织的抗氧化能力,并能拮抗ET的产生及其不良反应,从而减轻神经功能缺损,促进脑功能的恢复,这种作用以在手术前12h预先给药的效果更为显著。
[1]Cecchin D,Chondrogiannis S,Puppa AD,et al.Presurgical(99m)Tc-sestamibi brain SPET/CT versus SPET:a comparison with MRI and histological data in 33patients with brain tumours[J].Nucl Med Commun,2009,30(9):660-668.
[2]Cheng J,Wang F,Yu DF,et al.The cytotoxic mechanism of malondialdehyde and protective effect of carnosine via protein cross-linking/mitochondrial dysfunction/reactive oxygen species/MAPK pathway in neurons[J].Eur J Pharmacol,2011,650(1):184-194.
[3]Ye R,Yang Q,Kong X,et al.Sevoflurane preconditioning improves mitochondrial function and long-term neurologic sequelae after transient cerebral ischemia:role of mitochondrial permeability transition[J].Crit Care Med,2012,40(9):2685-2693.
[4]Mitchell SJ,Merry AF,Frampton C,et al.Cerebral protection by lidocaine during cardiac operations:a follow-up study[J].Ann Thorac Surg,2009,87(3):820-825.
[5]丰浩荣,许鹏程,徐进步,等.利多卡因预处理对大鼠脑缺血再灌注时水通道蛋白表达的影响[J].中国医院药学杂志,2011,31(13):1045-1049.
[6]Yao M,HervéD,Allili N,et al.NIHSS scores in ischemic small vessel disease:a study in CADASIL[J].Cerebrovasc Dis,2012,34(5/6):419-423.
[7]邹金发,吴秀香.原花青素对脑缺血再灌注损伤大鼠炎症及自由基水平的影响[J].中国老年学杂志,2012,32(19):4239-4240.
[8]Maier T,Fromm M,Schieber A,et al.Process and storage stability of anthocyanins and non-anthocyanin phenolics in pectin and gelatin gels enriched with grape pomace extracts[J].Eur Food Res Technol,2009,229(6):949-960.
[9]Gulcin I.Antioxidant activity of l-adrenaline:a structureactivity insight[J].Chem Biol Interac,2009,179(2/3):71-80.
[10]施贤清,王希锋,薛欣盛.利多卡因及异丙酚联合预处理对脑缺血再灌注损伤保护作用[J].中国误诊学杂志,2006,6(9):1630-1633.
[11]McMillen MA,Sumpio BE.Endothelins:polyfunctional cytokines[J].J Am Coll Surg,1995,180(5):621-637.
[12]唐艳,王迪芬.利多卡因和维拉帕米预处理对鼠脑缺血再灌注损伤的保护作用[J].贵阳医学院学报,2006,31(1):34-37.

