陡河水库鱼体汞的生物积累初探
王明猛,闫海鱼,李太山,刘文利,陈旭锋,康静文
1. 太原理工大学,环境科学与工程学院,太原 030024 2. 中国科学院地球化学研究所,环境地球化学国家重点实验室,贵阳550002 3. 唐山市环境监测中心站,唐山130203
陡河水库鱼体汞的生物积累初探
王明猛1,闫海鱼2,*,李太山3,刘文利3,陈旭锋3,康静文1
1. 太原理工大学,环境科学与工程学院,太原 030024 2. 中国科学院地球化学研究所,环境地球化学国家重点实验室,贵阳550002 3. 唐山市环境监测中心站,唐山130203
为了解陡河燃煤电厂大气汞释放对毗邻的陡河水库水生生态系统中鱼体汞含量、生物积累和放大等的影响,本研究采集陡河水库野生鱼、虾和螺蛳,分别测定了鱼样等生物样品中的总汞和甲基汞,并对部分代表性样品测定稳定碳氮同位素比值。鱼汞分布特征和δ13C‰和δ15N‰同位素比值分布特征显示:鱼体(鲜样)中总汞和甲基汞平均含量分别为56.4±26.7和15.5±8.4 ng·g-1,总汞含量最高的是杂食性的白条鱼为133 ng·g-1。不同食性的鱼体δ13C和δ15N稳定同位素值变化范围分别为-28.1‰~-24.4‰和12.0‰~16.1‰,Log10[Hg]与δ15N的线性相关斜率值为负值。以上结果表明:陡河水库鱼体汞总体偏低,没有发现高生物积累和生物放大,其主要原因在于陡河水库水环境中汞含量较低,且陡河水库靠近市区,过度捕捞使可以捕获的鱼样种类和数量偏少,且鱼龄较低。
鱼;汞;稳定同位素;生物积累与放大
汞是唯一一种可以气态形式存在的人体健康非必需金属元素。环境中的汞通常以无机汞和有机汞两种化学形态存在,其中有机汞在水环境中主要以甲基汞存在。甲基汞是毒性最大、最容易通过食物链积累、传递和生物放大的汞形态,环境中低含量的甲基汞(1ng·L-1或更低)通过食物链的积累和传输,在鱼体中可以达到106~107倍[1]。因此,环境中微量汞的增加都可能导致鱼及其他水生物中汞成百上千倍的增加。
水环境中的主要来源于人为排放和自然源,燃煤是我国大气和水体人为汞输入的主要来源之一。燃煤电厂的煤炭燃烧过程中,会释放出大量的汞,其中主要是单质汞。这些汞释放到大气中会进入到水体或土壤环境,进入水环境的汞经过一系列的迁移转化,最终进入水生食物链, 增加汞在食物链中积累的风险。
陡河水库1956年建成,位于燕山南麓的陡河上游,距离唐山15公里处,是河北省建立的第一座大型水库,也是唐山市唯一的饮用水源地。陡河电站是坐落在陡河水库西畔的一个燃煤电站,生产和生活用水都取自陡河水库。该电站拥有完善的除尘除汞的环保工艺,能够有效降低烟气中烟尘和气态汞的排放量,但具体减少的程度并不明了,该电站排放的含汞气体是否对水库水体、沉积物和鱼类等水生物有不良影响,也尚未见报道。为此,本研究选取陡河水库现有优势鱼种、虾和螺蛳,通过测定其汞的形态、含量及稳定碳氮同位素,了解其汞含量和生物富集与放大的程度,以明确陡河水库水生食物链的汞污染现状。
1 材料和方法(Materials and methods)
1.1 样品采集与保存
2013年8月,采集唐山市陡河水库鱼、虾和螺蛳,共计8种38个样本(螺蛳和虾各算1个样本),分别为11尾鲤鱼(Cyprinuscarpio)、12尾鲫鱼(Carassiusauratus)、3尾餐条(Hemiculterleuciculis)、5尾白鲢(Hypophthalmichthysmolitrix)、1尾花鲢(Aristichthysnovilis)、5尾翘嘴红鲌(Erythroculterilishaeformis)、20只螺蛳(Margaryamelanioides)、10只虾(Macrobranchiumnipponense)。
样品采集后立即带回实验室,记录鱼的质量、长度,最后将鱼除鳞、洗净、切取背脊肌肉装入样品袋于冰箱中冷冻保存(-18℃)。由于螺蛳及虾个体小,故在测定其汞含量时将所采集样品去壳、取肉,混合后测定鲜样中总汞和甲基汞;稳定碳氮同位素样品测定前对样品进行冷冻干燥、研磨和过筛(60目)后备用。
1.2 样品分析方法与质量控制
1.2.1 样品分析方法
准确称取样品干样0.0010~0.1000 g (精确到0.0001 g),通过PYRO-915+热解装置(800 ℃以上的高温热解样品),样品中的汞先原子化,汞原子在254 nm共振辐射吸收、塞曼背景校正技术处理后,经过RA-915+塞曼效应汞分析仪在线实时检测,测定时需要用去掉其中的鱼皮和鱼骨[2]。
鱼体甲基汞的测定采用碱消解-水相乙基化结合气相色谱(GC)冷原子荧光(CVAFS)测定[3]。准确称量0.1~0.2 g(精确到0.0001 g)标准干鱼样到25 mL的Teflon消化罐中,加5 mLKOH溶液, 在水浴锅中75±3 ℃加热约3 h,然后用60 ℃超纯水定容到25 mL,摇匀待测。在硼硅玻璃气泡瓶中依次加入约80 mL Milli-Q水、200 μL醋酸钠缓冲溶液、50 μL消解液和200 μL浓度为1%的四乙基硼化钠溶液,通高纯氮气进行吹扫,将汞预富集到Tenax管上,经GC色谱柱分离、高温热解为单质汞蒸汽,最后用冷原子荧光测汞仪测定。
鱼样总汞和甲基汞测定使用的标准物质为NRCC-Tort2(生产国:加拿大),其总汞的标准含量为270±0.06 ng·g-1和152±0.013 ng·g-1。
碳氮稳定同位素组成采用MAT-253质谱仪测定,用δ13C和δ15N‰来表示,并与国际标准P-VDB和大气氮组分相对应。碳同位素选用的标准参考物质为IAEA-cH-6和IAEA-C-3,氮同位素选用的标准参考物质为USGS25、IAEA-N-1、IAEA-N-2和ST-N1。δ13C或δ15N的计算方法食鱼标样比较生物样品的同位素比例:
δ13C或δ15N=[(R样品/R标样)-1]×1 000
(1)
式中R为标样或样品中13C/12C 或15N/14N。
本研究选取了16个具有代表性的不同食性鱼种分别进行碳氮同位素测定。
1.2.2 质量控制
鱼样国际标准参考物质(NRCC-Tort2)的测定总汞和甲基汞的回收率分别达到101%和97%。总汞和甲基汞测定的标准偏差分别为5 ng·g-1和3 ng·g-1,空白测定均低于检测限。
为保证测试结果的准确性,碳氮稳定同位素的测定均采取每个样测定两次,结合标准参考物质的校准,碳氮同位素的重复样测定结果标准偏差平均分别为0.3%和1.5%,仪器测试精度分别为碳同位素0.2‰,氮同位素0.4‰。
1.3 数据处理与分析
本文数据处理采用Office excel 2007、Origin 8 和SPSS 11.0软件。
2 结果与讨论(Results and discussion)
2.1 鱼体中汞的形态含量分布特征
本实验中鱼的个体普遍偏小,鱼龄为1~3冬龄,且以1冬龄为多数,鱼、虾和螺蛳的基本参数见下表1:
陡河水库鱼体汞含量整体较低(图1),根据含水率换算为鲜样中的汞含量总汞和甲基汞含量分别为:56.4±26.7和15.5±8.4 ng·g-1,最高值是杂食性的白条鱼133 ng·g-1,但平均值仍为肉食性鱼(翘嘴红鲌)>杂食性(鲤鱼、鲫鱼和餐条)>滤食性(白鲢和花鲢),总汞含量分别为:76.8、54.1和52.2 ng·g-1;甲基汞含量分别为17.8、16.5和15.5 ng·g-1。鲤鱼和鲫鱼的长度、重量、年龄与汞含量间的相关性均不显著(p>0.05, R=0.08~0.10, n=23),其余样本数量较少,没有做相关性分析。
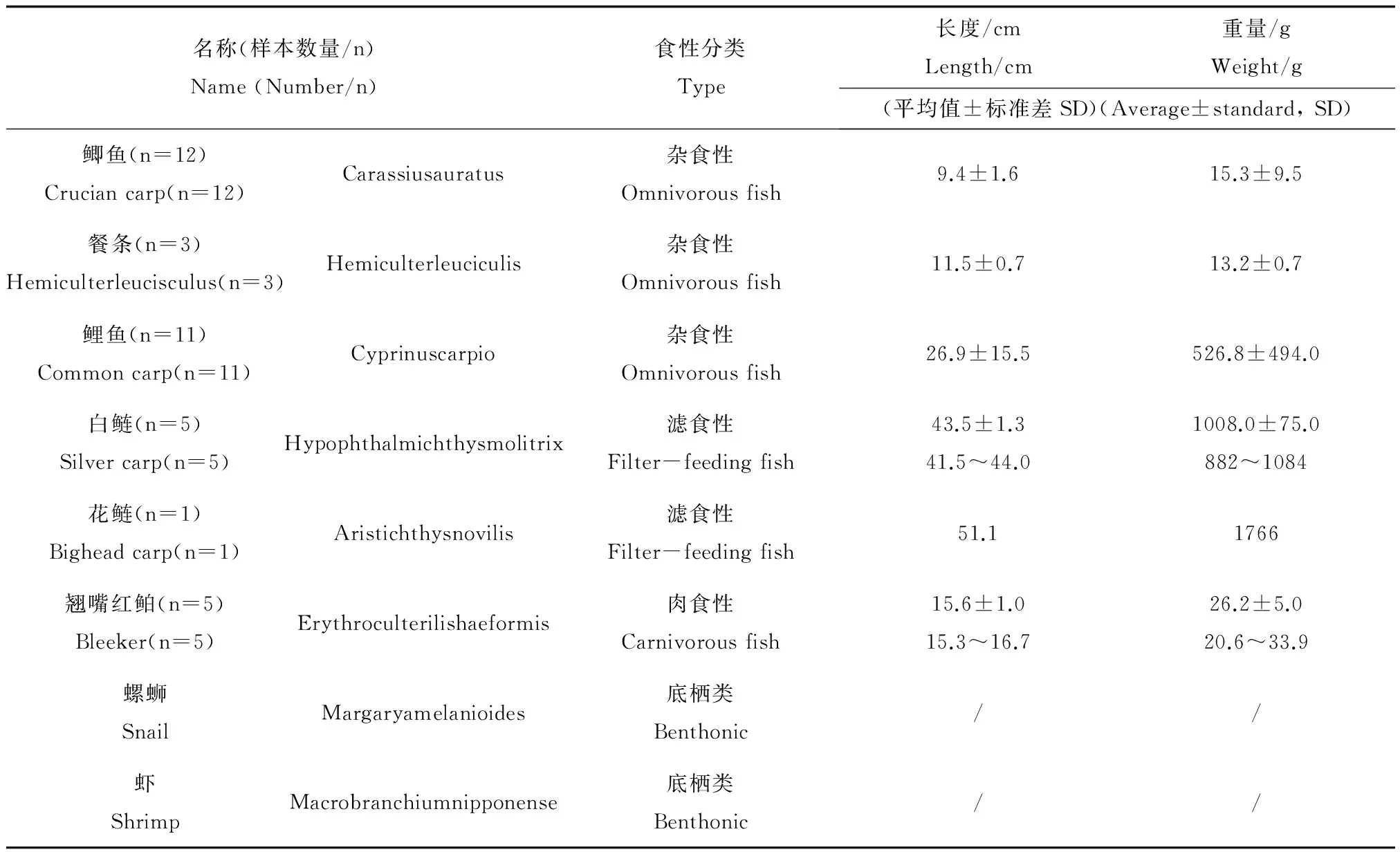
表1 样本的基本参数Table 1 Basic parameter of Samples
注:/表示未对个体进行称重。
Note: / No mass-weighting for individual sample, respectively.
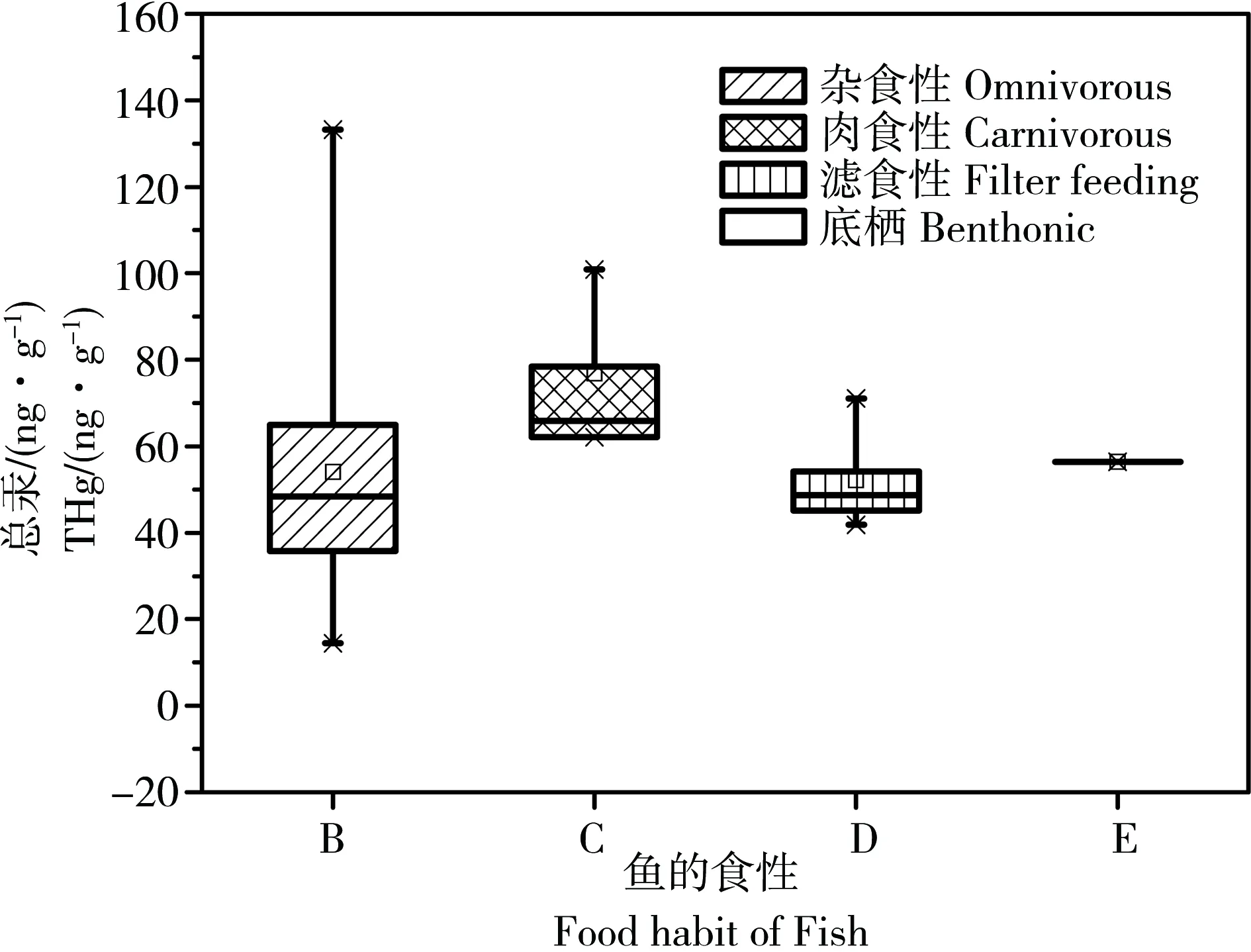
图1 不同食性鱼体总汞含量Fig. 1 THg in difference species fish
底栖生物螺蛳中总汞和甲基汞含量分别为56.4 ng·g-1和8.7 ng·g-1,虾的总汞和甲基汞含量分别为19.3 ng·g-1和5.8 ng·g-1。目前我国淡水鱼在食品中的污染物限量规定,甲基汞含量不超过500 ng·g-1鲜重(GB2762-2012)[4],世界卫生组织[5]汞含量指导限值200 ng·g-1鲜重和美国环保局规定鱼体鲜样中汞含量的食用安全限值甲基汞300 ng·g-1和总汞500 ng·g-1[6]。据此可以看出,陡河水库鱼生物汞含量远远低于这些食用安全标准。与国内部分地区淡水鱼汞含量相比,也相对较低[7-9],远低于北欧、北美地区淡水鱼汞含量[10-11]。
鱼体甲基汞占总汞的比例平均值为28%,低于国际上大部分研究结果认为的高于90%甚至98%[12],与国内大部分研究成果相似,如我国西南贵州乌江流域6个水库鱼体甲基汞占总汞的比例平均值(低于50%)[7,9]、三峡水库(低于30%)(参考王定勇待发表数据)、广东沿海不同养殖方式鱼体比例(低于60%)(参考闫海鱼未发表数据),但显然远低于小浪底鱼体甲基汞占总汞的比例(82.5±9.3)%[13]。甲基汞与总汞含量呈显著正相关性(R=0.649,p<0.01,N=38)。
2.2 鱼体中碳氮稳定同位素分布特征
相邻营养级间动物组织的差值(⊿δ15N)较大且较为恒定,为3.0‰~5.0‰[14],测得相邻营养级间动物组织的δ15N,就可以判断出动物在食物链中的营养级位置。一些研究表明,动物组织中δ13C同位素也会随营养级增加而增加[15],可以与δ15N值一起作为营养级位置的指示物[16]。
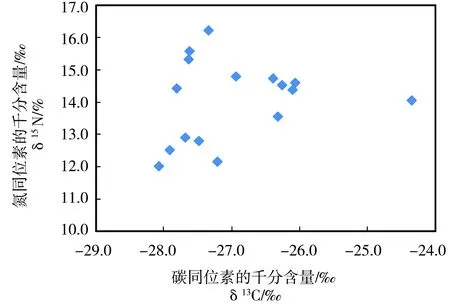
图2 鱼体内碳氮同位素分布特征Fig. 2 Character with the δ15N and δ13C in fish species
陡河水库不同食性的鱼体δ13C和δ15N稳定同位素值变化范围分别为:-28.1‰~-24.4‰和12.0‰~16.1‰,变化范围较小,但δ15N值偏高,最大δ15N与余杨[17]对三峡水库鱼体氮同位素比值测定结果相似(8.26‰~16.98‰),但营养级跨度较低,仅为1.2。根据鱼样的种类判断,陡河鱼类的营养级属于2~3营养级,但实测值为第四营养级[18]。与太湖[19]、百花湖等生态系统中相近[20],但高于国外研究结果,说明该水体生物废水污染普遍存在,并影响到了水生物体的δ15N比值。δ15N同位素差值4.1‰,仅差约1个营养级。通常,生物体内碳同位素与氮同位素比值呈正相关,鱼的营养级越高δ15N越高,δ13C也相对更高,但陡河水库鱼体碳氮同位素比值间没有显著正相关性(图2),前人的研究也发现,不同营养级间δ13C的差值较小(约为0.4‰~1.0‰),因此在判定营养级的应用中受到一定的限制[21],特别是对于食物链较短的情况下,人为干扰较多的城市附近水环境条件,碳来源更为多样化,难以根据δ13C差值判断生物营养级,但是生物体内的碳同位素比值可以分析探究一些难以察觉的有机碳来源,因此,鱼类碳同位素的比值对于鱼类摄食状况有重要的指示意义,故本研究样品中δ13C比值主要用以分析鱼类的食物来源。一般地,浮游生物δ13C比值偏高,约为-16‰~-17‰,陆源有机质δ13C比值则更偏负如-28‰。陡河水库鱼体δ13C比值平均值为(-27.1±0.9)‰,因此可以初步判定其鱼体食物来源十分相近。
2.3 鱼体中氮同位素与汞形态和含量的关系
鱼体汞的随营养级的积累程度通常用Log10[Hg]与δ15N的线性相关斜率值的大小,斜率越
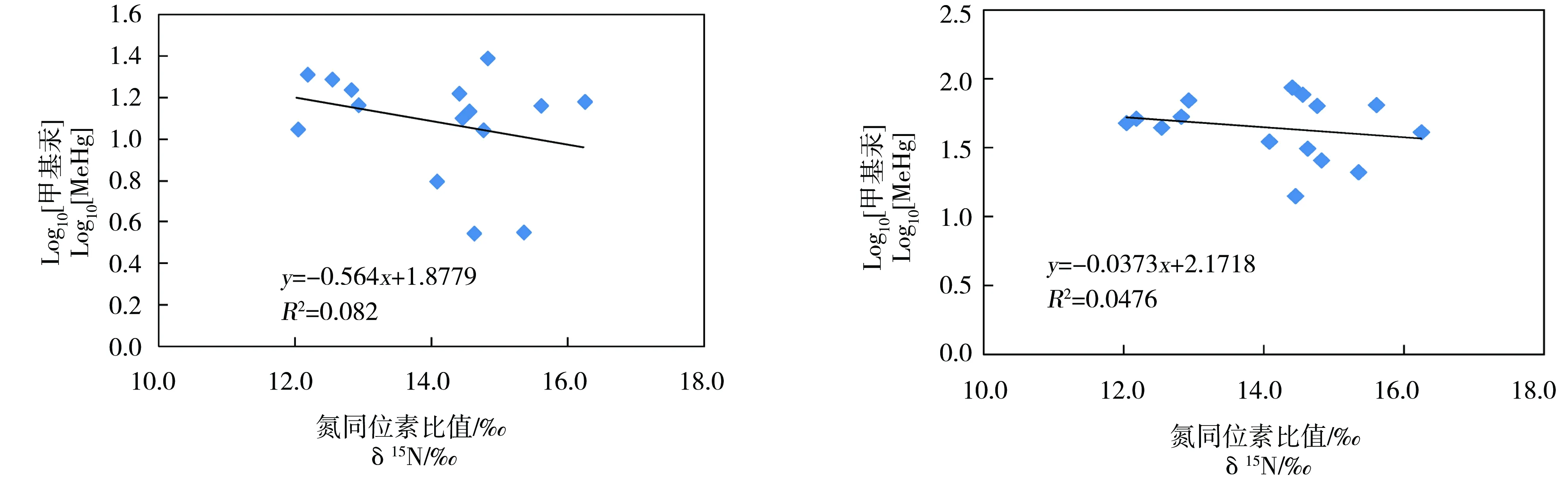
图3 不同食性鱼体内汞和氮同位素的相关性Fig. 1 Correlations with the δ15N and δ13C and mercury in difference feeding habits fish
大说明生物积累程度越高。汞含量与δ15N值的相关性方程Log10[Hg]=aδ15N+b,式中[Hg]表示生物体内总汞或甲基汞浓度,δ15N值为生物体的稳定氮同位素比值,a的大小可以指示汞在生物体内的放大率。
本研究中鱼体甲基汞和总汞在不同营养级的斜率分别为-0.06和-0.04,但线性相关不显著,没有发现汞随水生食物链的富集与放大。我国其他区域研究结果也发现,a值普遍低于国内外大部分研究成果[22-26]。推断可能的原因在于每个研究中选取的鱼种类不同,各种类的鱼所占比例也不同,以大型肉食性海洋鱼类为研究对象,a值则普遍偏大(总汞为0.10~0.20,甲基汞约为0.2~0.3)[27],而以淡水草食性、杂食性为主的鱼类则a值普遍偏低(约为0.06~0.16)。肉食性鱼类肉味鲜美、少刺,因而被过度捕捞,在我国大部分内陆水体已经变得越来越少。陡河水库作为城郊的水源地,大量的钓鱼爱好者前往垂钓,各种鱼类在水中存活时间太短,食物链结构简单且不完整,因此没有出现汞随食物链富集放大的现象。此外,热污染可能也是鱼类种群结构和数量变化的影响因素之一[28]。
综上所述,通过对陡河水库鱼类、虾和螺蛳汞含量及稳定碳氮同位素的测定及结果分析,得出如下结论:
(1)陡河水库鱼体甲基汞含量为3.6~40.1 ng·g-1, 远低于我国《食品中污染物限量》(GB2762-2012)规定的淡水鱼甲基汞含量限值(< 500 ng·g-1)。
(2)没有发现鱼体中汞的高生物积累和生物放大,推断其主要原因电厂排放排放的气态汞对陡河水体和沉积物中汞含量影响较小,因此陡河水库水环境中汞含量较低(水体总汞仅为1.20~3.80 ng·L-1,沉积物干样总汞为0.025~0.100 mg·kg-1),且陡河水库靠近市区,过度捕捞使可以捕获的鱼样种类和数量偏少,且鱼龄较低(最大鱼龄为3+)。
致谢:感谢中国科学院地球化学研究所李仲根副研究员、中国地质大学(武汉)的陈吉、陆卓和贵州大学阳许同学对我们野外采样工作的帮助。
[1] Stein E D, Cohen Y, Winner A M. Environmental distribution and transformation of mercury compounds[J]. Critical Reviews in Environmental Science and Technology, 1996, 26(1): 1-43
[2] 王翠萍, 闫海鱼, 刘鸿雁, 等. 使用Lumex测汞仪快速测定固体样品中总汞的方法[J]. 地球与环境, 2010, 38(3): 378-382
Wang C P, Yan H Y, Liu H Y, et al. The method of rapidly measuring total mercury in solid samples using Lumex analytical equipment [J]. Earth and Environment, 2010, 38(3): 378-382 (in Chinese)
[3] 闫海鱼, 冯新斌, Liang L, 等. GC-CVAFS法测定鱼体内甲基汞的方法研究[J]. 分析测试学报, 2005, 24(6): 78-80
Yan H Y, Feng X B, Liang L, et al. Determination of methyl mercury in fish using GC-CVAFS [J]. Journal of Instrumental Analysis, 2005, 24(6): 78-80 (in Chinese)
[4] 中华人民共和国卫生部. GB2762-2012 食品安全国家标准食品中污染物限量[S]. 北京: 中国标准出版社, 2002
[5] World Health Organization. Environmental Health Criteria 101: Methylmercury [R]. Geneva: WHO, 1990
[6] United States Environmental Protection Agency (US EPA). Human Health Criteria: Methylmercury Fish Tissue Criterion [R]. Washington DC: Office of Water, Office of Science and Technology, 2001
[7] 闫海鱼, 冯新斌, 刘霆, 等. 贵州百花湖鱼体汞污染现状[J]. 生态学杂志, 2008, 27(8): 1357-1361
Yan H Y, Feng X B, Liu T, et al. Present situation of fish mercury pollution in heavily mercury-contaminated BaihuaReservoir inGuizhou [J]. Chinese Journal of Ecology, 2008, 27(8): 1357-1361 (in Chinese)
[8] Yan H Y, Rustadbakken A, Yao H, et al. Total mercury in wild fish in Guizhou Reservoirs, China [J]. Journal of Environmental Sciences, 2010, 22(8): 1129-1136
[9] 姚珩, 冯新斌, 闫海鱼, 等. 贵州乌江流域洪家渡水库鱼体汞研究[J]. 生态学杂志, 2010, 29(6): 1155-1160
Yao H, Feng X B, Yan H Y, et al. Mercury concentration in fish body in Hongjiadu Reservoir of Guizhou Province [J]. Chinese Journal of Ecology, 2010, 29(6): 1155-1160 (in Chinese)
[10] Johnston T A, Leggett W C, Bodaly R A, et al. Temporal changes in mercury bioaccumulation by predatory fishes of boreal lakes following the invasion of an exotic forage fish [J]. Environmental Toxicology and Chemistry, 2003, 22(9): 2057-2062
[11] kerblom S, Nilsson M, Yu J, et al. Temporal change estimation of mercury concentrations in northern pike (Esoxlucius L.) in Swedish lakes [J]. Chemosphere, 2012, 86(5): 439-445
[12] Bloom N S. On the chemical form of mercury in edible fish and marine invertebrate tissue[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1992, 49(5): 1010-1017
[13] 索乾善, 毛宇翔, 张飞鹏, 等. 小浪底水库鱼体汞的污染现状[J]. 环境化学, 2013, 32(11): 2030-2036
Suo Q S, Mao Y X, Zhang F P, et al. Mercury contents in the muscle tissue of fish species in Xiaolangdi Reservoir [J]. Environmental Chemistry, 2013, 32(11): 2030-2036(in Chinese)
[14] Peterson B J, Fry B. Stable isotopes in ecosystem studies [J]. Annual Review of Ecology and Systematic, 1987, 18: 293-320
[15] McCutchan J H, Lewis W M, Kendall C, et al. Variation in trophic shift for stable isotope ratios of carbon, nitrogen and sulfur [J]. Oikos, 2003, 102: 378-390
[16] Olive P J W, Pinnegar J K, Polunin N V C, et al. Isotope trophic-step fractionation: A dynamic equilibrium model [J]. Journal of Animal Ecology, 2003, 72(4): 608-617
[17] 余杨, 王玉春, 周怀东, 等. 三峡水库蓄水初期鱼体汞含量及其水生食物链积累特征[J]. 生态学报, 2013, 33(13): 4059-4067
Yu Y, Wang Y C, Zhou H D, et al. Mercury contents in fish and its biomagnification in the food web in Three Gorges Reservoir after 175m impoundment [J]. ActaEcologica Sinica, 2013, 33(13): 4059-4067
[18] Carlier A, Riera P, Amouroux J M, et al. Benthic trophic network in the Bay of Banyuls-sur-Mer (northwest Mediterranean, France): An assessment based on stable carbon and nitrogen isotopes analysis [J]. Estuarine, Coastal and Shelf Science, 2007, 72(1-2): 1-15
[19] Wang S F, Xing D H, Jia Y F, et al. The distribution of total mercury and methyl mercury in a shallow hypereutrophic lake (Lake Taihu) in two seasons [J]. Applied Geochemistry, 2012, 27(1): 343-351
[20] Liu B, Yan H Y, Wang C P, et al. Insights into low fish mercury bioaccumulation in a mercury-contaminated reservoir, Guizhou, China [J]. Environmental Pollution, 2012, 160: 109-117
[21] Post DM. Using stable isotopes to estimate trophic position: models, methods, and assumptions [J]. Ecology, 2002, 83(3): 703-718
[22] Senn D B, Chesney E J, Blum J D, et al. Stable isotope (N, C, Hg) study of methylmercury sources and trophic transfer in the Northern Gulf of Mexico [J]. Environmental Science & Technology, 2010, 44(5): 1630-1637
[23] Cheng Z, Liang P, Shao D D, et al. Mercury biomagnification in the aquaculture pond ecosystem in the Pearl River Delta [J]. Archives Environmental Contamination and Toxicology, 2011, 61(3): 491-499
[24] Razavi N R, Qu M Z, Jin B S, et al. Mercury biomagnification in subtropical reservoir fishes of eastern China [J]. Ecotoxicology, 2014, 23(2): 133-146
[25] Shao D D, Liang P, Kang Y, et al. Mercury species of sediment and fish in freshwater fish ponds around the Pearl River Delta, PR China: Human health risk assessment [J]. Chemosphere, 2011, 83(4): 443-448
[26] Costa M F, Landing W M, Kehrig H A, et al. Mercury in tropical and subtropical coastal environments [J]. Environmental Research. 2012, 119: 88-100
[27] Coelho J P, Mieiro C L, Pereira E, et al. Mercury biomagnification in a contaminated estuary food web: Effects of age and trophic position using stable isotope analyses [J]. Marine Pollution Bulletin, 2013, 69: 110-115
[28] 盛连喜, 刘伟, 王振堂, 等.热污染对陡河水库鱼类及其水环境的影响[J]. 环境科学学报, 1990, 10(4): 453-463
Sheng L X, Liu W, Wang Z T, et al. Effects of thermal pollution on aquatic environment and fish in Douhe Reservoir [J]. Acta Scientiae Circumstantiae, 1990, 10(4): 453-463 (in Chinese)
◆
PreliminaryStudyonBioaccumulationofMercuryinFishfromDouheReservoir
Wang Mingmeng1, Yan Haiyu2,*, Li Taishan3, Liu Wenli3, Chen Xufeng3, Kang Jingwen1
1. College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan 030024, China 2. State key of laboratory Environmental geochemistry, Institute of Geochemistry, Chinese Academy of Sciences, Guiyang 550002, China 3. Tangshan Municipal Environmental Monitoring Center Station, Tangshan 130203, China
15 May 2014accepted11 June 2014
To understand the impact of atmospheric mercury emissions from a coal-fired power plant on the distributions of mercury in fish as well as bioaccumulation and biomagnification processes of mercury in the food chain, wild fish, shrimp and snails were collected from Douhe reservoir close to the Douhe coal-fired power plant. Total mercury (THg) and methylmercury(MeHg) concentrations for all these samples were measured and some of them were selected for measurements of stable carbon and nitrogen isotopes. Our results showed mean concentrations of 56.4±26.7 ng·g-1for THg and 15.5±8.4 ng·g-1for MeHg in wet weight. The highest THg concentration of 133 ng·g-1is observed in omnivorous fish (Hemiculterleuciculis). δ13C and δ15N values for fishes with different feeding habits were in the ranges of from -28.1‰ to -24.4‰ and from 12.0‰ to 16.1‰, respectively. A correlation with a negative slope was observedbetween lognormal concentrations of THg (Log10[Hg]) and δ15N. Our results indicate that THg and MeHgin fish in Douhe reservoir were at a relatively low level, and no strong bioaccumulation and biomagnifications was found. The explanations may include low mercury concentrations in water, limited species and populations of fish due to the overfishing, and short ages of fish.
fish; mercury; stable isotope; bioaccumulation and biomagnification
唐山市科学技术研究与发展计划(Nos. 12130215A);国家自然科学基金(Nos. 40973083,41273099)
王明猛(1988-),男,在读硕士生,研究方向为环境工程,E-mail: wmqym2006@126.com
*通讯作者(Corresponding author), E-mail: yanhaiyu@vip.skleg.cn
10.7524/AJE.1673-5897-20140515002
2014-05-15录用日期:2014-06-11
1673-5897(2014)5-986-06
: X171.5
: A
闫海鱼(1973—), 女,地球化学专业,博士,副研究员,主要研究方向为汞的生物地球化学循环,发表学术论文50余篇。
王明猛, 闫海鱼, 李太山,等. 陡河水库鱼体汞的生物积累初探[J]. 生态毒理学报,2014, 9(5): 986-991
Wang M M, Yan H Y, Li T S, et al. Preliminary study on bioaccumulation of mercury in fish from Douhe reservoir [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 986-991 (in Chinese)

