贵州万山汞矿地区耐汞野生植物研究
赵甲亭,李云云,高愈希,李柏,李玉锋,赵宇亮,柴之芳
中国科学院高能物理研究所 核辐射与核能技术重点实验室 纳米生物效应与安全性重点实验室,北京 100049
贵州万山汞矿地区耐汞野生植物研究
赵甲亭,李云云,高愈希,李柏,李玉锋*,赵宇亮,柴之芳
中国科学院高能物理研究所 核辐射与核能技术重点实验室 纳米生物效应与安全性重点实验室,北京 100049
在贵州万山地区废弃汞矿堆和矿山附近,受长期高剂量汞暴露的影响经过的自然选择,该地区出现了一些能耐受汞毒性的生态型植物。对汞耐受及汞富集植物的筛选对于汞污染土壤的植物修复具有一定的现实意义。通过对万山梅子溪地区汞污染土壤及汞耐受植物采样调查发现,该区域采样土壤中汞的含量均在50 mg·kg-1以上,达到重度汞污染水平。对该地区野生植物的采样分析发现,蔷薇科植物悬钩子不仅数量较多,单株植物生物量较大,表现出很强的耐汞毒性的能力,而且植株内可以很大程度地富集汞,在其植株中汞的含量可达20 mg·kg-1左右,属于汞富集植物,另外发现野蒿对汞也具有较强的富集能力,其植株中汞的含量可达10 mg·kg-1以上。该类型植物的发现将为植物的汞耐受以及汞富集机理研究提供新的素材,为汞污染土壤的植物修复技术提供新的植物类型,也为进一步开发汞污染土壤处理技术提供了一种可能。
汞耐受和汞富集植物;悬钩子(Rubus L.);汞污染土壤植物修复
汞是毒性最强的重金属元素之一,具有易迁移、易蓄积和不易降解等特点。环境中的汞可以通过食物链在高层级生物体内累积到很高的浓度,危害机体健康,如强烈的致癌、致畸和致突变等[1-2]。汞矿开采、工业生产和燃煤等人为因素是导致我国汞污染的主要原因[3]。矿物开采及金属冶炼过程中产生的大量矿渣、废水和废气排放到周围环境中,废弃物中的汞可随降水流动、沉淀,大气中的汞可经沉降等过程在土壤中沉积[4-5]。土壤中的汞具有明显的空间分布规律,一般地,汞的含量高低与污染源距离远近具有显著的相关性。在汞污染地区,从矿渣或尾矿冲刷下来的雨水经地表径流进入河流,河流中的汞在向下游迁移的过程中,经过沉降与再悬浮作用,一部分汞被沉积物吸附,或被沿途植物所截留,一部分随水流继续迁移从而对周边的环境造成严重的汞污染[6-8]。
万山汞矿位于贵州省东部万山特区,地处云贵高原向湘西丘陵过渡的武陵山区,属黔东低山丘陵河谷地貌,年平均气温在13~14 ℃左右。该地区气候宜人,地貌多样,适宜多种植物生长,矿产资源丰富,汞矿储量居全国首位,并且具有600多年的汞矿开采历史[9]。在长期的汞矿开采和金属冶炼过程中,产生了大量的含汞矿渣等废弃物,造成该地区土壤和植物严重的汞污染。已有文献报导,贵州万山废弃汞矿区的汞污染以土壤、大气污染为主,大部分地区土壤汞含量为24.31~347.52 mg·kg-1,比全国土壤汞含量平均值高出2~3个数量级[10-11]。进入土壤中的汞可以通过食物链积累放大至数十倍,影响动植物生长发育,并最终威胁到人类的健康[12-13]。有研究表明,万山当地的植被中存在明显的汞蓄积,多种植物不同部位的汞含量可达到0.47~331.4 mg·kg-1[13]。Feng等人发现,汞污染地区的水稻可以吸收无机汞和甲基汞,食用稻米成为当地以及周边居民汞尤其是甲基汞暴露的重要来源[14-15]。长期的汞污染可以破坏土壤的营养结构,污染地下水源,甚至严重影响当地生态系统的平衡发展,对当地居民的生活、健康造成了长期、潜在的威胁。近年来,利用超富集植物清除土壤中重金属的技术以其潜在的高效、廉价和环境友好性成为该领域研究的热点,一些能够在地上部大量富集重金属污染物的植物得到研究人员的广泛关注。但是,长期以来人们对超富集植物的研究主要集中在铅、砷等重金属元素,而对汞富集植物的研究还相对较少。
本研究通过对贵州万山特区废弃汞矿地区生长的多种汞耐受野生植物进行汞富集特征分析,对筛选出的数量较多、能在高剂量汞污染环境中生存并且生长旺盛的植物进行汞的吸收、转运和蓄积情况研究,为探索汞耐受植物的汞吸收、转运和富集机制和汞污染地区植生修复技术的推广和应用打下基础。
1 材料和方法(Materials and methods)
1.1 仪器与试剂
仪器及条件:Elemental X7型ICP-MS仪(美国Thermo公司),用含1 μg·L-1的Be、Co、In、U的调谐溶液用于优化仪器的各项参数对ICP-MS仪器条件进行优化,用含2% HNO3的10 μg·L-1Bi溶液作为在线内标。实验过程中ICP-MS工作主要参数设置:射频功率,1 200 W; 冷却气流速,13.0 L·min-1;辅助气流速,0.70 L·min-1;雾室流速,0.72 L·min-1;样品提升速度,0.6 mL·min-1;碰撞气,H2: He = 7.28%,流速5.6 mL·min-1;驻留时间,100 ms。EH35 Aplus型微控数显电热板(德国Labtech公司);RLPHR 1-2 LD plus 冷冻干燥机(德国CHRIST公司);Milli-Q超纯水系统(英国Millipore公司)。MARSxpress密闭微波消解系统(美国CEM公司),样品微波消解条件见表1。
试剂与标液:硝酸(BV-III级),过氧化氢(Mos级),2-巯基乙醇(ME,纯度>99%,Amersco,USA),氯化汞标准品(GBW 08617)购自国家标准物质中心,浓度为1 000 mg·L-1Hg,在实验当天用2%的硝酸(含0.1%的巯基乙醇)逐级稀释成0.5,1,2,5,10,50 μg·L-1做标准曲线使用,内标元素In和Bi的储备液(1 000 mg·L-1,美国Thermo公司)测试时配制成20 μg·L-1的工作液使用,动态监测仪器使用过程中的稳定性。土壤标准样品(GBW07405)和杨树叶标准样品(GBW 07604,GSV-3)均购自中国标准物质中心。所有溶液均用经Milli-Q 纯水系统(Millipore,UK)处理的去离子水 (电阻率 ≥ 18.2 MΩ·cm) 配制。
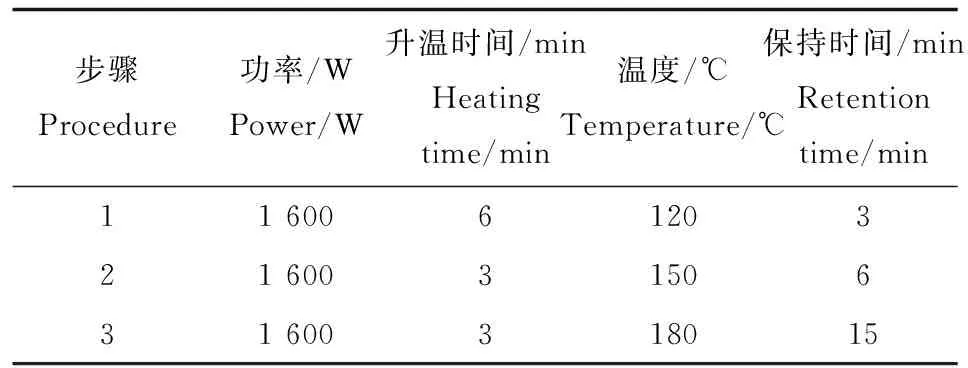
表1 微波消解条件Table 1 The procedure of microwave digestion
1.2 实验材料及处理
实验样品采集与前处理:
本次汞耐受植物采样地点位于东经109° 13',北纬27° 30'的万山梅子溪地区。采集植物标准以植物数量及单株植物的生物量为指标,选择茎干挺拔,枝叶伸展茂密的植物。采集时,将植物连根整株挖出,装入布袋中并且做好标记;另外,收集植物根际土壤装入自封袋中保存,每个位点平行取三份,并且做好相应的标记,共采集12种当地野生植物,包括小飞蓬、蜈蚣草、芒萁、构树、悬钩子、荨麻、野葛、苜蓿、鬼针草、野蒿、旱蓼及苍耳等。
所有植物样品经过超声二次水洗净后,自然风干一周,各组植物分别分割成地下部和地上组织部分,然后进一步进行冷冻干燥24 h。样品冻干后,用液氮辅助研磨成精细粉末,装入自封袋中保存。消解时,每组样品各取三份,每份0.2 g,置于50 mL聚四氟乙烯罐中,各组分别加入4 mL 浓硝酸和0.5 mL双氧水放在通风橱内预消解过夜,第二天将聚四氟乙烯罐密封后置于配套铁罐内整体置于恒温电热箱中,设置消解温度为150 ℃继续消解2~3 h。消解完成后,取出消解罐,若消解液澄清,则认为消解完全,然后将内罐置于电热板(设置为90 ℃)上赶酸至溶液剩余0.5 mL左右,取下冷却至室温,用2%的硝酸(含0.1%的巯基乙醇)定容至5 mL,用ICP-MS对样品进行汞含量分析[16]。
土壤样品经过自然风干后,过100目筛,置于自封袋内室温保存。测试时,准确称取三份土壤样品各0.5 g置于高压消解罐中,各加入3.75 mL浓硝酸,1.25 mL高氯酸,5 mL氢氟酸,加盖密封,进行微波消解[24](微波消解条件见表2),样品消解完成后,待罐内的溶液稍稍冷却,将消解液转移至聚四氟乙烯罐中,置于电热板上用90 ℃恒温赶酸至0.5 mL左右,用2%的硝酸溶液(含0.1%的巯基乙醇)将其定容至5 mL,ICP-MS总汞含量分析[17-18]。
1.3 研究指标
1.3.1 采样点土壤中汞的生态风险评价
本研究中采用地积累指数法评价采样点土壤中汞的污染程度。地积累指数法是德国学者Muller[19]在评价沉积物中重金属污染等级时提出的,目前广泛应用于土壤重金属的污染评价,一般将土壤重金属污染程度分为7级(见表2)。计算公式如下:
Igeo= log2[C / (k × B) ]
式中:C为土壤中汞的含量;B为汞背景值,本研究中采用贵州土壤背景值,汞背景含量约为0.16 mg·kg-1;k为考虑当地背景值的变动而取的系数,一般为1.5。

表2 汞污染地积累指数级别Table 2 Igeo for evaluating Hg contaminated soil
1.3.2 植物对土壤中汞的生物富集系数(BAF)[20]
生物富集系数(AF)=植物体内汞浓度(Cp)/土壤中汞的浓度(Cs)
1.3.3 植物体内汞的生物转运系数(TF)[21]
生物转运系数(TF)=植物地上部汞浓度(Cu)/植物根部汞浓度(Cd)
1.4 数据处理
通过EXCEL数据处理软件,将ICP-MS原始测量数据进行归一化处理,并制表分析。利用Origin 8.0软件进行绘图。
2 结果 (Results)
2.1 采样点土壤污染程度
本实验中应用地积累指数法评价了采样点土壤中汞的污染水平,各采样点土壤中汞的地积累指数如表3所示。
从表3中可以看出,各植物采样位点土壤中汞的含量均>50 mg·kg-1,高出世界土壤汞含量背景值(0.03 ~ 0.1 mg·kg-1) 2 ~ 3个数量级,而且远远大于国家土壤三级标准的限制值(Hg ≤ 1.5 mg·kg-1),各位点的汞污染地积累指数均>5,达到严重汞污染水平,存在很大的生态风险。
2.2 植物对汞的生物富集水平分析
对贵州万山废弃汞矿区生长的植物采样调查发现,与不少正在使用的矿山废弃地很少有野生植物生长的情形不同,该地区有大量野生植物成簇生长,但是植物的种类组成较为简单,大多数为丛生的草本植物。本次调查共记录了12种生长数量较多的野生植物,包括菊科植物小飞蓬、凤尾蕨科植物蜈蚣草、蔷薇科植物悬钩子等植物种类(见表3)。这些植物长势较好,单株生物量比较大,对汞敏感性比较低,大都表现出较强的耐汞毒害的特征。
对采集的植物消解后,利用ICP-MS分析植物根部和地上组织部分汞的含量,结果如表3所示。结果表明,12种植物各组织中汞含量差异比较显著,其中悬钩子的汞含量最高,根部汞含量达到15.6 mg·kg-1,地上部汞含量达到6.1 mg·kg-1,且植株长势比较茂盛,植物总体数量及单株植物生物量较大,表明该种植物具有较强的抗汞毒害能力;其次是野蒿,其根部汞含量为13.6 mg·kg-1,地上部汞含量为5.2 mg·kg-1;然后是野葛,其根部汞含量也超过10 mg·kg-1。其余植物各组织中汞的含量均<10 mg·kg-1,汞含量最小的是蜈蚣草,仅为1 mg·kg-1左右,而且蜈蚣草植株长势相对比较弱小,表明其抗汞毒害能力较弱。悬钩子和野蒿地上部汞含量高于5 mg·kg-1,对汞富集能力较强,属于高富汞植物;野葛的地上部汞含量>3 mg·kg-1,而<3.5 mg·kg-1,可划为中富汞植物,其余植物对汞的生物富集能力比较低。
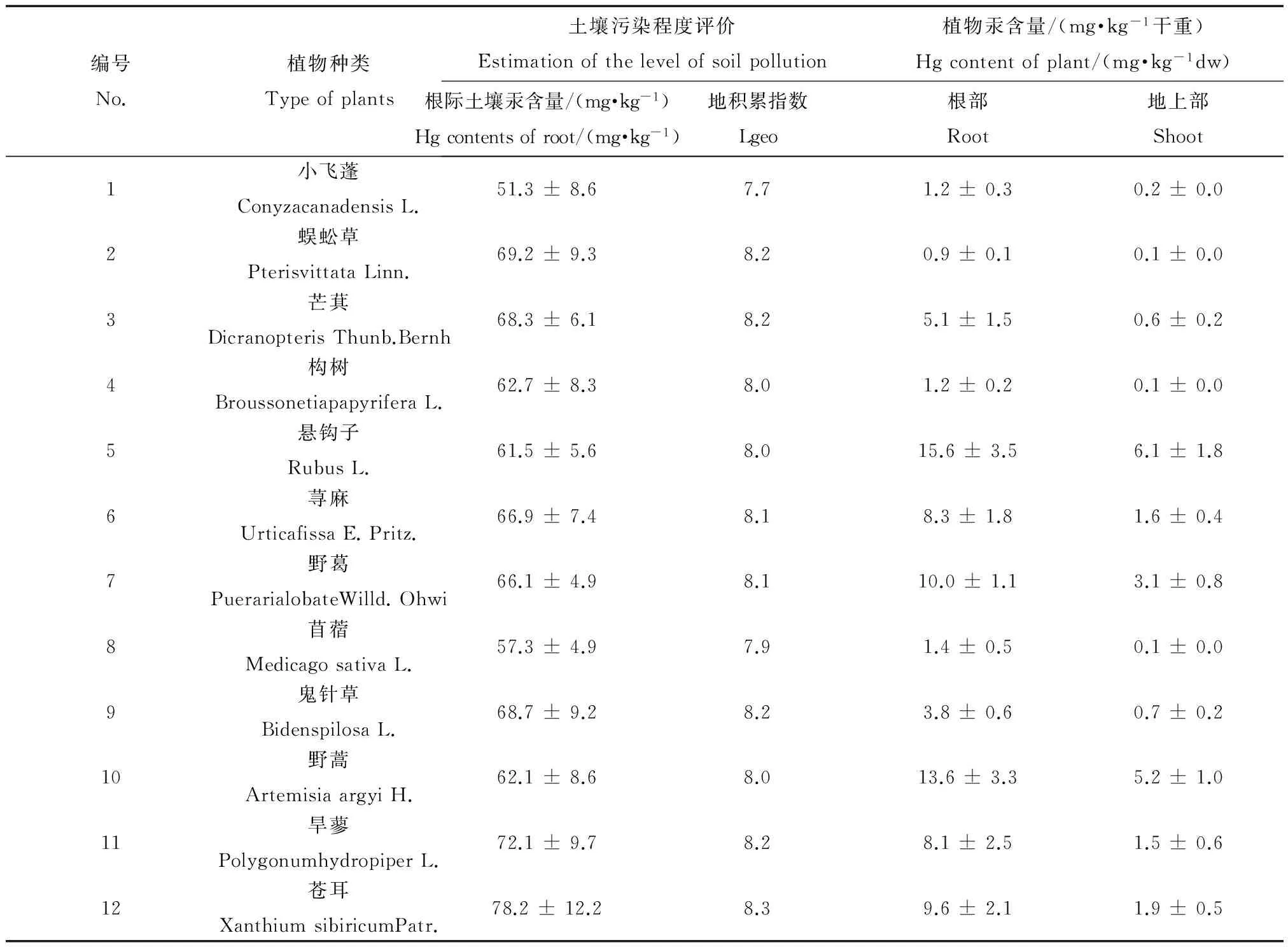
表3 野生植物根际土壤及各组织部分中汞的含量Table 3 The concentrations of Hg in the collected soils and wild plants
注:采样位置坐标:1#(N 27°30'15.0",E 109°13'26.9"); 2-4#(N 27°30'14.8",E 109°13'28.1"); 5-12#(N 27°30'15.7",E 109°13'27")
Note: coordinates of the sampling sites, 1#(N 27°30'15.0",E 109°13'26.9"); 2-4#(N 27°30'14.8",E 109°13'28.1"); 5-12#(N 27°30'15.7",E 109°13'27")
植物对汞的生物富集系数(bioaccumulation factors, BAF)见图1。从图1中可以看出,悬钩子对汞的富集能力最强,对汞的生物富集系数>35%,其次是野蒿对汞的生物富集系数约为30%,这两种植物对汞表现出较强的富集能力。其余野生植物虽然生物量也比较大,但对汞的生物富集系数均<25%,对汞的富集能力较小。在采集位点数量较多的蜈蚣草对汞的富集能力最小,对汞的生物富集系数仅为1%左右。植物地上部汞的含量更能反映出植物对土壤中汞的提取能力和转运效率,植物对汞的生物转运系数(transfer factors, TF)见图2。从图2中可以看出,与植物对汞的生物富集系数类似,在所采集植物中,悬钩子对汞的生物转运系数最高,约为40% ~ 45%,这也反映出其对汞有较强的生物富集能力;其次是野蒿对汞的生物转运系数在40%左右。另外,野葛对汞的生物转运系数在30% ~ 35%之间,而其余植物对汞的生物转运系数均<20%,苜蓿对汞的生物转运系数最低,仅为6%左右,反映出这些植物虽然具有一定的耐汞毒害的能力但对汞的生物富集能力比较小。

图1 植物对汞的生物富集系数(BAF)Fig. 1 BAF of Hg in wild plants

图2 植物对汞的生物转运系数(TF)Fig. 2 The TF of Hg in wild plants
3 讨论 (Discussions)
由于汞矿资源的枯竭,万山地区大规模的汞矿开采、冶炼活动均已停止。但是长期的汞资源开发,产生了大量固体废弃物,无论尾矿、废弃矿,还是冶炼矿渣中都含有远高于环境背景值的汞。有文献报导矿区土壤总汞的含量为12.12 mg·kg-1~ 447 mg·kg-1,这些汞通过降水、大气颗粒物沉降等过程,长期而缓慢地释放到周围环境中,造成矿区周边土壤严重的汞污染,进而影响该地区植被的种类、数量与质量[22]。
受高剂量汞污染的影响,经过长期的自然选择,在废弃汞矿堆和原矿区周边地区,出现了一些能耐受汞污染的生态型植物,其中以草本植物为主,乔木和灌木比较少。一般来说,重金属超富集植物是指能够大量吸收环境中的重金属,并可高效地将其转移到地上部的植物,这类植物一般应满足两个条件:一,富集系数>1,即植物中重金属含量/土壤中重金属含量>1;二,转运系数>1,即植物地上部重金属含量/地下部重金属含量>1[23]。由于汞是毒性最强的重金属元素之一,长期较高剂量的汞暴露环境下大多数植物难以正常生长,对于汞富集植物来说,植物体内汞含量一般应达到10 mg·kg-1以上[24]。目前为止,关于国内重金属超富集植物的报导还比较少,且大多集中在对As,Cd等元素富集植物的研究,如陈同斌等发现As超富集植物蜈蚣草[25];魏树和等筛选出Cd超富集植物龙葵[26];薛生国等在湖南湘潭锰矿区发现Mn超富集植物商陆[27],以及张学洪等在广西某电镀厂附近发现的Cr超富集植物李氏禾等[28],但是对汞超富集植物的相关报导还很有限。在国内仅有王明勇等发现大戟科植物乳浆大戟对汞具有较强的吸收、富集能力,在采样点土壤中汞含量为100.3 mg·kg-1~ 123.9 mg·kg-1时,乳浆大戟根部积累汞的量为8.6 mg·kg-1~ 13.3 mg·kg-1,地上部汞含量可达15.1 mg·kg-1左右[29]。在该研究中,通过对高剂量汞污染的废弃汞矿地区,覆盖度较大的野生植物进行采样分析,发现蔷薇科植物悬钩子和菊科植物野蒿不仅数量较多,而且对汞污染环境的适应性也较好,在土壤中汞含量很高的情况下,悬钩子对汞的生物富集和生物转运效率虽然<1,但仍然能够达到50%左右,植物体内汞的含量可达到20 mg·kg-1左右,表明悬钩子不仅具有很强抗汞毒害的能力,可以有效地从土壤环境中吸收汞,并且将其转运至地上部并累积。矿区采样中虽未发现乳浆大戟,但在该地区大多数植物都生长较弱势的情况下,悬钩子组织中汞含量较高并且能够大量生长和繁殖,表明其具有较强的汞耐受和汞富集能力。
对汞耐受植物的筛选和植物对汞富集能力的分析,在汞污染土壤的植生修复方面有着重要的应用价值[30]。在汞污染地区汞耐受植物一般生长比较旺盛,生物量较大,扩培后可通过收割移除土壤中汞的办法来对汞污染土壤进行修复。悬钩子耐贫瘠、适应性强,且地上部生物量相对较大,对汞的耐性较强并且能够很大程度地蓄积汞,这为汞污染土壤的人工植物修复技术提供了一种新的植物种类,也为开发汞污染土壤无损处理技术提供了一种可能途径。但是,到目前为止所筛选的汞耐受植物对汞的总体富集能力和转运效果相对较弱,距实际应用还有一定的距离,进一步了解这类植物的耐汞及富集汞的机理,提高汞耐受植物对汞吸收以及植物对汞从根部到地上组织部分的转运效率,对汞污染地区土壤植物修复具有重要意义,这部分的工作还有待于进一步深入探讨。
[1] Zahir F, Rizwi S J, Haq S K, et al. Low dose mercury toxicity and human health [J]. Environmental Toxicology and Pharmacology, 2005, 20(2): 351-360
[2] 安建博, 张瑞娟. 低剂量汞毒性与人体健康[J]. 国外医学: 医学地理分册, 2007, 28(1): 39-42
[3] 胡月红. 国内外汞污染分布状况研究综述[J]. 环境保护科学, 2008, 34(1): 38-41
[4] Gillis A A, Miller D R. Some local environmental effects on mercury emission and absorption at a soil surface. Science of The Total Environment, 2000, 260(1): 191-200
[5] Wang D, Shi X, Wei S. Accumulation and transformation of atmospheric mercury in soil [J]. Science of The Total Environment, 2003, 304(1): 209-214
[6] Domagalski J. Mercury and methylmercury in water and sediment of the Sacramento River Basin, California [J]. Applied Geochemistry, 2001, 16(15): 1677-1691
[7] Biester H, Muller G, Scholer H. Binding and mobility of mercury in soils contaminated by emissions from chlor-alkali plants [J]. Science of The Total Environment, 2002, 284(1): 191-203
[8] Hines M E, Horvat M, Faganeli J, et al. Mercury biogeochemistry in the Idrija River, Slovenia, from above the mine into the Gulf of Trieste [J]. Environmental Research, 2000, 83(2): 129-139
[9] 包正铎, 王建旭, 冯新斌, 等. 贵州万山汞矿区污染土壤中汞的形态分布特征[J]. 生态学杂志, 2011, 30(5): 907-913
Bao Z D, Wang J X, Feng X B, et al. Distribution of mercury speciation in polluted soils of Wanshan mercury mining area in Guizhou [J]. Chinese Journal of Ecology, 2011, 30(5): 907-913(in Chinese)
[10] Jiang G B, Shi J B, Feng X B. Mercury pollution in China [J]. Environmental science & technology, 2006, 40(12): 3672-3678
[11] Zhang H, Feng X B, Larssen T, et al. Fractionation, distribution and transport of mercury in rivers and tributaries around Wanshan Hg mining district, Guizhou province, southwestern China: Part 1 Total mercury[J]. Applied Geochemistry, 2010, 25(5): 633-641
[12] Meng B, Feng X B, Qiu G L, et al. The process of methylmercury accumulation in rice (Oryza sativa L.) [J]. Environmental Science & Technology, 2011, 45(7): 2711-2717
[13] Qiu G L, Feng X B, Wang S, et al. Mercury and methylmercury in riparian soil, sediments, mine-waste calcines, and moss from abandoned Hg mines in east Guizhou province, southwestern China [J]. Applied Geochemistry, 2005, 20(3): 627-638
[14] Feng X B, Li P, Qiu G L, et al. Human exposure to methylmercury through rice intake in mercury mining areas, Guizhou Province, China [J]. Environmental Science & Technology, 2007, 42(1): 326-332
[15] Horvat M, Nolde N, Fajon V, et al. Total mercury, methylmercury and selenium in mercury polluted areas in the province Guizhou, China [J]. Science of The Total Environment, 2003, 304(1-3), 231-256
[16] Zhao J T, Gao Y X, Li Y F, et al. Selenium inhibits the phytotoxicity of mercury in garlic (Allium sativum) [J]. Environmental Research, 2013, 125: 75-81
[17] Zhao J T, Hu Y, Gao Y X, et al. Mercury modulates selenium activity via altering its accumulation and speciation in garlic (Allium sativum) [J]. Metallomics, 2013, 5(7): 896-903
[18] Li Y F, Chen C Y, Li B, et al. Elimination efficiency of different reagents for the memory effect of mercury using ICP-MS [J]. Journal of Analytical Atomic Spectrometry, 2006, 21(1): 94-96
[19] Forstner U A W, Calmano W. Sediment quality objectives and criteria development in Germany [J]. Water Science and Technology, 1993, 28: 307-314
[20] Moreno-Jiménez E, Gamarra R, Carpena-Ruiz R, et al. Mercury bioaccumulation and phytotoxicity in two wild plant species of Almad n area [J]. Chemosphere, 2006, 63(11): 1969-1973
[21] Wang J X, Feng X B, Anderson C W, et al. Implications of mercury speciation in thiosulfate treated plants [J]. Environmental Science &Technology, 2012, 46(10): 5361-5368
[22] Li P, Feng X B, Shang L H, et al. Mercury pollution from artisanal mercury mining in Tongren, Guizhou, China [J]. Applied Geochemistry, 2008, 23(8): 2055-2064
[23] 韩 阳, 李雪梅, 朱延姝, 等. 环境污染与植物功能[M]. 北京: 化学工业出版社, 2005, 37-46
[24] 张玉秀, 柴团耀. 植物重金属调节基因的分离和功能[M]. 北京: 中国农业出版社, 2006, 22-28
[25] 陈同斌, 韦朝阳, 黄泽春, 等. 砷超富集植物蜈蚣草及其对砷的宫集特征[J]. 科学通报, 2002, 47(3): 207-210
[26] 魏树和, 周启星, 王新. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学, 2005, 26(3): 67-171
Wei S H, Zhou Q X, Wang X. Cadmium-hyperaccumulatorSolanum nigrum L. and its accumulating characteristics [J]. Environmental Science, 2005, 26(3): 67-171 (in Chinese)
[27] 薛生国, 陈英旭, 林琦, 等. 中国首次发现的锰超积累植物——商陆[J]. 生态学报, 2003, 23(5): 935-937
Xue Shengguo, Chen Yingxu, Lin Qi, et al. Phytolacca acinosa Roxb. (Phytolaccaceae): A new manganese hyperaccumulator plant from Southern China [J]. Acta Ecologica Sinica, 2003, 23(5): 935-937 (in Chinese)
[28] 张学洪, 罗亚平, 黄海涛, 等. 一种新发现的湿生铬超积累植物--李氏禾(Leersia hexandra Swartz)[J]. 生态学报, 2006, 26(3): 950-953
Zhang X H, Luo Y P, Huang H T, et al. Leersia hexandraSwartz:a newly discovered hygrophyte with chromium hyperaccumulator properties [J]. Acta Ecologica Sinica, 2006, 26(3): 950-953 (in Chinese)
[29] 王明勇, 乙引. 一种新发现的汞富集植物——乳浆大戟[J]. 江苏农业科学, 2010, 2, 354-356
[30] Lombi E, Zhao F, Dunham S, et al. Phytoremediation of heavy metal-contaminated soils [J]. Journal of Environmental Quality, 2001, 30(6): 1919-1926
◆
StudyofMercuryResistantWildPlantsGrowingintheMercuryMineAreaofWanshanDistrict,GuizhouProvince
Zhao Jiating, Li Yunyun, GaoYuxi, Li Bai, Li Yufeng*, Zhao Yuliang, Chai Zhifang
Key Lab of Nuclear Radiation and Nuclear Energy Technology, Key Lab for Biomedical Effects of Nanomaterials and Nanosafety, Institute of High Energy Physics, Chinese Academy of Sciences, Beijing 100049, China
15 May 2014accepted1 July 2014
With a long-term exposure to high levels of mercury (Hg), Hg-resistant wild plants were naturally selected to survive in the region near the abandoned Hg mine area in Wanshan District, Guizhou Province. The screening of Hg-resistant and -hyperaccumulation plants is practically significant for the phytoremediation of Hg contaminated soils. The concentrations of Hg in the soils and wild plants collected from Meizi rivulet in Wanshan district were analyzed. The results indicated that the contents of Hg in most of the soils surpassed 50 mg·kg-1which reached severe degree of Hg contamination. The concentration of Hg in Rubus L. which was found to have a large biomass survived in the Hg contaminated area can reach up to 20 mg·kg-1. Rubus L. can be considered as one of the Hg resistant and enriched plants. Additionally, the concentration of Hg in Artemisia argyi H. can also reach up to 10 mg·kg-1or more, indicating a strong capability for accumulating Hg of this plant. The Hg-resistant and Hg-hyperaccumulation plants discovered in this study can provide new model plants for revealing the mechanisms of Hg resistance and Hg accumulation in plant, and new insights for improving the phytoremediation techniques in Hg contaminated soils.
Hg resistant and enriched plant; Rubus L.; phytoremediation of Hg contaminated soils
国家自然科学基金(Nos. 21377129, 11205168);
赵甲亭(1984-),男,博士,研究方向为重金属环境毒理学,E-mail: zhaojt@ihep.ac.cn
*通讯作者(Corresponding author),E-mail: liyf@ihep.ac.cn
10.7524/AJE.1673-5897-20140515006
2014-05-15录用日期:2014-07-01
1673-5897(2014)5-881-07
: X171.5
: A
李玉锋(1977—),男,博士,副研究员,主要从事金属组学以及汞的环境生物学效应相关研究。
赵甲亭, 李云云, 高愈希, 等. 贵州万山汞矿地区耐汞野生植物研究[J]. 生态毒理学报,2014, 9(5): 881-887
Zhao J T, Li Y Y, Gao Y X, et al. Study of mercury resistant wild plants growing in the mercury mine area of Wanshan district, Guizhou Province [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 881-887 (in Chinese)

