原发性肝癌术后早期复发的危险因素分析
王 浩,朱 冰,苏鹏飞
肝癌是严重威胁我国人民健康的常见恶性肿瘤,术后复发率高[1,2]。研究肝癌术后早期复发的危险因素有利于早期识别高风险复发人群,尽早给予及时的处理,以改善预后[2]。本研究收集原发性肝癌(primary liver cancer,PLC)患者的临床和组织病理学资料,分析了PLC术后早期复发的危险因素。
1 资料与方法
1.1 一般资料 2001年~2010年收治的PLC患者51例,男性45例,女性6例;平均年龄(49.3±8.4)岁(31~75岁)。手术完整切除肿瘤,切缘肿瘤细胞阴性,经病理学检查证实为原发性肝癌。以2年为早期复发的时限依据[3],在51例中早期复发35例,其中肺转移3例,骨转移2例,肝内复发30例。早期复发指根治性手术后2年内肿瘤复发或转移。无瘤生存期(disease-free survival,DFS)指手术日期至术后复发的时间间隔。
1.2 随访 定期检测肝功能、血清AFP,行腹部B超、胸片、CT、MRI或 PET-CT检查。
1.3 统计学处理 采用SPSS 19.0软件进行统计学处理,采用卡方检验或Fisher确切概率计算、Kaplan–Meier法及Cox风险比例模型分析早期复发的危险因素。P<0.05时被认为差异有统计学意义。
2 结果
2.1 PLC早期复发的相关因素 血清谷草转氨酶水平、是否伴有肝硬化、肿瘤包膜是否完整和血管侵犯与早期复发相关(表1)。
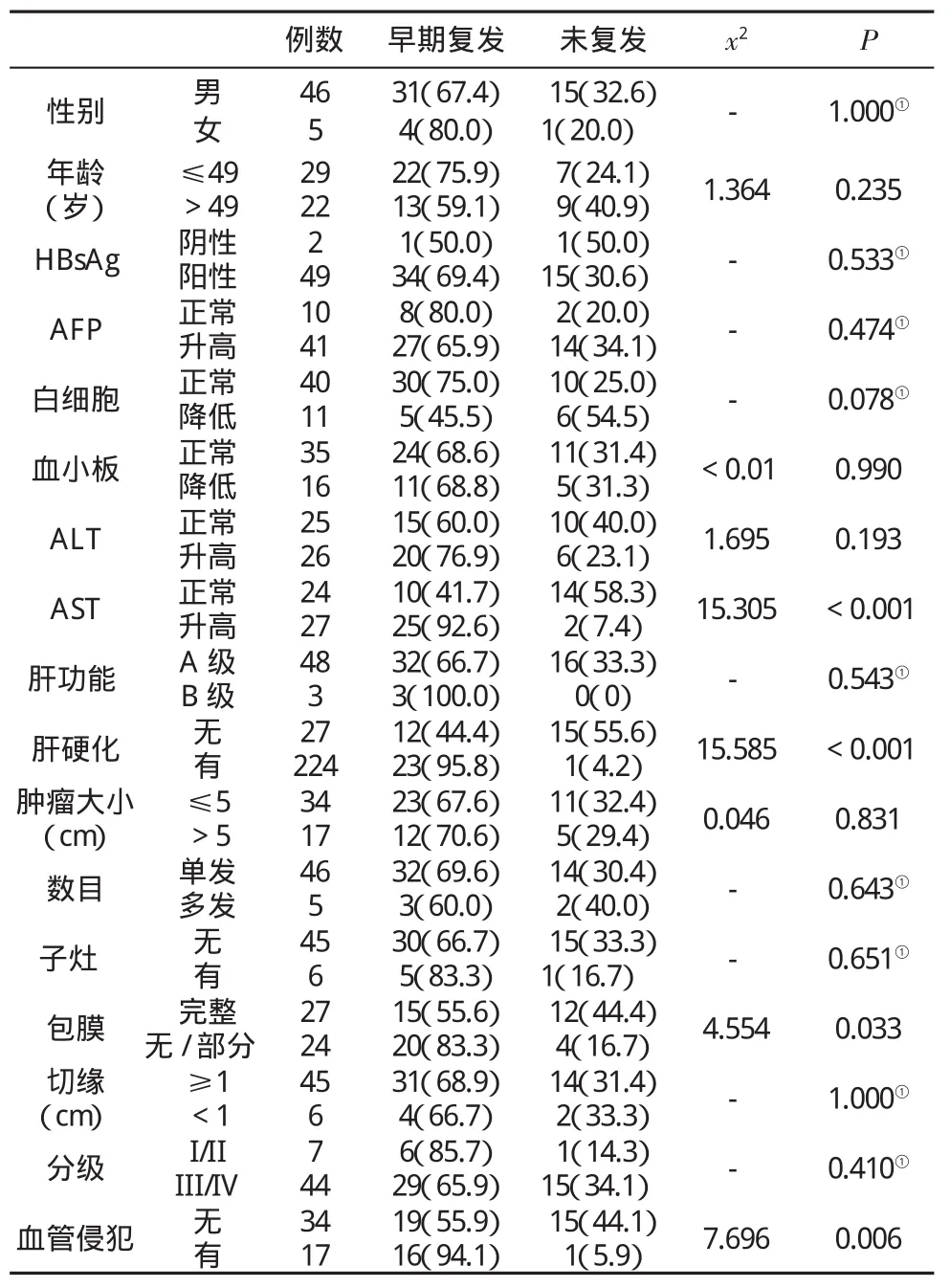
表1 51例PLC患者早期复发(%)的临床和病理学因素分析
2.2 早期复发的危险因素 采取Kaplan–Meier法分析,发现上述4项指标对DFS均有明显的影响,即血清AST升高、伴有肝硬化、肿瘤无包膜或仅有部分包膜和伴有血管侵犯的患者DFS更短(图1)。将此4项指标纳入Cox风险比例模型进行多因素分析,如表2所示,伴有肝硬化(P<0.001)、肿瘤包膜缺失(P=0.002)和伴有血管侵犯(P=0.027)是影响DFS的独立危险因素。

图1 Kaplan–Meier法绘制的生存曲线 提示AST正常(P=0.001)、无肝硬化(P<0.001)、包膜完整(P=0.021)和无血管侵犯者预后较好(P=0.005)

表2 多因素分析PLC患者手术后早期复发的独立危险因素
3 讨论
肝癌术后复发,尤其是早期复发是影响患者术后远期生存的主要因素[2]。术后早期复发时限通常认为是2年。在本研究中,我们从17项临床和组织病理学参数中筛选出4项与PLC早期复发相关的因素,即血清AST升高、伴有肝硬化、肿瘤包膜缺失和伴有血管侵犯的患者早期复发比例明显高于对照组。通过Kaplan-Meier法验证了这4项指标对PLC患者的DFS有明显的影响,Cox风险比例模型进一步筛选发现伴有肝硬化、肿瘤包膜缺失和伴有血管侵犯为PLC术后早期复发的独立危险因素。
肝硬化是 PLC早期复发的危险因素[2,4,5]。我国 PLC常常由于病毒性肝炎导致的肝硬化发展而来,即使通过手术将肿瘤完整切除,但是无法逆转病肝的功能,已经形成的肝硬化结节是PLC术后早期复发的巨大隐患。这种由肝硬化结节发展成的“复发肿瘤”可能不是真正意义上的复发,而是肿瘤再发,它不一定是由原发肿瘤的侵袭所致,因此有学者称之为多中心发生的复发(multicentric occurrence,MO)[6]。肿瘤伴有血管侵犯也是PLC术后早期复发的重要原因[2,7~9]。由于肿瘤侵犯微血管,肿瘤细胞沿血管播散并在肝脏定植,形成微小转移灶,在合适的时机生长形成复发。这种由肿瘤侵犯微血管造成的复发是由肿瘤的侵袭所致,更符合原发肿瘤的肝内复发转移(intrahepatic occurrence,IM)[4,6]。肿瘤包膜缺失是PLC术后早期复发的另一独立危险因素。肿瘤包膜的有无可以反映肿瘤的生长能力,肿瘤包膜完整提示其生长缓慢,侵袭能力较弱;包膜缺失提示肿瘤侵袭能力强,肿瘤向周边侵犯严重,更容易复发转移。
此外,血清AST升高对判断PLC术后早期复发的价值值得关注,虽然其并不是独立的危险因素,但生存曲线显示血清AST升高的患者DFS时间明显短于血清AST正常人群。国外研究小组报道过相似的发现[10],而国内尚未发现类似报道。
在本研究中,肿瘤大小、数目、有无子灶、切缘是否阳性和病理分级等因素与PLC早期复发无关,提示通过规范的手术操作,完整切除肿瘤可以减少部分肿瘤自身因素的不良影响,降低早期复发率。多家报道术前血清AFP升高能否提示早期复发结果不一,但血清AFP一直是术后随访的重要参考指标,其作用不可小视。此外,国内有相关文献报道肝门阻断次数[5]和术中术后输血[5,7]是PLC术后早期复发的不良因素,提醒外科医生在保证手术顺利和患者安全的前提下应尽量减少肝门阻断次数及术中术后输血量,或许可以减少PLC患者术后早期复发的风险。我们在以往研究的基础上结合我院病例情况分析了PLC术后早期复发的危险因素,发现肝硬化、肿瘤包膜缺失和血管侵犯是PLC术后早期复发的独立危险因素。
[1]Hoshida Y,Villan ueva A,Kobayashi M,et al.Gene expression in fixed tissues and outcome in hepatocellular carcinoma.N Engl J Med,2008,359:1995-2004.
[2]Portolani N,Coniglio A,Ghidoni S,et al.Early and late recurrence after liver resection for hepatocellular carcinoma:prognostic and therapeutic implications.Ann Surg,2006,243:229-235.
[3]Takayama T,Sekine T,Makuuchi M,et al.Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma:a randomised trial.Lancet,2000,356:802-807.
[4]Poon RT,Fan ST,Ng ⅠO,et al.Different risk factors and prognosis for early and late intrahepatic recurrence after resection of hepatocellular carcinoma.Cancer,2000,89:500-507.
[5]高明,龚瑾,曹明溶,等.原发性肝癌术后早期复发的相关因素.广州医学院学报,2011,39:86-92.
[6]Chen PJ,Chen DS,Lai MY,et al.Clonal origin of recurrent hepatocellular carcinomas.Gastroenterology,1989,96:527-529.
[7]欧迪鹏,杨连粤,黄耿文.肝细胞癌术后复发转移相关危险因素分析.中南大学学报(医学版)2005,30:540-543.
[8]潘金强,段永亮,肖红.小肝癌患者术后肝内早期复发的生存因素分析.中华肿瘤防治杂志,2011,18:1118-1120.
[9]Ⅰmamura H,Matsuyama Y,Tanaka E,et al.Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy.J Hepatol,2003,38:200-207.
[10]Ercolani G,Grazi GL,Ravaioli M,et al.Liver resection for hepatocellular carcinoma on cirrhosis:univariate and multivariate analysis of risk factors for intrahepatic recurrence.Ann Surg,2003,237:536-543.

