鸦胆子油注射液对H22细胞增殖的抑制作用及其机制探讨
宋艳丽,薛 瑞,吴 倩,张玉洁
鸦胆子是苦木科植物鸦胆子的成熟果实,出自于《本草纲目拾遗》,性味苦,寒,有毒,其能燥湿、解毒、杀虫,治疗痢疾,抗疟,扁平疣等[1]。鸦胆子油注射液是以鸦胆子仁石油醚提取物和精制大豆磷脂为原料制成的水包油型乳剂,研究发现其既有抗肿瘤作用还有免疫保护作用,联合放化疗治疗对机体免疫功能有促进作用,并可降低放化疗所伴随的毒性作用,提高患者的生活质量和对治疗的依从性[2~4]。有体外实验研究提示,鸦胆子油注射液可抑制膀胱癌、肺癌、食管癌和宫颈癌等细胞的增殖,并促进细胞凋亡[5,6],但对其作用机制方面的研究较少。本研究拟观察鸦胆子油注射液在体内外对H22肝癌细胞的抑制作用及其作用机制,为其临床应用提供依据。
1 材料与方法
1.1 细胞、动物与试剂 肝癌H22细胞由华中科技大学同济医学院提供;ICR小鼠,体质量(20±2)g,雌雄兼用,由襄阳医学院动物实验中心提供;胎牛血清(杭州四季青生物工程材料公司);RPMI 1640培养粉(Gibco公司);顺铂(江苏豪森药业股份有限公司);MTT和胰蛋白酶(Sigma公司);ELx800型酶联免疫检测仪(BIO-TEK公司);CO2孵箱(JOUAN公司);定量检测肿瘤坏死因子-α的酶联免疫试剂盒(上海森雄科技实业有限公司);检测125I-转化生长因子-α的放射免疫分析药盒(北京普尔伟业生物科技有限公司);其他试剂均为国产分析纯。
1.2 H22细胞增殖检测 采用MTT法,取对数生长期的H22细胞,常规消化、洗涤后,调整细胞浓度至1×105/ml,接种于96孔培养板中,于 5%CO2、37℃孵箱中培养24 h后,分别加入不同浓度的鸦胆子油注射液或顺铂各100μl,对照孔加入等容积的1640培养液,每组设6个复孔,培养48 h后按常规采用酶标仪(波长570 nm)测定各孔吸光度值(A)。按公式“(1-药物孔A值/对照孔A值)×100%”计算细胞抑制率。
1.3 荷H22移植瘤小鼠模型的建立 按文献[7]方法,用灭菌NS调整瘤细胞数至1×107/ml,计数活细胞数为98%以上可用。取ICR小鼠,除正常对照组外,其他组小鼠皆接种瘤细胞悬液0.2 ml于右腋窝皮下。在24 h后,随机分为荷瘤阴性对照组、5-Fu处理组和鸦胆子油处理组,每组10只。在正常对照组,给予生理盐水0.2 ml灌胃,1次/d;给予荷瘤小鼠5-Fu 25 mg·kg-1·d-1或鸦胆子油 12.5 mg·kg-1·d-1、25 mg·kg-1·d-1和 50 mg·kg-1·d-1腹腔注射,皆连续给药 10 d。于停药后次日,自小鼠眼球采血后,采用颈椎脱臼法处死小鼠,分别取肿瘤、脾脏和胸腺,称重。按以下公式计算抑瘤率和脏器指数:抑瘤率=(荷瘤组瘤质量-给药组瘤质量)/荷瘤组瘤质量×100%;脾脏指数=脾脏质量(mg)/体质量(g);胸腺指数=胸腺质量(mg)/体质量(g)。
1.4 脾细胞增殖检测[8]停药后次日颈椎脱臼处死小鼠,无菌操作条件下取出脾脏,剪碎,Hanks液洗涤,经200目铜网过滤,离心,去上清,加入2 ml双蒸水,滴管吹打30 s,立即加入1.8%氯化钠溶液2 ml,离心,去上清,再加入Hanks液洗涤,直至溶液无红色,即为各组脾细胞悬液。用含10%小牛血清的RPMI 1640培养液调整细胞数为1×107/ml,向脾细胞中加入Con A(或LPS),使ConA(或LPS)的终浓度为5μg/ml(或10μg/ml)。取上述细胞悬液200μl,加入96孔培养板,设只加ConA(或LPS)的对照孔。将培养板置于5%CO2、37℃饱和湿度的培养箱中培养48 h。在结束培养前4 h加入MTT,继续培养4 h后加入酸化异丙醇终止反应,振荡10 min使充分溶解,用酶标仪于570 nm处测定各孔的OD值。
1.5 动物血清细胞因子的测定 按照试剂盒说明书采用ABC-ELISA法测定TNF-α;采用放射免疫法测定TGF-α。
1.6 统计分析 采用Office 2007和SPSS15.0进行统计分析。计量资料以(±s)表示,多样本比较采用Dunnett检验,P<0.05为有统计学意义。
2 结果
2.1 对H22细胞增殖的抑制作用 鸦胆子油在10~160μg·ml-1浓度范围内对H22细胞的体外增殖具有抑制作用,并具有浓度依耐性(表1)。
表1 鸦胆子油对H22细胞增殖(±s,n=6)的抑制作用

表1 鸦胆子油对H22细胞增殖(±s,n=6)的抑制作用
与对照组比,①P<0.05
?
2.2 对荷瘤小鼠瘤质量的影响 在给予5-Fu(25 mg·kg-1)腹腔注射10 d后可明显抑制荷瘤小鼠的瘤质量,与模型组比具有非常显著性差异(P<0.05);在给予鸦胆子油 12.5 mg·kg-1、25 mg·kg-1和 50 mg·kg-1灌胃后,均可不同程度地减轻荷瘤小鼠的瘤质量,与模型组比均具有非常显著性差异(P<0.05,表2)。
表2 荷瘤小鼠瘤质量(g,±s,n=10)的变化

表2 荷瘤小鼠瘤质量(g,±s,n=10)的变化
与荷瘤动物比,①P<0.05
?
2.3 对荷瘤小鼠脾脏指数和胸腺指数的影响 荷瘤动物脾脏指数和胸腺指数增加,与正常对照组比,具有显著性差异(P<0.05),而5-Fu和三个剂量鸦胆子油处理对脾脏指数和胸腺指数的影响较小(表3)。
表3 荷瘤小鼠脾脏指数和胸腺指数(±s,n=10)的变化
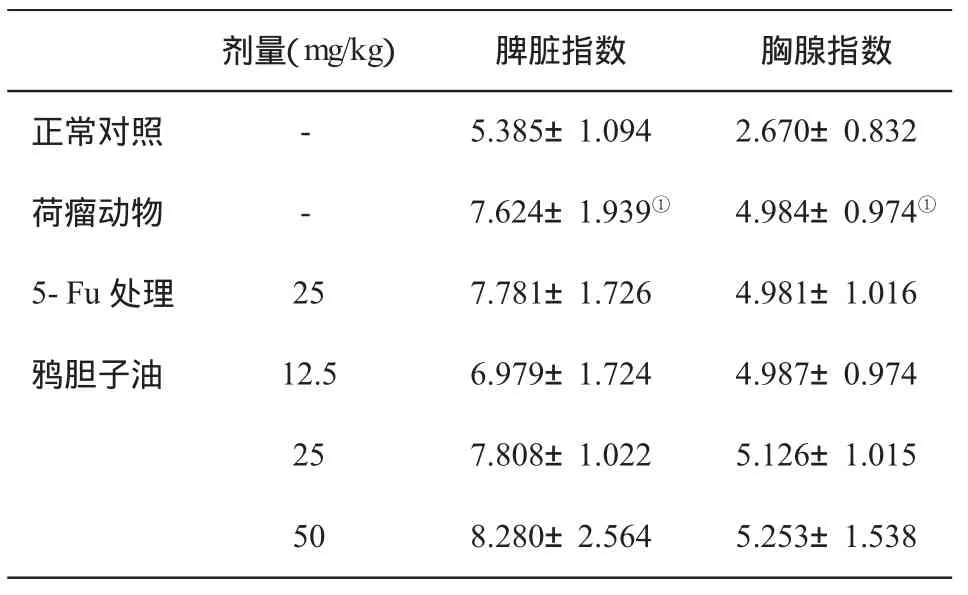
表3 荷瘤小鼠脾脏指数和胸腺指数(±s,n=10)的变化
与对照组比,①P<0.05
?
2.4 对荷瘤小鼠脾细胞增殖的影响 与对照组比,荷瘤动物脾细胞增殖受到抑制(P<0.05);与荷瘤动物比,在5-Fu腹腔注射后脾细胞增殖水平仍然低下;与荷瘤动物比,鸦胆子油体内给药可促进脾细胞增殖(P<0.05,表4)。
表4 荷瘤小鼠脾细胞增殖(OD值,±s,n=6)的变化
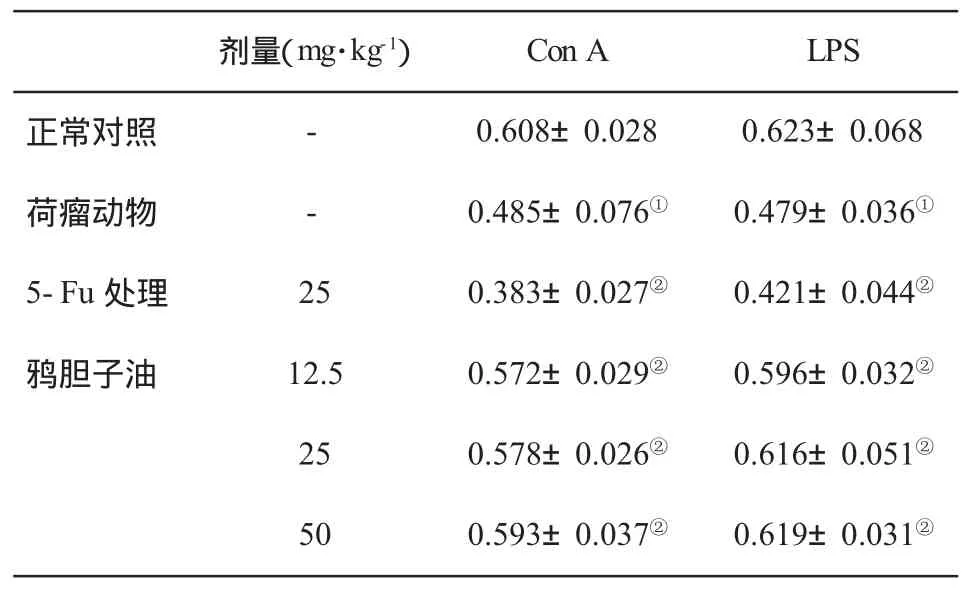
表4 荷瘤小鼠脾细胞增殖(OD值,±s,n=6)的变化
与对照组比,①P<0.05;与荷瘤动物比,②P<0.05
?
2.5 对荷瘤小鼠血清TNF-α和TGF-α水平的影响 见表5。
表5 荷瘤小鼠血清TNF-α和TGF-α水平(±s,n=6)的变化
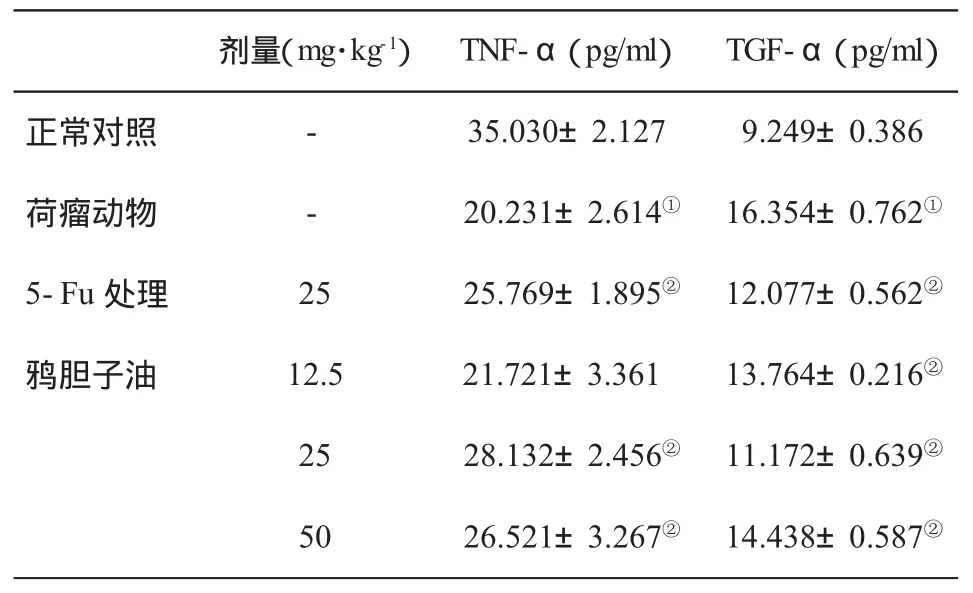
表5 荷瘤小鼠血清TNF-α和TGF-α水平(±s,n=6)的变化
与对照组比,①P<0.05;与荷瘤动物比,②P<0.05
?
3 讨论
中成药鸦胆子油注射液已广泛应用于临床治疗各种恶性肿瘤,其主要的活性成分为不饱和脂肪酸-油酸和亚油酸[9]。鸦胆子油中的油酸和亚油酸与肿瘤细胞膜具有特异的亲和力,有很强的抗癌活性[10]。鸦胆子油乳主要成分油酸能抑制拓扑异构酶活性,从而抑制细胞DNA的合成,阻断癌细胞的增殖[11]。鸦胆子油还可选择性破坏癌细胞和线粒体等膜性系统,使癌细胞变性坏死,而对正常细胞无损害;其对肿瘤细胞具有靶向性,用药后药物浓度浓集,并与癌细胞具有特异性的紧密亲和力[12]。本研究结合MTT实验以及建立荷瘤模型小鼠观察鸦胆子油注射液对H22细胞增殖的影响,结果表明鸦胆子油体内外均可抑制肝癌H22细胞的增殖,与对照组相比皆具有显著性差异,且具有浓度依赖性。
肿瘤的发生、发展、预后与人体的免疫功能密切相关,免疫系统作为机体的第一道防线,在恶性转化细胞的识别和清除过程中发挥着重要作用[13]。机体在发生肿瘤后,免疫系统可通过多种方式对肿瘤细胞发生应答,并清除肿瘤细胞[14,15]。在机体抗肿瘤防御中,T淋巴细胞介导的细胞免疫和B淋巴细胞介导的体液免疫共同发挥着重要作用。脾细胞富含T、B淋巴细胞,在ConA等因素刺激下可增殖分化,参与免疫应答。本研究观察到,给予鸦胆子油注射液灌胃给药10天后,可明显促进由Con A和LPS分别诱导的荷瘤小鼠淋巴细胞增殖,显示其具有免疫促进作用,但是对脾脏指数和胸腺指数的影响较小。
TNF-α属肿瘤坏死因子家族,由单核-巨噬细胞、NK细胞、T细胞分泌,能够激活T淋巴细胞、刺激机体产生抗体和细胞因子,直接杀伤肿瘤细胞而对机体正常细胞无明显毒害作用;也可通过抑制肿瘤血管生成等间接途径杀伤肿瘤细胞;还可诱导许多不同来源肿瘤细胞的凋亡,可作为肿瘤复发、转移的标记物及鉴定肿瘤预后的一项指标[16,17]。TGF-α为表皮生长因子家族成员之一,在多种肿瘤中过度表达。TGF-α可与表皮生长因子受体(EGFR)结合,级联激活MAPK信号系统,促使DNA合成,从而促使细胞增殖和分化,使肿瘤细胞的生长不受机体的控制,使细胞增殖失控,从而发生癌变[18,19]。TGF-α表达减弱可以加速肝癌细胞凋亡,而其表达增强则会抑制肝癌细胞凋亡。本研究结果显示,荷瘤模型小鼠血清TNF-α水平明显降低,TGF-α水平明显升高,说明小鼠荷瘤以后其免疫功能受到抑制,而在给予鸦胆子油注射液灌胃给药后,荷瘤小鼠血清TNF-α水平显著升高,而TGF-α水平明显降低,提示鸦胆子油可通过促进血清TNF-α表达或/和抑制TGF-α表达,从而增强荷瘤机体的免疫功能。
综上所述,鸦胆子油体内外均可抑制肝癌H22细胞的增殖,还可提高机体的免疫功能,其调节免疫功能的作用与促进T、B淋巴细胞增殖、上调TGF-α水平以及下调TNF-α水平有关,可能还有其他作用机制,尚需进一步研究。
[1]路广秀,范洁宇,马瑞莲.鸦胆子临床新用及研究进展,内蒙古医学院学报,2012,34(5):423-427.
[2]蔡树华,张东成,李化龙.全身热疗联合奥沙利铂治疗中晚期原发性肝癌近期疗效观察.实用肝脏病杂志,2012,15(5):451-452.
[3]吴玉昌.鸦胆子油乳注射液联合放疗治疗鼻咽癌的疗效分析.亚太传统医药,2009,5(6):95-96.
[4]尹绍成,石文建,赵喜庆,等.鸦胆子油乳注射液对C6胶质瘤细胞作用的实验研究.中国神经肿瘤杂志,2012,10(1):10-13.
[5]路广秀,范洁宇,马瑞莲.鸦胆子临床新用及研究进展.内蒙古医学院学报,2012,34(5):423-427.
[6]潘镏镏,万小洁,章圣辉,等.鸦胆子油乳对宫颈永生化细胞体外增殖和凋亡的作用,中国妇幼保健,2013,28:834-837.
[7]甄汉深,周燕园,袁叶飞,等.青天葵活性部位的体内抗肿瘤作用研究.中药材,2007,30(9):1095-1098.
[8]李丽,冯俊,王朝莉,等.小鼠B7-H4慢病毒表达载体的构建及对脾细胞增殖的影响.中国免疫学杂志,2012,28:200-204.
[9]胡美薇,张越峰,姚国丽.鸦胆子油乳抑制人白血病多药耐药K562/VCR细胞株增殖的实验研究,浙江实用医学,2012,17(5):315-317.
[10]贾勇士,吴树强,吕世良,等.鸦胆子油乳加放射治疗中晚期食管癌的临床分析. 中国中药杂志,2008,33(17):2174-2176.
[11]张宏胜.鸦胆子油乳注射液联合化疗对食管癌术后患者免疫功能的影响. 海军医学杂志,2007,28(1):31-33.
[12]潘镏镏,万小洁,章圣辉,等.鸦胆子油乳对宫颈永生化细胞体外增殖和凋亡的作用.中国妇幼保健,2013,28:834-837.
[13]王慰,任桂芳,刘玉珍,等.慢性乙型肝炎患者外周血T淋巴细胞亚群的变化.实用肝脏病杂志,2012,15(4):346-347.
[14]Kuss Ⅰ,Hathway B,Ferris RL,et a1.Decreased absolute counts of T lymphocyte subsets and their relation to disease in squamous cell carcinoma of the head and neck.Clin Cancer Res,2004,10(11):3755-3762.
[15]葛金华,曾祥铨,连豫苞.阿德福韦酯治疗HBeAg阳性慢性乙型肝炎患者外周血T细胞亚群的变化.实用肝脏病杂志,2012,15(6):566-567.
[16]Kruglov AA,Kuchmiy A,Grivennikov SⅠ,et a1.Physiological functions of tumor necrosis factor and the consequences of its pathologic overexpression or blockade:Mouse models.Cytokine Growth Factor Rev,2008,19:231-244.
[17]陈学彰,田华琴,黄志庆,等.肺积方对Lewis肺癌小鼠抑瘤率及EGFR、TNF-α 表达的实验研究. 中西医结合研究,2013,5(1):17-20.
[18]Kikuehi K,Li XH,Zheng Y,et a1.Ⅰnvasion of breast cancer cells into collagen matrix requires TGF-α and Cdc42 signaling.FEBS Lett,2011,585(2):286-290.
[19]Kobayashi K,Kusakabe M,Okada M,et al. Ⅰmmunohistochemical localization of transforming growth factor alpha in chemically induced rat hepatocellular carcinomas with reference to differentiation and proliferation.Toxicol Pathol,2000,28:664-667.

