三种品系小鼠对伴刀豆球蛋白A所致急性肝损伤的耐受性比较研究*
于慧杰,盛国光
成功建立肝损伤动物模型是探究肝炎发生机制及其治疗药物的重要工具[1,2]。1992年,Tiegs用伴刀豆球蛋白A(Con A)建立了较为接近自身免疫性肝病及病毒性肝炎免疫损害的肝损伤模型[3],被认为是适合研究人类病毒性肝炎和自身免疫性肝病等肝脏疾病的合适模型[4]。免疫性肝炎动物模型的病理改变及肝细胞损伤机制均与病毒性肝炎相类似,免疫性肝炎通常由生物性因素等引起,常见的原因为病毒感染,如临床上HBV、丙型肝炎病毒等病毒的感染,其重要的特征是肝组织内大量的炎细胞浸润,产生免疫/炎症应答,导致免疫反应为基础的肝损伤,即为免疫性肝炎。免疫性肝炎是肝纤维化、肝硬化乃至肝脏肿瘤等终末病变发生发展的重要因素之一[5]。
与其他肝损伤模型如四氯化碳模型、卡介苗加脂多糖(BCG+LPS)模型相比,ConA所建立的肝损伤模型被认为更适合用来进行病毒性肝炎、自身免疫性肝病等病理机制的研究。且用ConA建立肝损伤模型具有操作简便,无需提前致敏的特点,因此目前在建立肝损伤模型时ConA更为常用[6]。虽然目前已有学者对ConA不同用量或使用不同品系小鼠建立的肝损伤进行过探讨[7],但对于ConA的建模应用剂量并没有统一的标准,且存在造模药物干预时间不一致,实验结果差异大等问题。本文以C57BL/6J小鼠、BABL/c小鼠和KM小鼠三种常用品系的实验小鼠作为研究对象,观察了几种常用造模剂量的ConA造成的肝损伤情况,现报道如下。
1 材料与方法
1.1 动物与试剂 雄性KM小鼠、BABL/c小鼠和C57BL/6J小鼠各50只,4~5周龄,体质量18~22 g,由武汉大学动物实验中心提供【许可证号:SCXK(鄂)2008-0004】。实验动物由湖北省中医院实验动物中心饲养,恒温恒湿,标准饲料,自由饮水。ConA(IV型,100mg/支,批号80M7680V)购于Sigma公司。检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)试剂盒购于南京建成生物工程研究所(批号依次为 20120410、20120412)。
1.2 急性肝损伤模型的制备 根据Con A的用量分为5组,每组30只,三种品系的小鼠各10只。A组为空白对照组;B组应用Con A 6mg.kg-1;C组为Con A 12 mg.kg-1;D组为 Con A 20 mg.kg-1;E组为 Con A 30 mg.kg-1。在实验开始时,A组小鼠经尾静脉注射生理盐水,其余各组小鼠分别通过尾静脉注射不同剂量的Con A。在经尾静脉注射8 h后,摘眼球取血,室温静置30 min,3000 r/m,离心15 min,分离血清。按试剂盒说明测定血清ALT和AST水平。脱颈椎处死小鼠,各组小鼠取肝组织,在4℃生理盐水中漂洗,除去血液,滤纸拭干,称取肝组织和脾组织,称质量后计算脏器指数。其中肝指数=肝质量(g)/体质量×100%,脾指数=脾质量(g)/体质量×100%。取部分肝组织,置入4%中性多聚甲醛中固定,石蜡包埋、制成4μm连续切片后,固定在玻片上,行常规HE染色,在光学显微镜下观察肝组织病理学改变。以小鼠肝组织出现病理学改变和血清ALT水平超过正常值上限2倍以上作为造模成功的标准。
1.3 统计方法 采用SPSS 17.0统计学软件进行数据处理和统计分析,数据以(±s)表示,各组数据进行正态分布分析和方差齐性检验,采用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况 在尾静脉注射前各组小鼠一般情况较好,毛发光泽度较好,进食、饮水正常,活动度好。在尾静脉注射后,A组小鼠和B组小鼠活动度未见明显异常;C组BABL/c小鼠和C57BL/6J小鼠分别出现2只死亡,其余小鼠出现精神萎靡,活动减少,蜷卧、抱团;在D组KM小鼠中死亡1只,BABL/c小鼠死亡4只,C57BL/6J小鼠死亡5只,未死亡小鼠出现精神萎靡,活动减少,蜷卧、抱团,竖毛;E组KM小鼠死亡3只,7只未死亡小鼠出现精神萎靡,蜷卧、抱团,活动减少,竖毛。BABL/c小鼠和C57BL/6J小鼠全部死亡。
2.2 不同ConA用量动物血清转氨酶及肝脾指数的变化 见表1。
2.3 肝组织病理学变化 A组小鼠肝脏组织未见明显异常,在HE染色中肝细胞浆均匀红染,细胞核大小正常,核质淡染,肝窦清晰可见,肝索排列整齐;B、C、D、E组肝组织均出现不同程度的病变,肝板排列紊乱,呈气球样变或嗜酸性变,可见明显的点状坏死,灶性坏死甚至大片状坏死,肝组织内大量淋巴细胞浸润,尤其是汇管区少量淋巴细胞、粒细胞存在,肝窦内大量红细胞淤积,肝板消失。血管周围的肝细胞胞浆疏松,染色变浅,肝窦间隙明显增宽,肝索消失,有的还可见点状坏死、淋巴细胞、中性粒细胞浸润,见图1~4。
表1 各组不同品系小鼠血清转氨酶及肝脾指数(±s)的变化
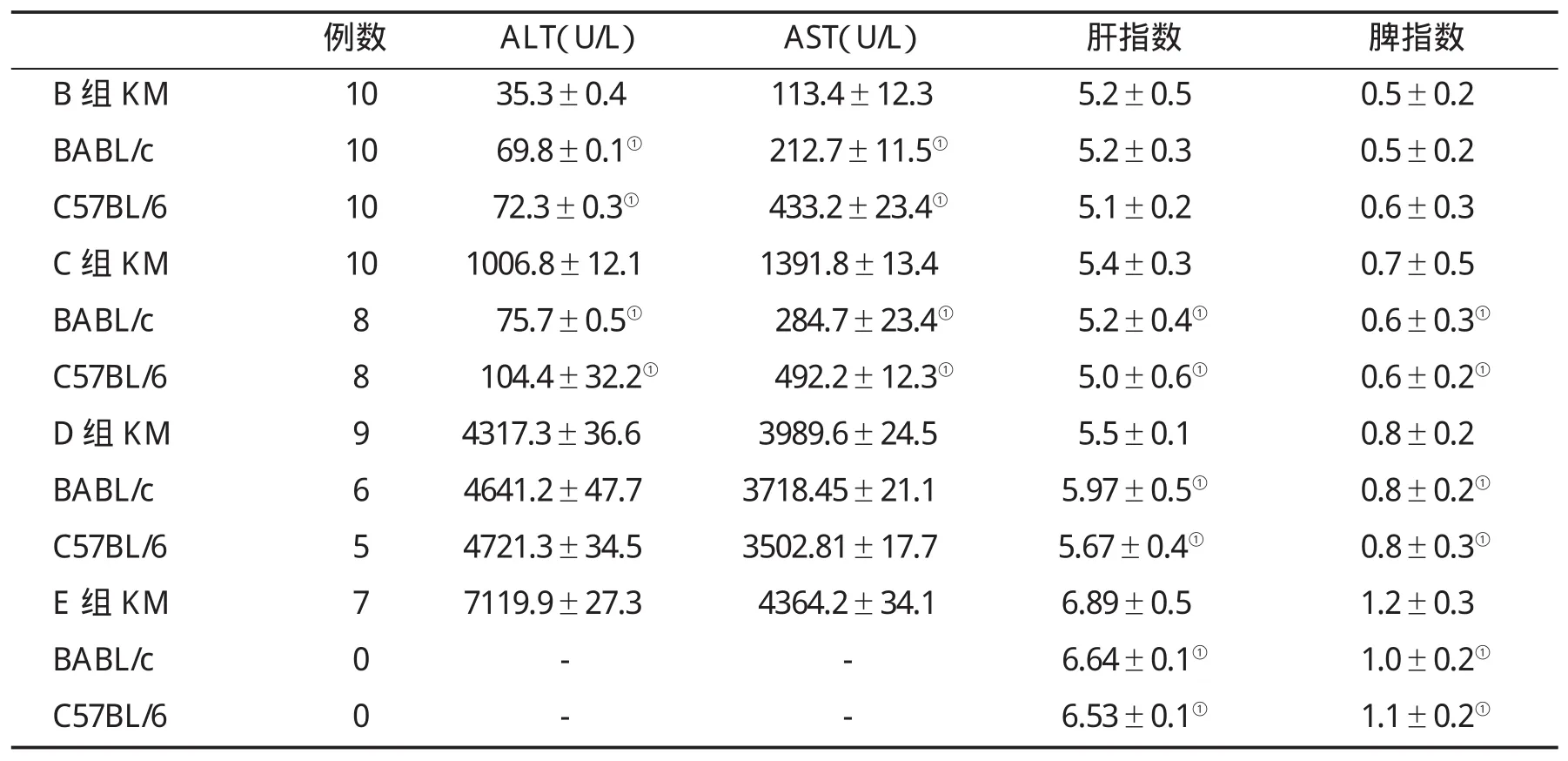
表1 各组不同品系小鼠血清转氨酶及肝脾指数(±s)的变化
与同组KM小鼠比,①P<0.05
?

图1 肝组织病理学表现 KM小鼠在注射ConA 6 mg·kg-1后,可见肝组织汇管区炎细胞浸润,肝细胞肿胀,呈气球样变(HE,400Χ)

图2 肝组织病理学表现 KM小鼠在注射ConA 12 mg·kg-1后,可见炎细胞浸润,肝细胞肿胀,呈气球样变,片状坏死(HE,400Χ)

图3 肝组织病理学表现 KM小鼠在注射ConA 20 mg·kg-1后,可见肝板消失,肝细胞排列紊乱,肝细胞形态消失,炎细胞浸润,肝组织出现淤血(HE,400Χ)

图4 肝组织病理学表现 KM小鼠在注射ConA 30mg·kg-1后,可见肝板消失,肝细胞排列紊乱,肝细胞形态消失,炎细胞浸润,淤血进一步加重(HE,400Χ)
3 讨论
ConA是从JACK豆中提取出的一种植物蛋白质,是一种T细胞丝裂原,也是一种可以与多种细胞表面糖分子残基结合的蛋白分子[8],在pH中性的条件下以四聚体的形式存在,分子量为104000。ConA诱导的免疫性肝损伤模型适合研究病毒性肝炎的病理学发病机制和保护肝损伤药物的研究。现代医学研究表明,自身免疫性肝病、病毒性肝炎等所致的肝损害均与T淋巴细胞的活化密切相关[9]。ConA可作为有丝分裂刺激原,激活T淋巴细胞、巨噬细胞等释放多种细胞因子,从而引起肝损伤[10]。国外有研究报道小鼠静脉注射ConA 8~12小时可引起明显的急性肝损害[11],故本次实验研究选择尾静脉注射8小时后进行观察。
ConA诱导的肝损伤能够模拟免疫相关肝病时T细胞依赖免疫反应,其特点是由CD4+T细胞增多所介导的免疫损伤[12]。尾静脉注射ConA能够引起以辅助性T细胞和巨噬细胞为主要效应细胞的特异性肝损伤[13],其作用机制为:肝窦内存在大量的巨噬细胞,激活后产生细胞因子可直接损伤肝细胞;其次,大量活化T淋巴细胞存在于脾脏,并产生细胞因子(如TNF-α、IL-2、INF-γ等),T细胞与细胞因子随血液运行到肝脏,与肝细胞接触或进一步激活巨噬细胞,破坏血管内皮细胞,导致肝损伤[14]。
本研究结果表明,Con A引起的肝脏损伤主要表现为肝脏和脾脏质量增加、淤血,血清转氨酶(ALT和AST)水平急剧升高。ConA剂量越大,转氨酶上升越高。当肝细胞有实质性损害时,可因肝细胞坏死、细胞膜通透性增加,细胞内相应的酶释放入血,故血中酶活性增高。肝组织出现大面积灶状坏死,肝脏、脾脏体积增大,故ConA干预的各组肝脾指数均高于对照组。
该实验还可以看出在此肝损伤模型中,脾病变可能先于肝脏,与李敏等[15]提出的“脾内活化的T淋巴细胞随血流到达肝脏,直接或进一步激活巨噬细胞,产生细胞因子引起的损伤”相吻合。
遗传体质是药物代谢和效应的决定性因素[16],在异卵双生子中香豆素半衰期的变异程度比同卵双生子高6~22倍。遗传多态性药物代谢酶、转运蛋白和受体的遗传多态性是导致药物反应差异的重要原因。遗传多态性是一种孟德尔单基因性状,由同一基因位点上具有多种等位基因引起,并由此导致多种表型。
中医学理论认为,体质是由遗传或获得性因素所决定的表现在形态结构、生理机能和心理活动方面综合的相对稳定的特质。体质的差异在很大程度上决定着疾病的发生、发展、变化[17]。陈小野等[18]通过观察4种小鼠的寒、热体质发现,KM、BABL/c、C57BL/6J三种小鼠寒性体质存在差异:在4~5周龄时昆明小鼠体质明显偏热;BALB/c小鼠与C57BL/6J小鼠体质偏寒。体质因素可能也是造成不同品系小鼠对ConA反应差异的原因之一。
当然,也不排除因小鼠品系不同,不同品系小鼠的正常参考值也存在差异的情况,此前胡建武等[19]对ICR小鼠、C3H小鼠、KM小鼠等10种常见的SPF级实验大、小鼠血液学及生化指标的正常参考值进行了探讨,虽然未包括BABL/c小鼠和C57BL/6J小鼠,但就ALT、AST两项指标看,10种常用实验用鼠间存在一定的差异。本实验设置空白对照组,观察未用ConA处理的三个品系的小鼠血清转氨酶的变化,结果它们之间的差异无统计学意义。
由本实验我们可以得出以下结论,当同一药物作用于不同品系的实验动物时,其结果可能由于动物品系的不同而产生差异,因此在建立实验模型选择实验动物时应当慎重。尤其在使用转基因动物或基因敲除等价格较为昂贵的实验动物进行实验研究时,应尽量采用品系相同的动物进行相关预实验,以避免因品系不同造成的实验结果的差异。
[1]张锦雀.肝损伤动物模型研究进展.福建医科大学学报,2009,43(1):86-88.
[2]黄正明,杨新波,曹文斌,等.化学性及免疫性肝损伤模型的方法学研究. 解放军药学学报,2005,21(1):42-46.
[3]Tiegs G,Hentschel J,Wendel A.A T cell dependent experimental liver injury in mice inducible by concanavalin A.J Clin Ⅰnvest,1992,9(10):196-203.
[4]张引强,唐旭东,王凤云,等.荣肝合剂对ConA诱导急性免疫性肝损伤小鼠的保护作用. 中医杂志,2010,51(5):453-455.
[5]胡水清,黄依雯,秦伟,等.Con A诱导小鼠肝损伤模型的发病机制. 中国血液流变学杂志,2007,17(1):159-162.
[6]黄凯,杨新波,陈红艳,等.两种急性免疫性肝损伤小鼠模型的对比研究. 中国比较医学杂志,2009,19(11):31-34.
[7]茹仁萍,吴锡铭,朱幸芳.小鼠慢性免疫性肝损伤模型建立与筛选. 医学研究通讯,2005,13(12):31-33.
[8]Yang MC,Chang CP,Lei HY.Endothelial cells are damaged by autophagic induction before hepatocytes in Con A-induced acute hepatitis.Ⅰnt Ⅰmmunol,2010,22:661-670.
[9]Watanabe Y,Morita M,Akaike T.Concanavalin A induced perforin mediated but not Fas-mediated hepatic injury.Hepatology,1996,24:702-710.
[10]Kaneko Y,Harada M,Kawano T,et al.Augmentation of Valpha14 NKT cell-mediated cytotoxicity by interleukin 4 in an autocrine mechanism resulting in the development of concanavalin A-induced hepatitis.J Exp Med,2000,191:105-114.
[11]Nakamoto Y,Kaneko S.Mechanisms of viral hepatitis induced liver injury.Curr Molec Med,2003,3(6):537-544.
[12]刘光伟,王春芳,王灵台,等.健脾清化方抗ConA诱导的肝损伤免疫学机制探讨.中国实验方剂学杂志,2010,16,(15):164-165.
[13]Chang CP,Lei HY.Autophagy induction in T cell-independent acute hepatitis induced by concanavalin A in SCⅠD/NOD mice.Ⅰnt J Ⅰmmunopathol Pharmacol,2008,21:817-826.
[14]胡水清,黄依雯,秦伟,等.ConA诱导小鼠肝损伤模型的发病机制. 中国血液流变学杂志,2007,17(1):159-162.
[15]李敏,李卫东.ConA引起小鼠肝损伤实验研究.中国比较医学杂志,2008,18(7):13-15.
[16]杨宝峰.药理学.7版,北京.人民卫生出版社,2008:38.
[17]孙广仁.中医基础理论.北京:中国中医药出版社,2002:198-212.
[18]陈小野,张宇鹏,张晓娟,等.4种小鼠的寒、热体质研究.现代中西医结合杂志,2005,14(16):2107-2110.
[19]胡建武,卢胜明,车路平,等.10种常见SPF级实验大、小鼠血液学及生化指标正常参考值的探讨.实验动物科学,2007,24(2):5-10.

