己酮可可碱对小鼠酒精性肝病酒精代谢酶和核受体PPAR-α的影响*
屈耀宁,董 蕾,史海涛,秦 斌,刘亚萍
因大量饮酒导致的酒精性肝病(alcoholic liver disease,ALD)在西方国家是导致死亡的主要疾病之一[1]。在我国,ALD的发病也呈逐渐增长的趋势。据调查,1982年我国成人嗜酒者为0.21%,1991年北京市16个县区调查结果为14.3%,2000年浙江地区调查结果为14.8%,西安地区饮酒者占35.1%[2]。乙醇在肝内通过细胞质乙醇脱氢酶(alcohol dehydrogenase,ADH)、微粒体细胞色素 P4502E1(CYP2E1)和过氧化物酶代谢,其中ADH和CYP2E1是乙醇代谢的主要酶类[3]。乙醇在肝内代谢主要通过胞浆中ADH途径和内质网的微粒体乙醇氧化系统(MEOS)途径,生成乙醛,再经过乙醛脱氢酶生成乙酸,代谢为水和二氧化碳。在MEOS途径中CYP2E1活化产生的活性氧基团(ROS)是损伤肝脏的主要原因之一[4]。过氧化物酶增殖物激活受体(peroxisome proliferator-activated receptor alpha,PPAR-α)是近年来广泛研究的调控脂肪酸转化和氧化的核转录因子[5],能有效地调控炎性因子的表达及氧化应激反应,参与酒精性肝损伤的发展过程并发挥关键性作用。目前,关于己酮可可碱(pentoxifylline,PTX)对ALD的治疗作用研究已有报道,但大多仅限于临床观察,很少涉及作用机制方面的研究。为了进一步探讨PTX对ALD的防治作用,我们制备了酒精诱导的C57BL/6小鼠ALD模型,检测小鼠血清 ADH、CYP2E1酶活性和肝组织 ADH、CYP2E1、PPAR-α mRNA水平,以及肝组织CYP2E1和PPAR-α蛋白表达,以探讨PTX对ALD的作用。
1 材料与方法
1.1 动物 SPF级雌性C57BL/6小鼠64只,体质量(20±4)g,由我校动物中心提供。室温保持在(22±2)℃,相对湿度为65%,按正常昼夜节律调整光照时间。
1.2 急性酒精性肝损伤模型的制备 取28只小鼠,随机分为模型组、治疗组和正常组,每组8~10只。治疗组动物提前7天给予PTX(Sigma公司 P1784-10G)100 mg·kg-1体质量腹腔注射,1次/d;模型组和正常组动物给予等量0.9%生理盐水腹腔注射。7天后,给予模型组和治疗组动物50%乙醇12 ml·kg-1体质量灌胃,q12h,连续3次[6];给予正常组等量5%葡萄糖溶液灌胃。在灌胃结束后,随机处死模型组动物2只,取肝组织行病理学检查。在光镜下见肝小叶大量炎细胞浸润,并有空泡和肝细胞坏死,证明模型建立成功。
1.3 慢性酒精性肝炎模型的制备 取36只小鼠,随机分为模型组、小剂量、大剂量治疗组和正常组,每组8~10只。分别给予治疗组动物PTX 50 mg·kg-1体质量和150 mg·kg-1体质量腹腔注射,1次/d,给予模型组和正常组等量0.9%生理盐水腹腔注射。2 h后,给予模型组、小剂量和大剂量治疗组动物10%乙醇10 ml·kg-1体质量灌胃,1次 /d,1周后,给予20%乙醇 10 ml·kg-1体质量灌胃,1次 /d,参考文献[7],给予正常组等量5%葡萄糖溶液灌胃,造模及给药时间均为6周。6周后,随机处死模型组动物2只,行病理学检查证明模型建立成功。造模及给药结束后,小鼠禁食不禁水12 h,眼球采血,分离血清,保存于-20℃。采取脱臼法处死小鼠,取肝脏右叶于无菌冻存管,经液氮罐转移至-80℃冰箱保存。取肝左叶置于甲醛液中固定,行病理学检查。
1.4 血清ADH和CYP2E1活性测定 采用比色法检测(南京建成科技有限公司提供试剂,批号A083-1 GMS18021.1)。
1.5 肝组织 ADH、CYP2E1和 PPAR-α mRNA水平测定 取肝组织块各约5 mg,用试剂盒RNAfast200(上海飞捷生物技术有限公司 Catalog no.220010)提取总RNA,采用反转录试剂盒(TaKaRa Biotechnology)反转录为cDNA。由北京鼎国昌盛生物技术公司设计并合成引物(表1)。mRNA水平和对照组无明显差异(P>0.05);在急性和慢性酒精性肝炎小鼠肝组织CYP2E1 mRNA水平明显增高,与对照组相比有显著性差异(P<0.01),而治疗组比模型组明显降低(P<0.01);在急性酒精性肝炎、治疗组和对照组小鼠肝组织PPAR-α mRNA水平无显著性差异(P>0.05),慢性酒精性肝炎小鼠肝组织PPAR-α mRNA水平降低,与对照组相比有统计学意义(P<0.05,图1、2)。

表1 引物序列
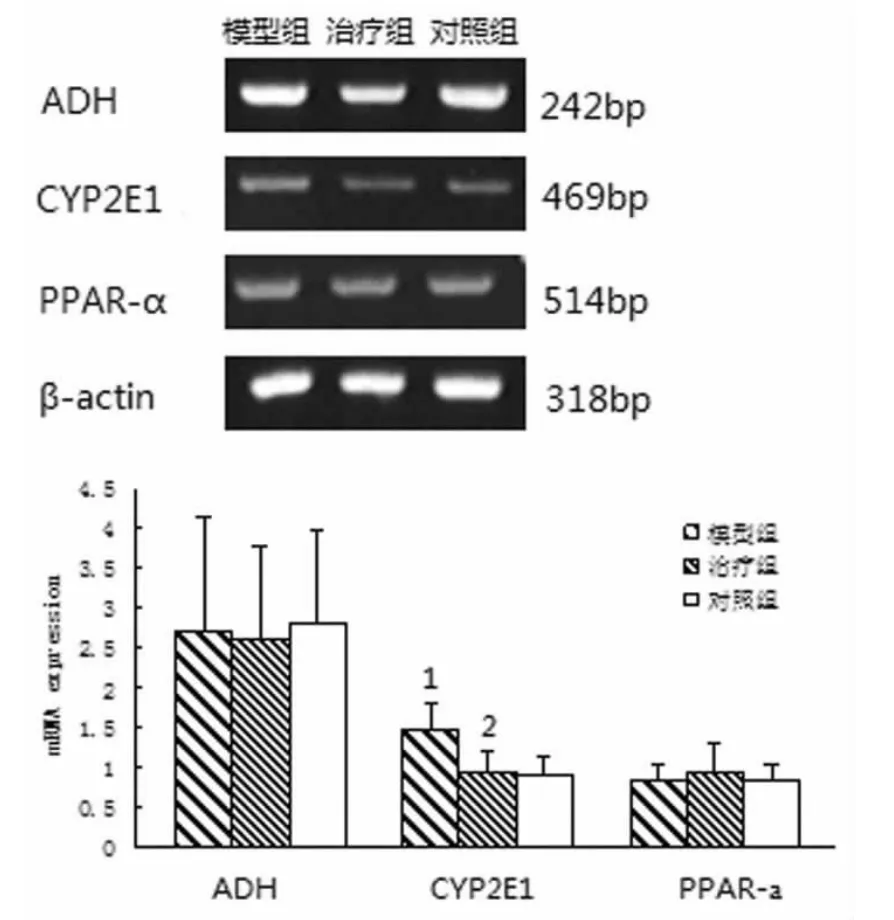
图1 急性肝损伤小鼠肝组织ADH、CYP2E1和PPAR-αmRNA水平
1.6 肝组织CYP2E1和PPAR-α蛋白表达检测 采用免疫组化法。经过脱蜡、抗原修复、封闭、加一抗(1:100,博士德生物 BA1774 BA1691),4°过夜,加二抗(中杉金桥SP-9000/9001/9002),显色,苏木素复染、封片。阳性染色细胞为胞浆和/或胞膜出现黄褐色物质。
1.7 统计学处理 采用SPSS18.0统计学软件,计量资料以(±s)表示,组间比较采用方差分析,P<0.05为有统计学差异,P<0.01为有显著性统计学差异。
2 结果
2.1 小鼠血清ADH和CYP2E1活性变化 见表2。
表2 各组小鼠血清ADH和CYP2E1活性(U/ml,±s)比较

表2 各组小鼠血清ADH和CYP2E1活性(U/ml,±s)比较
与对照组比,①P<0.05;②P<0.01
数量 ADH CYP2E1急性肝炎 811.2±1.612.2±1.8①治疗组 811.5±1.28.1±1.5对照组 812.5±1.27.9±1.4慢性肝炎 85.8±1.4① 11.8±1.7②小剂量PTX 86.9±2.6② 10.2±1.5大剂量PTX 84.6±1.77.8±1.5①对照组 84.3±0.66.5±1.2
2.2 肝组织 ADH、CYP2E1和 PPAR-α mRNA水平变化 急性和慢性酒精性肝炎小鼠肝组织ADH

图2 慢性酒精性肝炎小鼠肝组织ADH、CYP2E1和PPAR-αmRNA水平
2.3 肝组织CYP2E1和PPAR-α蛋白表达变化 采用Image-Pro Plus6.0图像处理软件计算阳性细胞表达量,结果在急性和慢性酒精性肝炎动物肝组织CYP2E1阳性细胞表达数比对照组明显增多[分别为(765±21)对(308±12)和(682±25)对(305±18),P<0.01],而大剂量治疗组分别为(521±18)和(418±12),显著低于模型组(P<0.01);急性和慢性酒精性肝炎动物肝组织PPAR-α阳性细胞表达比对照组明显减少[分别为(322±15)对(721±18)和(262±23)对(689±14),P<0.01],而大剂量治疗组分别为(548±20)和(725±19),显著高于模型组(P<0.01,图3、4、5和 6)。

图3 急性肝损伤小鼠肝组织CYP2E1蛋白表达 阳性细胞主要位于胞浆,分别呈弥漫或散在分布(SP,40×)A:模型组;B:治疗组;D:对照组

图4 急性肝损伤小鼠肝组织PPAR-α蛋白表达 阳性细胞主要位于胞核,分别呈弥漫或散在分布(SP,40×)A:模型组;B:治疗组;D:对照组

图5 慢性酒精性肝炎小鼠肝组织CYP2E1蛋白表达 阳性细胞主要位于胞浆,分别呈弥漫或散在分布(SP,40×)A:模型组;B:小剂量治疗组;C:大剂量治疗组;D:对照组
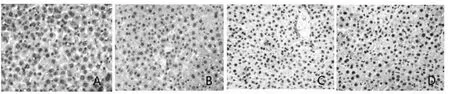
图6 慢性酒精性肝炎小鼠肝组织PPAR-α蛋白表达 阳性细胞主要位于胞核,分别呈弥漫或散在分布(SP,40×)A:模型组;B:小剂量治疗组;C:大剂量治疗组;D:对照组
3 讨论
PTX为甲基黄嘌呤化合物,是一种磷酸二酯酶抑制剂[8],可提高细胞内c-AMP水平。因改善血流变、扩血管、改善细胞缺氧、抗炎、抗氧化和调节免疫等作用[9],已被证实能预防和改善肝纤维化、肺纤维化、脂肪肝、脑缺血。目前,关于PTX对ALD的作用已有报道,比如疗效的观察等[10~12],研究表明,PTX确实可以改善ALD患者病情,但对其具体作用机理的研究尚未见报道。我们推测PTX改善ALD的机制可能与ADH无关。
国内外大量研究已经证实,CYP2E1的活化在ALD的发生发展中有着极其重要的作用[13]。
CYP2E1的活化是乙醇导致酒精性肝损伤和肝纤维化的原因[14]。Zanelli等证实,乙醇能够延缓CYP2E1的降解[15]。MEOS是乙醇代谢的另一重要途径,当肝组织中乙醇浓度超过10 mmol/L时,MEOS被激活并对乙醇代谢起主要作用。乙醇在体内代谢产生大量ROS,通过传递电子,氧化大分子物质,引起肝细胞脱氧核糖核酸损伤、蛋白质和脂质氧化损伤[16]。实验中模型组CYP2E1 mRNA和蛋白水平均明显增高,而治疗组显著降低,表明CYP2E1是ALD的一种损伤性蛋白。我们推测,PTX可能减少了乙醇代谢过程中ROS的产生。
PPAR是一类能被配体激活的核转录因子[17],目前已知有三种亚型,即α、β和γ,在各种组织中表达不同[18]。PPAR-α高表达于线粒体丰富和β氧化活性高的组织。PPAR-β高表达于脂肪组织,PPAR-γ几乎均低表达于各种组织[19]。PPAR-α是近年来广泛研究的调控脂肪酸转化和氧化的核转录因子[20],还可以调节炎症反应和免疫反应等。大量文献证明PPAR-α缺失或降低会导致肝脏脂肪变和炎症反应。细胞学实验表明,乙醛能够抑制PPAR-α与其DNA和某些配体的结合能力。实验中乙醇暴露后,小鼠肝脏PPAR-α蛋白水平显著降低,PTX治疗增加了PPAR-α蛋白的表达水平,并且在长期乙醇暴露后PPAR-α mRNA水平也降低。这一结果表明,PPAR-α是ALD的一种保护性蛋白,且PTX改善ALD的作用与其对PPAR-α的活化有关。我们推测,PTX可能因其抗氧化作用减少了乙醛的生成量,并且削弱了酒精对PPAR-α及某些脂肪氧化酶表达的抑制,从而阻止了ALD的发生和发展。
[1]宫嫚,罗生强,张宁,等.酒精性肝病的发病机制研究进展.临床荟萃,2013,23(3):350-352.
[2]厉有名.中国酒精性肝病的研究现状.现代消化及介入诊疗,2007,14(4):235-236.
[3]卿笃信.酒精代谢酶与酒精性肝病的关系研究进展.国外医学(生理、病理科学与临床分册),2003,24(3):310-313.
[4]Leung TM,Nieto N.CYP2E1 and oxidant stress in alcoholic and non-alcoholic fatty liver disease.J Hepatol,2013,58(2):395-398.
[5]Crabb DW,Galli A,Fischer M,et al.Molecular mechanisms of alcoholic fatty liver:role of peroxisome proliferator-activated receptor alpha.Alcohol,2004,34(1):35-38.
[6]齐慧慧,宋佳,陈岳祥.小鼠急性酒精性肝损伤模型的建立.世界华人消化杂志,2012,21(9):759-763.
[7]Anji A,Kumari M.Supplementing the liquid alcohol diet with chow enhances alcohol intake in C57 BL/6 mice.Drug Alcohol Depend,2008,97(1-2):86-93.
[8]鲁琼.己酮可可碱药理作用研究新进展.中国社区医师(医学专业),2012,12(5):13.
[9]Mendes JB,Campos PP,Rocha MA,et al.Cilostazol and pentoxifylline decrease angiogenesis,inflammation,and fibrosis in sponge-induced intraperitoneal adhesion in mice.Life Sci,2009,84(15-16):537-543.
[10]林雅.己酮可可碱治疗重症酒精性肝炎的疗效观察.海峡药学,2011,8(11):102-103.
[11]Zhu H,Jia Z,Misra H,et al.Oxidative stress and redox signaling mechanisms of alcoholic liver disease: updated experimental and clinical evidence.J Dig Dis,2012,13(3):133-142.
[12]Liu X,Bastian S,Snow CD,et al.Structure-guided engineering of lactococcus lactis alcohol dehydrogenase LlAdhA for improved conversion of isobutyraldehyde to isobutanol.J Biotechnol,2012,164(2):188-195.
[13]Wang Y,Millonig G,Nair J,et al.Ethanol-induced cytochrome P4502E1 causes carcinogenic etheno-DNA lesions in alcoholic liver disease.Hepatology,2009,50(2):453-461.
[14]Vidali M,Stewart SF,Rolla R,et al.Genetic and epigenetic factors in autoimmune reactions toward cytochrome P4502E1 in alcoholic liver disease.Hepatology,2003,37(2):410-419.
[15]Zanelli U,Longo V,Paolicchi A,et al.Stabilization of cytochrome P4502E1 protein by ethanol in primary hamster hepatocyte cultures.Toxicol Ⅰn Vitro,2000,14(1):69-77.
[16]Martin CG,Agapito VV,Obeso A,et al.Moderate ethanol ingestion,redox status,and cardiovascular system in the rat.Alcohol,2011,45(4):381-391.
[17]张晓燕,陈丽红,管又飞.PPAR家族及其与代谢综合征的关系. 生理科学进展,2005,25(1):6-12.
[18]Kong L,Ren W,Li W,et al.Activation of peroxisome proliferator activated receptor alpha ameliorates ethanol induced steatohepatitis in mice.Lipids Health Dis,2011,10:246.
[19]Zeng T,Zhang CL,Song FY,et al.Garlic oil alleviated ethanol-induced fat accumulation via modulation of SREBP-1,PPAR-alpha,and CYP2E1.Food Chem Toxicol,2012,50(3-4):485-491.
[20]Galli A,Pinaire J,Fischer M,et al.The transcriptional and DNA binding activity of peroxisome proliferator-activated receptor alpha is inhibited by ethanol metabolism.A novel mechanism for the development of ethanol-induced fatty liver.J Biol Chem,2001,276(1):68-75.

