乙型肝炎病毒相关肝硬化的临床诊断、评估和抗病毒治疗的综合管理*
科技部十二五重大专项联合课题组专家
1 背景
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是肝硬化的重要原因。研究显示,有效抑制HBV复制可改善肝纤维化[1,2],延缓或阻止代偿期肝硬化向失代偿期的进展,减少失代偿期患者病情进一步恶化,减少门静脉高压及相关并发症发生[3-6],延长生存期[3,4]。因此,有效的抗病毒治疗对改善疾病临床结局具有重要意义[7],也是目前HBV相关肝硬化整体治疗策略中的一个重要组成部分。近年来,我国、亚太、欧洲和美国肝病学会更新的慢性乙型肝炎诊治指南或共识,都明确指出应该给予HBV相关肝硬化患者积极、有效的抗病毒治疗。然而目前各国指南或共识中提出的抗病毒治疗意见比较简单,难以完全满足临床实践的需求。为此,我们组织国内有关专家,系统总结国内外研究进展,按照循证医学原则,制订本共识,旨在帮助临床医生对HBV相关肝硬化进行规范化的临床诊断、评估和抗病毒治疗,使更多患者获益。
2 流行病学
HBV相关肝硬化是慢性HBV感染的重要临床结局。据世界卫生组织(WHO)估算,2002年全球死于肝硬化的患者中约30%为HBV相关肝硬化[8]。总体而言,慢性HBV感染进展为肝硬化的5年累积发生率约为8%~20%。一项包括684例慢性乙型病毒性肝炎(chronic hepatitis B,CHB)患者的前瞻性研究显示,肝硬化的年发病率约为2.1%,持续HBeAg血清阳性者更高,达到3.5%[9]。
持续高病毒载量是发生肝硬化的主要危险因素,与肝硬化累积发生率呈正相关,可独立预测肝硬化发生。慢性HBV感染者易进展为肝硬化的其他危险因素尚包括:免疫状态(反复或持续的免疫清除)、男性、年龄>40岁、嗜酒、合并丙型肝炎病毒(hepatitis C virus,HCV)、丁型肝炎病毒(hepatitis D virus,HDV)或人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染等[10-14]。西方研究提示基因D型较A型更易导致疾病进展[15],而亚洲研究则认为基因C型风险更大[16,17]。有关HBV基因型与疾病进展的确切关系尚需进一步研究来证实。
3 自然史
病毒复制在HBV相关肝硬化患者中较为普遍。有研究发现,至少30%-70%的HBV相关代偿期肝硬化患者,体内有活跃的病毒复制。两项来自欧洲的研究显示,35%-55%的代偿期肝硬化患者HBeAg阳性,48%的患者HBV DNA阳性,而治疗后出现HBeAg血清转换或HBV DNA低于检测下限者预后较好[12,18]。HBsAg滴度与预后的相关性尚不明确。代偿期肝硬化进一步进展可导致失代偿期肝硬化和原发性肝癌(hepatocellular carcinoma,HCC)的发生。
失代偿期肝硬化通常是代偿期肝硬化隐匿进展的结果,一些诱发因素可导致病情进展[19]。约14%代偿期肝硬化患者因乙型肝炎急性发作而导致失代偿发生[20],表现为肝硬化急性失代偿。因此,失代偿期肝硬化可表现为慢性肝衰竭或慢加急性肝衰竭。每年约有2%-5%的代偿期患者进展为失代偿期;20%的代偿期肝硬化患者在确诊后5年内进展为失代偿期,而10年后则高达60%[21,22]。病毒复制与否与进展为失代偿期密切相关。肝硬化有HBV复制证据者的肝脏失代偿的年发病率为4%,显著高于无HBV复制者(1%)[20]。此外,合并其他嗜肝病毒感染也是促进失代偿发生的重要原因。
HBV相关肝硬化患者的中位生存期为10-12年。一旦进展为失代偿,患者常出现因门静脉高压导致的食管胃底静脉曲张破裂出血、腹水、脾功能亢进、肝性脑病、肝肾综合征等并发症,死亡风险明显增加[23]。代偿期和失代偿期肝硬化患者的5年生存率分别为84%和14%[24]。来自亚洲的回顾-前瞻队列研究显示,102例失代偿期肝硬化患者中,22例在平均13个月的随访中死亡,死亡原因包括肝肾综合征(32%)、静脉曲张破裂出血(23%)、HCC(28%)、肝衰竭(9%)和肝性脑病(9%)[23]。仅少量研究探讨了HBeAg状态对生存率的影响,但两者间并未建立明确关联。尚无研究专门评估基线HBV DNA水平对患者生存的预测作用。因此,病毒血症在肝硬化失代偿期的预后作用尚需进一步研究。
HCC是HBV相关肝硬化的重要临床结局,无论代偿期和失代偿期肝硬化都有进展为HCC的风险。肝硬化本身就是发生HCC的最重要危险因素。HCC的其他危险因素包括:老年、男性、肝病严重程度、ALT水平、随访期间病毒复制活跃、病毒基因型、病毒突变、HCV或HDV重叠感染、饮酒和黄曲霉素暴露等。台湾的队列研究显示,在调整年龄、性别、吸烟、饮酒、HBeAg状态及血清ALT水平等因素后,基线HBV DNA>10000拷贝/ml是HCC发生的最强独立预测因子[25]。但早年的小样本研究认为,HBV DNA水平或HBeAg状态与 HCC的发生不相关[26-28]。因此,肝硬化患者基线病毒载量和持续病毒复制在HCC发生中的作用仍需进一步研究阐明。
4 临床诊断和评估
HBV相关肝硬化是CHB发展的结果,其诊断过程包括临床诊断及评估,完整的诊断包括病因学、代偿/失代偿状态以及并发症情况。
4.1 临床诊断 建立HBV相关肝硬化临床诊断的必备条件,包括:1、组织学或临床提示存在肝硬化的证据;2、病因学明确的HBV感染证据。其他常见引起肝硬化的病因如HCV感染、酒精、药物等也需通过病史或相应的检查予以明确或排除。
4.1.1 存在肝硬化的证据 肝硬化临床诊断过程中需综合考虑包括临床表现、实验室检查、组织学、影像学及组织病理学诸多依据。肝组织活检可提供肝纤维化分期的重要信息,肝组织学中弥漫性肝纤维化伴假小叶形成,是肝硬化组织病理学诊断的金标准[30]。
代偿期肝硬化与慢性肝炎的临床、实验室检查特征很难鉴别。需要肝组织活检才能确诊。在缺乏组织学证据的情况下,代偿期肝硬化的临床诊断应综合依据肝脏生化(如白蛋白降低、胆红素升高)、血液学(如白细胞、血小板计数和凝血酶原活动度降低)、影像学(如肝脏边缘不规则、肝实质颗粒样、门静脉内径增宽、脾脏增大等)、内镜检查(如食管胃底静脉曲张、门脉高压性胃病等)和非创诊断技术等。
由于肝组织活检存在一定风险,且单个肝组织活检标本不一定能全面反映肝脏整体纤维化程度[32],因此,近年来发展了多项非创诊断技术用于评估肝纤维化,包括测定肝脏硬度的影像学技术、血清学标志和各类评分系统等[32-34]。肝脏硬度测定对判别有无肝纤维化和有无肝硬化有一定临床价值,可避免部分患者肝组织活检,中国人群中如检测值高于14.1 kPa[34],可作为肝硬化诊断时的参考,但实践中应注意排除血清转氨酶、胆红素等其他因素对检测值的影响[35-41]。
失代偿期肝硬化常伴有腹水、食管胃底静脉曲张、肝性脑病等并发症,常规影像学技术如MRI、CT、超声显像等也可发现典型的肝硬化及门静脉高压征象[31],结合实验室检查和临床症状体征,临床易做出诊断。
4.1.2 存在HBV感染的证据 慢性HBV感染是HBV相关肝硬化病因学诊断的重要依据。HBsAg阳性史超过6个月,且目前HBsAg和(或)HBV DNA仍为阳性者,可诊断为慢性HBV感染,包括慢性乙型肝炎、慢性HBV携带者/慢性非活动性HBsAg携带者、隐匿性慢性乙型肝炎[29]。
4.2 临床评估 HBV相关肝硬化的临床和病毒学特点在首次诊断时各不相同。在慢性乙型肝炎随访期间得以诊断的肝硬化,被认为接近于肝硬化发病或相对早期阶段;而以其他方式得以诊断的肝硬化,其确切发病时间则很难确定。因此,在建立诊断的同时应进行最初评估,在治疗随访阶段应定期进行后续评估。全面的评估至少包括:病毒复制状况、肝脏功能及代偿能力、并发症情况和HCC的筛查等。
4.2.1 病毒复制状况评估 病毒学指标HBV DNA是临床评估和监测乙肝病毒复制情况的重要指标,可反映病毒的复制水平,用于慢性HBV感染的诊断、抗病毒治疗适应证的选择及疗效的判断[29]。不同检测方法和试剂,灵敏度和可检测的范围不尽相同,如国产试剂的检测下限常为500~1000拷贝/ml,而进口试剂的PCR法则可检测到51-65拷贝/ml。HBV DNA定量检测值可以IU/ml或拷贝/ml表示,1 IU相当于3-6拷贝。检测值越高,提示更多的病毒在体内复制;但阴性或低于检测下限,并不一定意味着无病毒复制。初始治疗后的1-3个月检测一次,以后每3-6月应定期检测HBV DNA,以评估病毒复制的情况、抗病毒治疗的疗效。血清学指标 HBsAg、抗 -HBs、HBeAg、抗 -HBe、抗 -HBc和抗 -HBc IgM可适时检测,但不必过于频繁。
为准确评估病毒复制状况,如条件许可,应尽可能在质控严格、检测方法成熟的条件下,采用国际公认的高灵敏度和较大检测范围的检测方法,避免假阳性或假阴性结果。
4.2.2 肝脏功能及其代偿能力的评估 诊断HBV相关肝硬化时,可同时根据下述方面对患者的肝脏功能及其代偿能力做出准确评估,以了解患者目前的肝病进展属于代偿期或失代偿期,并对其预后、可能的死亡风险做出评估。
4.2.2.1 肝脏生化学指标 肝脏生化学指标中的ALT和AST等血清酶学指标升高并不能反映肝脏的特定功能受损或障碍,仅能作为提示肝损伤的标志,反映肝细胞损伤程度。
生化学指标中的胆红素水平、凝血酶原时间(PT)及凝血酶原活动度(PTA)、白蛋白和胆碱酯酶的明显异常,通常反映肝脏的部分功能受损或障碍,如排泄功能和合成功能。疾病进展,出现慢加急性(亚急性)肝衰竭和慢性肝衰竭时,上述生化学指标可显著异常并进行性加重。出现血清总胆红素≥171μmol/L或每日上升≥17.1μmol/L、胆酶分离现象、PTA进行性降至40%以下等,为肝衰竭征象,提示死亡风险增加、预后不良。
4.2.2.2 吲哚氰绿(ICG)试验 ICG试验可反映肝脏储备功能,通常以注射后15 min血中ICG潴留率(ICGR15)或ICG最大清除率作为衡量肝储备功能的指标。其对外科手术的选择、手术时机的确定有重要参考价值,有学者认为ICGR15是HCC患者术前肝储备功能评估的最佳指标[42]。
4.2.2.3 Child-Pugh分级 Child-Pugh分级是常用的评估肝脏储备功能的工具,可反映病情的严重程度,见表1。Child-Pugh评分最初用于评估酒精性肝硬化伴静脉曲张破裂出血患者的门体分流术后死亡风险,可预测术后1年生存率及术后并发症的风险,但无法很好预测长期死亡风险。根据评分,可将肝硬化分为 A(5-6分)、B(7-9分)、C(≥10分)三级。通常,代偿期肝硬化一般属Child-Pugh A级,而失代偿期肝硬化则属 Child-Pugh B-C级[43]。诊断时的Child-Pugh分级与1年生存期密切相关,有研究提示肝硬化患者Child-Pugh A、B、C级的 1年生存率分别为100%、80%、45%[44,45]。
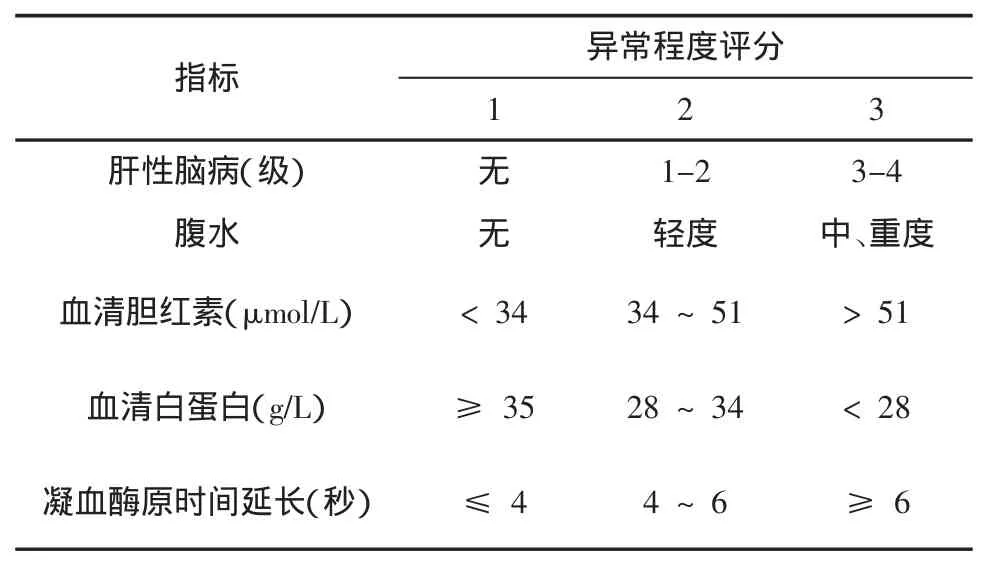
表1 Child-Pugh分级
4.2.2.4 MELD模型 终末期肝病模型(model for end-stage liver disease,MELD)可有效预测终末期肝病的死亡风险[44,45],其计算公式为:R=3.8×ln[胆红素(mg/dl)]+11.2×ln(INR)+9.6ln[肌酐(mg/dl)]+6.4×(病因:胆汁性或酒精性 0,其他1)。R值越高提示病情越严重,生存率越低。MELD评分最初用于评估经颈静脉肝内门体分流术患者的短期死亡风险,2002年后在美国用于评估各种病因肝硬化患者的3个月死亡风险。由于可准确评估终末期肝病的病情严重程度和近期的死亡风险,在等待肝移植的候选者中,MELD评分决定着器官分配的顺序。近年发展的MELD-Na模型也对终末期肝病的病情严重程度评估和预测死亡风险有重要价值。
4.2.3 并发症评估 肝硬化门静脉高压是导致食管胃底静脉曲张破裂出血、腹水、肝性脑病、肝肾综合征等严重并发症的重要原因。代偿期肝硬化患者一般无并发症,而一旦出现上述并发症,则提示已进入失代偿期[29]。Arvaniti将肝硬化分为5期 (图1):1期和2期属代偿期肝硬化,而3-5期属失代偿期肝硬化;1、2、3、4、5期一年的死亡率分别为 <1%、3%-4%、20%、50%、>60%[46]。并发症的出现与肝硬化患者预后和死亡风险密切相关。因此,临床实践中应密切监测并发症的状况,一旦出现,应按相应的诊疗指南进行干预,以降低死亡风险。
4.2.4 HCC的筛查 HBV感染和肝硬化都是HCC发生的高危因素,因此,对HBV相关肝硬化患者即使HBV DNA检测不出,也应筛查HCC。可采用血清甲胎蛋白(AFP)和肝脏超声进行常规筛查。对年龄≥35岁的男性、有HBV和/或HCV感染、嗜酒、有HCC家族史的高危人群,每6个月进行一次筛查。对AFP>400μg/L而超声检查未发现肝脏占位者,在排除妊娠、活动性肝病和生殖腺胚胎源性肿瘤等其他可引起AFP增高的因素后,应作CT和/或MRI等检查。如AFP升高未达到诊断水平,除排除上述可能引起AFP增高的因素外,还应密切追踪AFP的动态变化,将超声筛查间隔缩短至1-2个月,必要时进行CT和/或MRI检查;若高度怀疑HCC,可考虑DSA肝动脉碘油造影检查[47],但应注意,DSA检查也可能会出现假阳性或假阴性结果。

5 HBV相关肝硬化的抗病毒治疗
5.1 治疗目标 总体治疗目标是通过长期最大限度地抑制HBV,阻止疾病进展,延缓和减少失代偿期肝硬化、HCC或死亡等终点事件的发生,提高生活质量,延长生存时间[22]。代偿期肝硬化抗病毒治疗的首要目标是阻止或延缓肝功能失代偿和HCC的发生;失代偿期肝硬化抗病毒治疗的首要目标是维护或改善残存的肝脏功能,降低或延缓肝硬化并发症和HCC的发生,减少或延缓肝移植的需求[48]。
5.2 治疗指征 肝硬化患者因具有进展至终末期肝病或肝细胞癌的风险,建议早期即开始抗病毒治疗,尤其是失代偿期肝硬化[24]。
5.2.1 代偿期肝硬化 决定是否开始治疗的唯一因素是HBV DNA水平,与ALT水平无关。中国“慢性乙型肝炎防治指南 (2010年版)”(下文简称为“中国指南”)对HBeAg状况进行了区分,HBeAg阳性者和阴性者的治疗指征分别为HBV DNA≥104拷贝/ml和≥103拷贝/ml,事实上对HBeAg阴性者降低了抗病毒治疗的阈值。2012年EASL指南建议“只要HBV DNA可测,即使ALT正常,需考虑治疗”[97]。从指南的发展来看,提倡尽早、积极的抗病毒治疗。
5.2.2 失代偿期肝硬化 失代偿期肝硬化患者只要HBV DNA可检出,应尽早开始抗病毒治疗。中国指南提出对此类患者的抗病毒治疗建议在知情同意的基础上。HBV DNA检测不出时,建议用国际公认的高灵敏方法复查以确认是否存在HBV复制。失代偿期患者当肝脏功能严重受损时才开始抗病毒治疗,可能已无法显著降低死亡风险,应考虑肝移植[49-51]。
5.3 抗病毒治疗药物及选择 目前的抗病毒药物包括α干扰素(IFNα)和核苷(酸)类似物两类。HBV相关肝硬化患者抗病毒治疗药物的选择,应综合考虑可能的获益、安全性风险、耐药风险和经济状况等。
5.3.1 IFNα 早年研究提示,IFNα治疗可改善代偿期肝硬化患者的组织学,肝功能失代偿的发生率<1%[52,53]。而对Child-Pugh B级或C级的失代偿期患者,IFNα治疗并未见受益,且有引起肝功能恶化、增加细菌感染的风险[52,54]。因此,对失代偿期肝硬化患者,IFNα是禁忌证,应寻求其他替代治疗[48,55]。目前尚缺乏聚乙二醇干扰素(PEG-IFN)治疗肝硬化人群的相关研究。
IFNα是否应用于代偿期肝硬化的抗病毒治疗,目前尚有争议。2011年意大利指南建议肝硬化患者慎用PEG-IFN,应仅限用于代偿良好、既往无任何失代偿史、无门静脉高压、无禁忌证、HBV DNA<2000000 IU/ml、ALT升高的年轻肝硬化患者,且在治疗过程中需对应答情况及安全性进行仔细监测[56]。也有学者认为,对代偿期患者干扰素治疗应十分慎重,如有必要,宜从小剂量开始,并根据患者情况逐渐增加到预定治疗剂量[55,57]。但这在临床实践中仍会面临不少难题,如起始的小剂量应该为多少?小剂量是否会获得预期的获益?
因此,考虑到IFNα的不良反应、耐受性及可能引发的肝功能失代偿等问题,对代偿期肝硬化患者应非常慎重,必须全面评估可能的风险/获益,才能做出治疗决策。IFNα禁用于失代偿期肝硬化患者。
5.3.2 核苷(酸)类似物 核苷(酸)类似物包括拉米夫定(LAM)、阿德福韦酯(ADV)、恩替卡韦(ETV)、替比夫定(LdT)和替诺福韦酯(TDF)。前4者已在我国上市多年,TDF也在最近获得国家食品药品监督总局(CFDA)的批准。
著名的4006研究是一项里程碑式的随机双盲安慰剂对照临床试验,它首次证实有效的抗乙肝病毒治疗(口服LAM 3年)能够延缓进展期肝纤维化和代偿期肝硬化患者的疾病进展,并可减少HCC的发生[58]。但高耐药率使其远期获益受到影响,故不适合长期单药治疗。
对3项临床研究中的1633例患者(245例患者为进展期肝纤维化/肝硬化)分析后发现,服药48周后,恩替卡韦组在HBeAg阳性、HBeAg阴性和LAM耐药患者中的组织学肝纤维化改善率分别为为57%、59%和43%,均显著高于对照LAM组[59]。一项回顾性队列研究显示,与未接受抗病毒治疗患者相比,接受恩替卡韦治疗患者的肝硬化并发症、HCC和肝脏相关死亡风险等终点事件显著减少[95]。
在失代偿期肝硬化患者中开展的随机对照临床研究显示,TDF不仅可以有效抑制HBV复制,而且可以改善Child-Pugh及MELD评分[81]。
事实上,包括LAM、ADV、ETV、LdT和TDF的大量研究均表明,核苷(酸)类似物治疗肝硬化患者,不仅可获得病毒学、血清学、生化学应答和组织学改善,而且可延缓疾病进展,改善肝脏功能及晚期肝病的严重程度,提高生存率,延长等待肝移植患者术前存活时间或减少肝移植的需求[60-81,96]。
两种核苷(酸)类抗病毒药物初始联合是否获益更多,研究结论不一[69,70,82-85]。目前尚无足够的证据显示初始联合治疗比采用高效低耐药的单药治疗更有效。考虑到在严重失代偿期患者中初始联合可能增加肝脏对多种药物的代谢负担,增加安全性隐患和多药耐药的潜在风险,因此,初始联合治疗应慎重。
失代偿期肝硬化患者应用核苷(酸)类似物能否降低HCC发生风险尚存争议,延长抗病毒治疗时间能否有效降低HCC发生,尚有待大队列的长期研究阐明[86,87]。
总之,目前的证据表明,核苷(酸)类似物适用于HBeAg阳性或阴性的代偿期或失代偿期患者。长期抗病毒治疗可阻止疾病进展,改善HBV相关肝硬化患者的临床结局[3,22]。美国的数据显示,自2000年起,由于核苷(酸)类似物的应用,HBV相关肝衰竭患者需进行肝移植的数量明显下降。
亚太、美国及欧洲肝病学会的指南均推荐高效低耐药的ETV和TDF作为治疗HBV相关肝硬化患者的首选或优先考虑药物[9,89,97]。中国指南也指出,对HBV相关肝硬化患者,只要条件允许,尽可能选择高效低耐药药物治疗[29]。考虑到肝硬化患者长期治疗的需要,因此,本共识推荐,在条件许可的条件下,建议首选或优先选用强效和低耐药的药物如ETV、TDF的单药长期治疗。
5.4 安全性监测 抗病毒治疗过程中需高度关注抗病毒药物的安全性。定期监测抗病毒药物治疗的不良反应,评估获益/风险,对保障患者在整体治疗中的利益最大化具有重要意义。
线粒体毒性是口服核苷(酸)类似物的共性安全性隐患,各核苷(酸)类似物的毒性靶器官不尽相同[90]。LAM的安全性总体较好,但耐药发生率相对较高,曾有报道出现横纹肌溶解。ADV的肾脏毒性需要关注,代偿期患者连续应用4-5年后肾脏毒性的发生率为3%,等待肝移植和移植后患者的发生率更高[70,88],每3个月监测血清肌酐和血磷水平是必要的,需要时可更频繁[89]。ETV总体耐受性良好且耐药发生率较低[74],动物研究中曾有肺部良性肿瘤的报道,但未在人体研究及应用中证实;有报道ETV治疗基线MELD评分≥22的HBV相关肝硬化患者中出现乳酸酸中毒,其风险与疾病严重性(高MELD评分)相关[91],因此,在高MELD评分肝硬化患者的抗病毒治疗过程中,发生乳酸酸中毒的风险可能增高,应密切监测。LdT引起肌病(包括横纹肌溶解)、中枢及外周神经系统的安全问题和相对较高的耐药发生率,是临床应用的顾虑。TDF最常见的不良反应主要是胃肠道反应,也有报道引起低磷血症及骨代谢异常[92,93],此外,在HIV感染患者中已有肾毒性的报道,因此,应定期监测肾功能。
总之,核苷(酸)类似物的线粒体毒性可产生全身系统性病变,包括肌病、肾毒性、神经病变、胰腺炎、脂肪肝、巨红细胞症、高乳酸血症、乳酸酸中毒等。因此,应定期严密监测CPK、肾功能、血磷、淀粉酶等指标,一旦出现肌病、肾毒性、骨质疏松、神经病变、胰腺炎等严重不良反应,建议及时更换其他核苷(酸)类似物治疗。其他宿主因素,如年龄、性别、遗传背景、合并症、营养状况、个体差异等也可能影响线粒体毒性的临床表现形式和危害程度。干扰素的不良反应及处理原则见中国指南[29]。
5.5 耐药监测及管理 耐药是制约核苷(酸)类似物长期抗病毒治疗的重要问题。一旦耐药发生,不仅使已取得的治疗获益丧失,还有导致肝脏病变急剧恶化,疾病加速进展为肝衰竭,增加肝移植、HCC发生的风险,使死亡风险增加。因此,对于已进展为晚期肝病阶段的肝硬化患者而言,尽可能减少耐药的发生尤其重要。
核苷(酸)类似物在肝硬化人群中的耐药情况仅有少量研究(主要为LMV)报道。对各核苷(酸)类似物耐药风险的认识,更多来源于慢性乙型肝炎人群。强效和高耐药基因屏障的药物如ETV、TDF是目前耐药发生率更低的药物。
仔细了解患者既往治疗史、初始选用强效和高耐药基因屏障药物如ETV、TDF的单药长期治疗、加强患者对疾病的认识和依从性教育、避免低耐药基因屏障药物的单药序贯治疗、严格掌握治疗适应证、加强对医务人员抗病毒治疗耐药预防和管理的教育等都是耐药预防及管理的重要措施。治疗过程中,密切监测HBV DNA,一旦出现耐药信号,如病毒学突破、病毒学反弹和生化学突破等,应尽快进行耐药基因位点检测。耐药监测和治疗中,根据完全病毒学应答、部分病毒学应答和原发无应答情况,采取继续单药治疗、继续观察加药或换药策略。对已确认的耐药,应及早进行挽救治疗。挽救治疗可按表2执行[94]。关于耐药监测及管理的具体实施及其他信息可参考“核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理”一文。
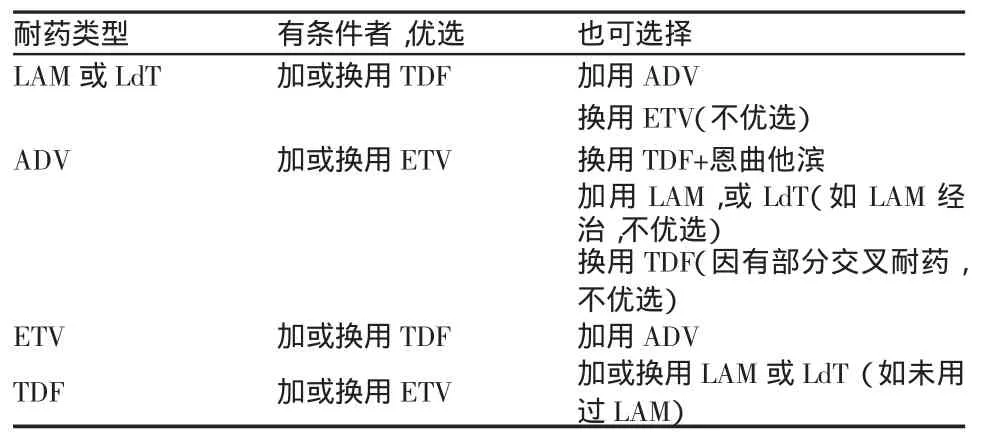
表2 抗病毒耐药的挽救治疗
5.6 肝肾功能不全患者中的剂量调整 在肝功能不全患者中,目前无证据显示需对核苷(酸)类似物进行相应的剂量调整。肝功能受损不影响LAM、LdT的药物代谢过程;中度和重度肝损伤对ADV、ETV药代动力学无影响。
肾功能不全可以在肝硬化失代偿的终末期发生。因此,对伴肾功能不全的患者,建议首先进行剂量或给药间隔的调整(表3)。其次,定期监测血清肌酐、血磷和尿液样本。若肾功能轻度受损,可每2-3个月监测一次;若中度或严重受损,则需每月监测1次。尤其应严密监测肾功能不全已进行剂量调整的患者。第三,尽可能避免使用其他肾毒性药物。
由于ADV和TDF均有引起肾毒性的风险,对长期服用ADV或TDF的患者,应定期监测血清肌酐和血磷水平,如肌酐水平超过基线值0.5 mg/dL以上,或血磷水平低于2.0 mg/dL,提示出现ADV或TDF相关的肾毒性,如肾功能受损,优先考虑换用其他核苷 (酸)类似物,否则需根据肾小球滤过率(GFR)或估测的肾小球滤过率(eGFR)对剂量或给药间隔进行调整。

表3 肾功能不全HBV感染患者的推荐剂量或给药间隔
5.7 并发症的处理 肝硬化失代偿时,常合并腹水、自发性细菌性腹膜炎、肝肾综合征、静脉曲张破裂出血、肝性脑病等并发症。对这些患者,应在抗病毒治疗的基础上,参照相应指南或共识,针对出现的并发症进行规范化的治疗。
6 患者随访、监测及管理
通过最初、后续评估,在全面了解患者病情基础上,制定合理的患者随访、监测策略,这不仅对判断患者的预后、评估可能的死亡风险具有重要价值,而且对采取正确治疗决策有重要指导意义。随访中应重点监测病毒复制状况、耐药风险、抗病毒治疗安全性、肝脏功能的受损及代偿能力、并发症、HCC风险、疾病进展和死亡风险等,监测指标详见第四、五部分和HBV相关肝硬化临床诊断、评估、抗病毒治疗流程图(图2)。有肝移植指征者,应及时转诊肝移植中心。

图2 HBV相关肝硬化临床诊断、评估、抗病毒治疗流程图
7 未来研究方向
尽管HBV相关肝硬化的抗病毒治疗已建立了一定证据,但仍有很多问题有待解决,因此,未来的研究方向包括:1、寻找疾病进展的生物标记;2、HBV DNA在肝硬化失代偿期的预后作用;3、基线HBV DNA和持续病毒复制在HCC发生中的作用;4、非创诊断技术预测疾病进展的价值;5、IFN在代偿期肝硬化患者中的适用人群和最佳剂量;6、核苷(酸)类似物在肝硬化人群中的耐药情况及应对策略;7、核苷(酸)类似物与治疗肝硬化并发症药物的相互作用;8、药物经济学。
8 推荐意见
意见1:持续高病毒载量可独立预测肝硬化发生(1b;A)。HBeAg持续阳性者肝硬化发生风险更高(2a;B)。治疗后出现HBeAg血清转换或HBV DNA低于检测下限者预后较好(2b;B)。HBV基因型与疾病进展的关联尚存争议(2b;B)。
意见2:代偿期肝硬化可通过隐匿进展或肝炎急性发作导致失代偿发生(2b;A)。其中HBV高载量(或持续复制)者、合并其他嗜肝病毒感染者的失代偿风险更高(2a;B)。
意见3:肝硬化是HCC发生的最重要风险因素(2a;A)。代偿期肝硬化可不经失代偿期而直接进展为HCC(2b;B)。基线病毒载量和持续病毒复制在HCC发生中的作用需进一步阐明(2b;B)。
意见4:HBV相关肝硬化临床诊断的必备条件包括组织学或临床确认的肝硬化证据、HBV感染的病因学证据,完整诊断包括病因学、代偿/失代偿状态以及并发症情况。最初和后续完整临床评估至少应包括病毒复制状况、肝脏功能及代偿能力、并发症和HCC筛查(5;B)。
意见5:肝硬化的诊断需要综合依据临床表现、实验室检查、组织学、影像学等检查,其中肝脏硬度测定可作为肝硬化非创诊断时的参考(2b;B)。需要明确诊断时,肝组织活检是代偿期肝硬化临床诊断的金标准(2b;A)。
意见6:初始抗病毒治疗后的1-3个月检测一次HBV DNA,以后每3-6月定期监测(2b;A)。条件许可,应尽可能采用国际公认的高灵敏度和较大检测范围的检测方法检测HBV DNA(2b;B)。血清学指标可适时检测,但不必过于频繁(5;B)。
意见7:根据病情监测生化指标,应用ICG、Child-Pugh分级和/或MELD模型,有助于准确评估肝脏功能及代偿能力,判断死亡风险(2b;A)。
意见8:可按5期分类法评估肝硬化并发症状况,确定疾病进展,判断死亡风险;1、2期为代偿期肝硬化,3-5期为失代偿期肝硬化(1a;A)。
意见9:HBV相关肝硬化患者即使HBV DNA检测不出,也应筛查HCC(2b;A)。对高危人群,每6个月用腹部超声和AFP筛查HCC(2b;A)。对AFP>400μg/L而超声未发现肝脏占位者,应作CT和/或MRI检查(2b;B)。AFP升高未达到诊断水平者,应监测AFP动态变化,1~2个月进行超声筛查,需要时作CT和/或MRI检查;若高度怀疑HCC,可考虑DSA肝动脉碘油造影检查(2b;B)。
意见10:代偿期肝硬化抗病毒治疗的首要目标是阻止或延缓肝功能失代偿和HCC的发生;失代偿期肝硬化抗病毒治疗的首要目标是维护或改善残存的肝脏功能,降低或延缓并发症和HCC的发生,减少或延缓肝移植的需求(1a;A)。
意见11:尽早并长期抗病毒治疗可带来明显临床获益(2b;B)。HBV DNA水平是决定代偿期患者是否开始抗病毒治疗的唯一因素(2b;B)。失代偿期患者只要HBV DNA可检出,建议在知情同意基础上,尽早开始核苷(酸)类似物治疗(2b;B);HBV DNA检测不出时,建议用国际公认的高灵敏方法复查以确认是否存在HBV复制(5;B)。
意见12:对代偿期肝硬化患者,选择干扰素治疗有争议,应十分慎重,需全面评估风险/获益(3b;B)。对失代偿期患者,禁用IFNα(3b;A)。核苷(酸)类似物对代偿期或失代偿期患者均适用(2b;B)。
意见13:核苷(酸)类似物的选择,应综合考虑可能的获益、安全性风险、耐药风险和经济状况等。如条件许可,建议首选或优先选用强效和低耐药的药物如ETV、TDF的单药长期治疗(1b;A)。
意见14:定期严密监测CPK、肾功能、血磷及淀粉酶等指标,一旦出现严重的肌病、肾损害、骨质疏松、神经病变及胰腺炎等核苷(酸)类似物线粒体毒性的不良反应,建议更换其他核苷(酸)类似物(3b;B)。对高MELD评分患者,应密切监测乳酸酸中毒的风险(2b;B)。干扰素治疗的安全性监测和不良反应处理原则参见中国《慢性乙型肝炎防治指南(2010年版)》(2b;B)。
意见15:耐药发生可导致治疗获益丧失、疾病恶化或进展加速(2b;B)。LAM或LdT耐药,优先考虑加用或换用TDF;ADV耐药,优先考虑加用或换用ETV;ETV耐药,优先考虑加用或换用TDF;TDF耐药,优先考虑加用或换用ETV(2b;B)。
意见16:对肝脏功能不全患者,目前无证据显示需对核苷(酸)类似物进行剂量调整(3b;B)。
意见17:伴肾功能不全者,应进行剂量或给药间隔调整(3b;B)。轻度肾功能受损者,每2-3个月监测血清肌酐、血磷;中重度受损者,每月监测1次(5;B)。长期服用ADV或TDF者,每3个月监测血清肌酐和血磷,如肌酐水平超过基线值0.5 mg/dL以上,或血磷水平低于2.0 mg/dL,提示出现ADV或TDF相关的肾毒性,如肾功能受损,优先考虑换用其他核苷类药物,否则应根据(e)GFR对剂量或给药间隔进行调整(3a;B)。
意见18:抗病毒治疗是HBV相关肝硬化整体治疗的重要组成部分,对肝硬化失代偿期相关并发症的处理,应在抗病毒治疗基础上,参照相应指南或共识进行规范化的治疗;有肝移植指征者,应及时转诊肝移植中心(5;B)。
附录:
术语及定义:
(1)病毒学应答(virological response):指血清HBV DNA检测不到(PCR法)或低于检测下限(完全病毒学应答),或较基线下降≥2 log10 IU/ml(部分病毒学应答)[29]。
2)完全病毒学应答(complete virological response):在抗病毒治疗时,用灵敏的实时PCR检测,HBVDNA检测不到或低于检测下限[94]。
(3)部分病毒学应答(partial virological response):在依从性良好的情况下,治疗至6个月(24周)时,仍能检测到HBVDNA,但下降>1log10 IU/ml。判定部分病毒学应答的时间因核苷(酸)类似物类别而异,对于低耐药基因屏障的LAM和LdT,判定时间为6个月(24周),而对于高耐药基因屏障的 ETV和 TDF,判定时间为 12个月(48周)[94,97]。
(4)原发无应答(primary non-response):在依从性良好的情况下,用核苷(酸)类似物治疗3个月(12周)时,HBVDNA下降<1 log10 IU/ml[94]。
(5)血清学应答(serological response):指血清HBeAg转阴或HBeAg血清学转换,或HBsAg转阴或HBsAg血清学转换[29]。
(6)生物化学应答(biochemical response):指血清ALT和 AST恢复正常[29,97]。
(7)耐药(drug resistance):在抗病毒治疗过程中,检测到和HBV耐药相关的基因突变,称为基因型耐药(genotypic resistance)。体外实验显示抗病毒药物敏感性降低并与基因耐药相关,称为表型耐药(phenotypic resistance)。针对一种抗病毒药物出现的耐药突变对另外一种或几种抗病毒药物也出现耐药,称为交叉耐药(cross resistance)[29]。
(8)病毒学突破 (virological breakthrough)在未更改治疗的情况下,获得部分或完全病毒学应答的患者,其HBV DNA水平较治疗中最低点上升1 lg IU/ml,并在间隔1个月以上的第2次检测证实[94]。
(9)生化学突破 (biochemical breakthrough)在未更改治疗的情况下,基线ALT≥2ULN,且在治疗中ALT已降至正常的患者,ALT升至高于ULN[94]。
(10)病毒学反弹 (virological rebound)在未更改治疗的情况下,获得部分或完全病毒学应答的患者,其HBV DNA载量超过治疗前水平[94]。
共识专家名单(排名不分先后,以姓名拼音字母为序):
陈成伟、丁惠国、窦晓光、段钟平、范建高、傅青春、韩涛、韩英、侯金林、江家骥、贾继东、刘玉兰、陆伦根、陆伟、毛青、茅益民、南月敏、牛俊奇、聂玉强、彭劼、任红、王吉耀、尚佳、唐红、魏来、翁心华、谢青、谢雯、谢冬英、谢渭芬、阎明、尤红、曾民德、钟碧慧、庄辉
[1]Xu B,Xu GG,Guo Q,et al.Long term treatment of lamivudine in chronic hepatitis B patients with severe liver fibrosisten-year follow-up outcomes of NUCB 4006 trial.Chin J Ⅰnfect Dis 2011,28(11):656-661.
[2]Chang TT,Liaw YF,Wu SS,et al.Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B.Hepatology,2010,52(3):886-893.
[3]Fink SA,Jacobson ⅠM.Managing patients with hepatitis-B-related or hepatitis-C-related decompensated cirrhosis.Nat Rev Gastroenterol Hepatol,2011,8(5):285-295.
[4]Zhang QQ,An X,Liu YH,et al.Long-term Nucleos(t)ide analogues therapy for adults with chronic hepatitis B reduces the risk of long-term complications:a meta-analysis.Virol J,2011,15(8):72.
[5]Manolakopoulos S,Triantos C,Theodoropoulos J,et al.Antiviral therapy reduces portal pressure in patients with cirrhosis due to HBeAg-negative chronic hepatitis B and significant portal hypertension.J Hepatol,2009,51(3):468-474.
[6]Li CZ,Cheng LF,Li QS,et al. Antiviral therapy delays esophageal variceal bleeding in hepatitis B virus-related cirrhosis.World J Gastroenterol,2013,19(40):6849-6856.
[7]Lok,AS.Hepatitis:Long-term therapy of chronic hepatitis B reverses cirrhosis.Nat Rev Gastroenterol Hepatol(advance online publication),29 January 2013;doi:10.1038/nrgastro.2013.13.
[8]Perz JF,Armstrong GL,Farrington LA,et al.The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide.J Hepatol,2006,45(4):529-538.
[9]Liaw YF,Leung N,Kao JH,et al.Asian-Pacific consensus statement on the management of chronic hepatitis B:a 2008 update.Hepatol Ⅰnt,2008,2(3):263-283.
[10]Ⅰloeje UH,Yang HⅠ,Su J,et al.Predicting cirrhosis risk based on the level of circulating hepatitis B viral load.Gastroenterology,2006,130(3):678-686.
[11]Huo T,Wu JC,Hwang SJ,et al.Factors predictive of liver cirrhosis in patients with chronic hepatitis B:a multivariate analysis in a longitudinal study.Eur J Gastroenterol Hepatol,2000,12(6):687-693.
[12]Realdi G,Fattovich G,Hadziyannis S,et al.Survival and prognostic factors in 366 patients with compensated cirrhosis type B:a multicenter study.The Ⅰnvestigators of the European Concerted Action on Viral Hepatitis (EUROHEP).J Hepatol,1994,21(4):656-666.
[13]Colin JF,Cazals-Hatem D,Loriot MA,et al. Ⅰnfluence of human immunodeficiency virus infection on chronic hepatitis B in homosexual men.Hepatology,1999,29(4):1306-1310.
[14]Hsu YS,Chien RN,Yeh CT,et al.Long-term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B.Hepatology,2002,35(6):1522-1527.
[15]Sánchez-Tapias JM,Costa J,Mas A. Ⅰnfluence of hepatitis B virus genotype on the long-term outcome of chronic hepatitis B in western patients.Gastroenterology,2002,123(6):1848-1856.
[16]Sumi H,Yokosuka O,Seki N,et al.Ⅰnfluence of hepatitis B virus genotypes on the progression of chronic type B liver disease.Hepatology,2003,37(1):19-26.
[17]Chu CJ,Hussain M,Lok AS.Hepatitis B virus genotype B is associated with earlier HBeAg seroconversion compared with hepatitis B virus genotype C.Gastroenterology,2002,122(7):1756-1762.
[18]de Jongh FE,Janssen HL,de Man RA,et al.Survival and prognostic indicators in hepatitis B surface antigen-positivecirrhosis of the liver.Gastroenterology,1992,103(5):1630-1635.
[19]Liaw YF,Chen JJ,Chen TJ.Acute exacerbation in patients with liver cirrhosis:a clinicopathological study.Liver,1990,10(3):177-184.
[20]Chu CM,Liaw YF.Hepatitis B virus-related cirrhosis:natural history and treatment.Semin Liver Dis,2006,26(2):142-152.
[21]Lefton HB,Rosa A,Cohen M.Diagnosis and epidemiology of cirrhosis.Med Clin N Am,2009,93(4):787-799.
[22]Vallet-Pichard A,Mallet V,Costentin CE,et al.Treatment of HBV-related cirrhosis.Expert Rev Anti Ⅰnfect Ther,2009,7(5):527-535.
[23]Das K,Datta S,et al.Course of disease and survival after onset of decompensation in hepatitis B virus-related cirrhosis.LiverⅠnt,2010,30(7):1033-1042.
[24]Zoulim F,Radenne S,Ducerf C.Management of patients with decompensated hepatitis B virus associated[corrected]cirrhosis.Liver Transpl,2008,14(2):S1-7.
[25]Chen CJ,Yang HⅠ,Su J,et al.Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level.JAMA,2006,295(1):65-73.
[26]Chen YC,Chu CM,Yeh CT,et al.Natural course following the onset of cirrhosis in patients with chronic hepatitis B:a longterm follow-up study.Hepatol Ⅰnt,2007,1(1):267-273.
[27]Fattovich G,Giustina G,Schalm SW,et al.Occurrence of hepatocellular carcinoma and decompensation in western European patients with cirrhosis type B.The EUROHEP Study Group on Hepatitis B Virus and Cirrhosis.Hepatology,1995,21(1):77-82.
[28]Fattovich G,Pantalena M,Zagni Ⅰ,et al.Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis:a cohort study of 297 patients.Am J Gastroenterol,2002,97(11):2886-2895.
[29]中华医学会肝病学分会.慢性乙型肝炎防治指南.中国病毒病杂志,2011,1(1):9-23.
[30]Colli A,Fraquelli M,Andreoletti M,et al.Severe liver fibrosis or cirrhosis:accuracy of US for detection-analysis of 300 case.Radiology,2003,227(1):89-94.
[31]郑荣琴,黄冬梅,张波等.超声、CT及MRⅠ诊断肝硬化的比较. 世界华人消化杂志,2005,13(8):993-996.
[32]Bedossa P,Dargere D,Paradis V.Sampling variability of liver fibrosis in chronic hepatitis C.Hepatology,2003,38(6):1449-1457.
[33]Min-De Zeng,Lun-Gen Lu,Yi-Min Mao,et al.Prediction of Significant Fibrosis in HBeAg-Positive Patients With Chronic Hepatitis B by a Noninvasive Model.Hepatology,2005,42(6):1437-1445.
[34]肝脏硬度评估小组.瞬时弹性成像技术诊断肝纤维化专家意见.中华肝脏病杂志,2013,2l(6):420-424.
[35]Poynard T,Munteanu M,Ⅰmbert-Bismut F,et al.Prospective analysis of discordant results between biochemical markers and biopsy in patients with chronic hepatitis C.Clin Chem,2004,50(8):1344-1355.
[36]Poynard T,McHutchison J,Manns M,et al.Biochemical surrogate markers of liver fibrosis and activity in a randomized trial of peginterferon alfa-2b and ribavirin.Hepatology,2003,38(2):481-492.
[37]Poynard T,Ngo Y,Munteanu M,et al.Noninvasive markers of hepatic fibrosis in chronic hepatitis B.Curr Hepat Rep,2011,10(2):87-97.
[38]Bartres C,Lens S.Elastography of the liver(Fibroscan)in hepatology.Rev Esp Enferm Dig,2013,105(4):235.
[39]Janssens F,de Suray N,Piessevaux H,et al.Can transient elastography replace liver histology for determination of advanced fibrosis in alcoholic patients:A real-life study.Clin Gastroenterol,2010,44(8):575-582.
[40]Castera L.Transient elastography and other noninvasive tests to assess hepatic fibrosis in patients with viral hepatitis.J Viral Hepat,2009,16(5):300-314.
[41]Bonnard P,SombiéR,Lescure FX,et al.Comparison of elastography,serum marker scores,and histology for the assessment of liver fibrosis in hepatitis B virus(HBV)-infected patients in Burkina Faso.Trop Med Hyg,2010,82(3):454-458.
[42]Lau H,Man K,Fan ST,et al.Evaluation of preoperative hepatic function in patients with hepatocellular carcinoma undergoing hepatectomy.Br J Surg,1997,84(9):1255-1259.
[43]Chen X,Zhang HB,Li ZQ,et al. Ⅰndocyanine green clearance in evaluating the recovery of liver reserve function after super selective transarterial chemoembolization.Hepatobiliary Pancreat Dis Ⅰnt,2013,12(6):656-660.
[44]Durand F,Valla D.Assessment of the prognosis of cirrhosis:Child-Pugh versus MELD.J Hepatol,2005,42 Suppl(1):S100-107.
[45]Schuppan D,Afdhal NH.Liver cirrhosis.Lancet,2008,371(9615):838-851.
[46]Arvaniti V,D'Amico G,Fede G,Manousou P,et al. Ⅰnfections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis.Gastroenterology,2010,139(4):1246-56,1256.e1-5.
[47]中国抗癌协会肝癌专业委员会.原发性肝癌规范化诊治专家共识. 临床肿瘤学杂志,2009,14(3):259-269.
[48]Fung SK,Lok AS.Management of patients with hepatitis B virus-induced cirrhosis.J Hepatol,2005,42 Suppl(1):S54-64.
[49]Fontana RJ,Hann HW,Perrillo RP,et al.Determinants of early mortality in patients with decompensated chronic hepatitis B treated with antiviral therapy.Gastroenterology,2002,123(3):719-727.
[50]Chien RN,Lin CH,Liaw YF.The effect of lamivudine therapy in hepatic decompensation during acute exacerbation of chronic hepatitis B.J Hepatol,2003,38(3):322-327.
[51]Tsubota A,Arase Y,Suzuki Y,et al.Lamivudine mono therapy for spontaneous severe acute exacerbation of chronic hepatitis B.J Gastroenterol Hepatol,2005,20(3):426–432.
[52]Perrillo R,Tamburro C,Regenstein F,et al.Low-dose,titratable interferon alfa in decompensated liver disease caused by chronic infection with hepatitis B virus.Gastroenterology,1995,109(3):908-916.
[53]Hoofnagle JH,DiBisceglie AM,Waggoner JG,et al. Ⅰnterferon alfa for patients with clinically apparent cirrhosis due to chronic hepatitis B.Gastroenterology,1993,104(4):1116-1121.
[54]Honkoop P,Niesters HG,de Man RA,et al.Lamivudine resistance in immunocompetent chronic hepatitis B.Ⅰncidence and patterns.J Hepatol,1997,26(6):1393-1395.
[55]Lai CJ,Terrault NA.Antiviral therapy in patients with chronic hepatitis B and cirrhosis.Gastroenterol Clin North Am,2004,33(3):629-654.
[56]Alberti A,Caporaso N.HBV therapy:Guidelines and open issues.Digest Liver Dis,2011,43(1):S57-S63.
[57]van Zonneveld M,Honkoop P,Hansen BE,et al.Long-term follow-up of alpha-interferon treatment of patients with chronic hepatitis B.Hepatology,2004,39(3):804-810.
[58]Liaw YF,Sung JJ,Chow WC,et al.Lamivudine for patients with chronic hepatitis B and advanced liver disease.N Engl J Med,2004,351(15):1521-1531.
[59]Schiff E,Simsek H,Lee WM,et al.Efficacy and safety of entecavir in patients with chronic hepatitis B and advanced hepatic fibrosis or cirrhosis.Am J Gastroenterol,2008,103(11):2776-2783.
[60]Villeneuve JP,Condreay LD,Willems B,et al.Lamivudine treatment for decompensated cirrhosis resulting from chronic hepatitis B.Hepatology,2000,31(1):207-210.
[61]Fontana RJ,Keeffe EB,Carey W,et al.Effect of lamivudine treatment on survival of 309 North American patients awaiting liver transplantation for chronic hepatitis B.Liver Transpl,2002,8(5):433-439.
[62]Hann HW,Fontana RJ,Wright T,et al.A United States compassionate use study of lamivudine treatment in non transplantation candidates with decompensated hepatitis B virus-related cirrhosis.Liver Transpl,2003,9(1):49-56.
[63]Yao FY,Bass NM.Lamivudine treatment in patients with severely decompensated cirrhosis due to replicating hepatitis B infection.J Hepatol,2000,33(2):301-307.
[64]Kapoor D,Guptan RC,Wakil SM,et al.Beneficial effects of lamivudine in hepatitis B virus-related decompensated cirrhosis.J Hepatol,2000,33(2):308-312.
[65]Manolakopoulos S,Karatapanis S,Elefsiniotis J,et al.Clinical course of lamivudine monotherapy in patients with decompensated cirrhosis due to HBeAg-negative chronic hepatitis B.Am J Gastroenterol,2004,99(1):57-63.
[66]Bae SH,Yoon SK,Choi JY,et al.Timing of lamivudine administration according to Child class in patients with decompensated cirrhosis.J Gastroenterol Hepatol,2005,20(10):1527-1532.
[67]Perrillo RP,Wright T,Rakela J,et al.A multicenter United States-Canadian trial to assess lamivudine monotherapy before and after liver transplantation for chronic hepatitis B.Hepatology,2001,33(2):424-432.
[68]Zoulim F,Locarnini S.Hepatitis B virus resistance to nucleos(t)ide analogues.Gastroenterology,2009,137(5):1593-608.
[69]Schiff ER,Lai CL,Hadziyannis S,et al.Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre-and post-liver transplantation patients.Hepatology,2003,38(6):1419-1427.
[70]Schiff E,Lai CL,Hadziyannis S,et al.Adefovir dipivoxil for wait-listed and post-liver transplantation patients with lamivudine-resistant hepatitis B:final long-term results.Liver Transpl,2007,13(3):349-360.
[71]Lampertico P.Partial virological response to nucleos(t)ide analogues in nave patients with chronic hepatitis B:From guidelines to field practice.J Hepatol,2009,50(4):644-647.
[72]Shim JH,Lee HC,Kim KM,et al.Efficacy of entecavir in treatment-nave patients with hepatitis B virus-related decompensated cirrhosis.J Hepatol,2010,52(2):176-182.
[73]Schiff ER,Lee SS,Chao YC,et al.Long-term treatment with entecavir induces reversal of advanced fibrosis or cirrhosis in patients with chronic hepatitis B.Clin Gastroenterol Hepatol,2011,9(3):274-276.
[74]Pozzi M,Pizzala DP,Maldini FF,et al.Portal pressure reduction after entecavir treatment in compensated HBV cirrhosis.Hepatogastroenterology,2009,56(89):231-235.
[75]Sherman M,Yurdaydin C,Sollano J,et al.Entecavir for treatment of lamivudine-refractory,HBeAg-positive chronic hepatitis B.Gastroenterology,2006,130(7):2039-2049.
[76]Wang LC,Chen EQ,Cao J,et al.De novo combination of lamivudine and adefovir versus entecavir monotherapy for the treatment of nave HBeAg-negative chronic hepatitis B patients.Hepatol Ⅰnt,2011,5(2):671-676.
[77]Levin J.On-Treatment Decline in Serum HBsAg Levels Predicts Sustained Ⅰmmune Control and HBsAg Clearance 6 Months Post-Treatment in HBeAg-Positive Hepatitis B Virus-Ⅰnfected Patients Treated with Peginterferon Alfa-2a.20th APASL Conference of the Asian Pacific Association for the Study of the Liver,2010.
[78]Gane EJ,Chan HL,Choudhuri G,et al.Treatment of decompensated HBV-cirrhosis:results from 2-years randomized trial with telbivudine or lamivudine.J Hepatol,2010,52(1):S4.
[79]Patrick Marcellin,Edward Gane,Maria Buti,et al.Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B:a 5-year open-label follow-up study.Lancet,2013,381(9865):468-475.
[80]Buti M,Hadziyannis S,Mathurin P,et al.Tenofovir Disoproxil Fumarate(TDF)is Highly Active for Treatment of Chronic Hepatitis B(CHB)in Patients With Cirrhosis.43rd Annual Meeting of the European Association for the Study of the Liver.S33.
[81]Liaw YF,Sheen ⅠS,Lee CM,et al.Tenofovir disoproxil fumarate(TDF),emtricitabine/TDF,and entecavir in patients with decompensated chronic hepatitis B liver disease.Hepatology,2011,53(1):62-72.
[82]贾红宇,卢微,郑临等.拉米夫定单药及其初始联合阿德福韦酯治疗失代偿期乙型肝炎肝硬化的疗效比较.中华肝脏病杂志,2011,19(2):84-87.
[83]Ⅰvana Carey,Huyen-Ly Nguyen,Dorothy Joe,et al.De-novo antiviral therapy with nucleos(t)ide analogues in‘real-life’patients with chronic hepatitis B infection:comparison of virological responses between lamivudine+adefovir vs.Tenofovir therapy.AASLD 2011,San Francisco,CA.Poster 1396.
[84]Girgis CM,Wong T,Ngu MC,et al.Hypophosphataemic osteomalacia in patients on adefovir dipivoxil.J Clin Gastroenterol,2011,45(5):468-473.
[85]Gish R,et al.Selection of chronic hepatitis B therapy with high barrier to resistance.Lancet Ⅰnfect Dis,2012,12(4):341-353.
[86]Eun JR,Lee HJ,Kim TN,Lee KS.Risk assessment for the development of hepatocellular carcinoma:according to on-treatment viral response duringlong-term lamivudine therapy in hepatitis B virus-related liver disease.J Hepatol,2010,53(1):118-125.
[87]Papatheodoridis GV,Manolakopoulos S,Touloumi G,et al.Virological suppression does not prevent the development of hepatocellular carcinoma in HBeAg-negative chronic hepatitis B patients with cirrhosis receiving oral antiviral(s)starting with lamivudine monotherapy:results of the nationwide HEPNET.Greece cohortstudy.Gut,2011,60(8):1109-1116.
[88]Hadziyannis SJ,Tassopoulos NC,Heathcote EJ,et al.Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years.Gastroenterology,2006,131(6):1743-1751.
[89]Lok AS,McMahon BJ.Chronic hepatitis B:update 2009.Hepatology,2009,50(3):661-662.
[90]茅益民.关注口服抗HBV药物治疗的长期安全性.肝脏,2009,14(7):68-70.
[91]Lange CM,Bojunga J,Hofmann WP,et a.Severe lactic acidosis during treatment of chronic hepatitis B with entecavir in patients with impaired liver function.Hepatology,2009,50(6):2001-2006.
[92]王桂爽,蔡皓东.阿德福韦酯和替诺福韦相关性肾小管病.药物不良反应杂志,2010,12(1):31-36.
[93]Peyrière H,Reynes J,Rouanet Ⅰ,et al.Renal tubular dysfunction associated with tenofovir therapy:report of 7 cases.J Acquir Ⅰmmune Defic Syndr,2004,35(3):269-273.
[94]庄辉,翁心华.核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理. 中国病毒病杂志,2013,3(1):1-11.
[95]Wong GL,Chan HL,Mak CH,et al.Entecavir treatment reduces hepatic events and deaths in chronic hepatitis B patients with liver cirrhosis.Hepatology,2013,58(5):1537-1547.
[96]Jiyao Wang.Clinical utility of entecavir for chronic hepatitis B in Chinese patients.Drug Design Develop Ther,2014,8:13-24.
[97]European Association for the Study of the Liver.EASL clinical practice guidelines:management of chronic hepatitis B virus infection.J Hepatol,2012,57(1):167-185.

