t(17;19)-急性淋巴细胞白血病细胞对肿瘤坏死因子相关凋亡诱导配体的敏感性及其意义
张晓春,郑晓敏,陈 诚,李义德
(1.宁夏医科大学总医院儿科,宁夏 银川 750004;2.宁夏医科大学总医院医学实验中心,宁夏 银川 750004)
同种造血干细胞移植(allogeneic stem cell transplantation,allo-SCT)后,移植物抗白血病效应(graft versus ceukemia,GVL)由细胞毒性T细胞(cytotoxic T-lymphocyte,CTL)和自然杀伤(natural killer,NK)细胞所介导[1],是白血病患者得以治愈的关键反应。近年来研究[2]表明:肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)在NK细胞和CTL细胞介导的抗肿瘤免疫中发挥极其重要的作用。t(17;19)-急性淋巴细 胞 白 血 病(acute lymphoblastic leukemia,ALL)预后极差,来源于t(17;19)(q21-q22;p13)的致癌基因E2A-HLF阻断内源性凋亡通路,在白血病形成及化疗药物耐受中起关键作用[3]。(17;19)-ALL患者多于诊断后2年内复发,但allo-SCT可 改 善 其 预 后[4]。 国 内 外 已 有 相 关 研究[5-7]表 明:重 组 人 可 溶 性 TRAIL(rhsTRAIL)对乳腺癌、恶性胶质瘤和肺癌等具有抗肿瘤效应,但rhsTRAIL对t(17;19)-ALL作用的研究尚少。本研究拟通过t(17;19)-ALL细胞株对rhsTRAIL的敏感性初步分析其可能作用机制,探讨其临床意义,为临床治疗t(17;19)-ALL提供新思路。
1 材料与方法
1.1 细胞株、主要试剂和仪器 t(17;19)-ALL细胞株4株(Endo-kun、HAL-O1、UOC-B1和 YCU-B2),混合谱系白血病(MLL)ALL(MLL+-ALL)细胞株9株(KOPN1、KOPB26、KOCL33、KOCL 44、KOCL 45、KOCL 50、KOCL 51、KOCL 58和 KOCL 69),Ph1+-ALL细 胞 株 6 株(KOPN30bi、KOPN 57bi、KOPN 66bi、KOPN 72bi、YAMN73 和 YAMN 91),前B ALL细胞株13株,包括t(1;19)细胞 株 7 株(697、 KOPN34、 KOPN 36、KOPN 60、KOPN 63、YAMN90和YAMN 92)、t( 12;21)细胞株1株(Reh)及其他细胞株5株(KOPN35、KOPN 61、KOPN 62、KOPN 79和KOPN 84),以上细胞株均来自日本山梨大学医学部小儿科。细胞株用含10%FCS的RPMI-1640培养液培养,置于37℃、5%CO2、饱和湿度恒温培养箱。取处于对数生长期细胞进行实验。1例t(17;19)-ALL患者的骨髓经Ficoll-Hypaque密度梯度离心分离出单核细胞(原始细胞>95%),RPMI 1640培养液离心洗涤,悬于含10%FCS的RPMI 1640培养液中。患者标本的使用经宁夏医科大学伦理委员会批准。Annexin-V-FITC、藻红蛋白(PE)标记的抗生物素蛋白链菌素、Caspase广 谱 抑 制 剂z-VAD-fmk和 rhsTRAIL(Killer TRAIL)分别购自BestBio、Invitrogen、Sigma和Alexis公司。死亡受体4(DR4)、死亡受体5(DR5)、诱骗受体1(DcR1)及诱骗受体 2(DcR2)单克隆抗体购自美国Accurate公司,鼠抗人PARP、caspase-3为美国BD公司产品,鼠抗人caspase-8单抗、tubulin和兔抗人Bid抗体为日本MBL公司产品。
1.2 TRAIL受体在细胞表面的表达 取细胞悬液,加入1μg生物素标记的鼠IgG1或者DR4、
DR5、DcR1及DcR2的单克隆抗体,冰上孵育30min;加入PE标记的抗生物素蛋白链菌素,冰上孵育30min后上流式细胞仪检测。相对荧光强度(RFI)=特异染色的平均荧光强度/对照染色的平均荧光强度。以RFI代表受体表达水平。
1.33H标记的胸腺嘧啶(3H-thymidine)法检测rhsTRAIL对细胞增殖的抑制作用 调整细胞浓度为1.0×109L-1,接种于经紫外线消毒的96孔平底培养板中,每孔 100μL(终浓度 0.5×108L-1),每组设3个平行样。添加3倍稀释的rhsTRAIL(最终浓度分别为11、33和100μg·L-1),按指定方法孵育36h,在培养的最后6h内给予脉冲(每孔1μCi),随即收集至玻璃纤维滤器;不添加孔作为对照组。用液体闪烁计数器计算整合入DNA的放射活性。rhsTRAIL的阻断率=(1-处理孔每分钟记数次数/未处理孔每分钟记数次数)×100%。t(17;19)-ALL细胞株添加rhsTRAIL(100μg·L-1),加入TRAIL中和抗体 RIK-2(10g·L-1)或caspase抑制剂z-VAD-fmk(20mmol·L-1)培养42h,在最后6h按上述方法检测3H-thymidine吸收;不添加者作为对照组。
1.4 流式细胞术检测细胞凋亡率 取细胞悬液,接种于经紫外线消毒的24孔板,每孔1mL(终浓度 1×108L-1)。TRAIL 孔 加 入 rhsTRAIL 100μg·L-1,对照孔加入新鲜培养液,12h后收集细胞。FITC标记的Annexin-V染色,采用流式细胞仪(BD,FACSCalibur)检测细胞早期凋亡率。
1.5 免疫印迹法检测caspase-8、Bia、caspase-3和PARP表达 取细胞悬液,接种于经紫外线消毒的24孔板,每孔1mL(终浓度1×105L-1)。TRAIL孔加入rhsTRAIL 100μg·L-1,对照孔加入新鲜培养液,24h后收集细胞,用NP液制备细胞裂解液并进行蛋白定量。经电泳、转膜后,5%TBS脱脂奶封闭,加入鼠抗人caspase-8、Bid、caspase-3和PARP,4℃孵育过夜。PBS洗涤3次后加入二抗振荡反应1h。TBST洗3次,TBS洗1次。ECL放射自显影,扫描图像保存。
1.6 统计学分析 采用SPSS 11.5统计学软件进行统计学分析。细胞增殖抑制率、细胞凋亡率和TRAIL受体表达水平以中位数及95%可信区间(95%CI)表示,组间比较采用秩和检验。
2 结 果
2.1 各组ALL细胞株TRAIL受体表达 采用流式细胞术检测TRAIL受体DR4、DR5、DcR1和DcR2在细胞表面的表达。t(17;19)-ALL细胞株表面DR4和DR5均为阳性表达,而DcR1和DcR2呈阴性表达。t(17;19)-ALL细胞株DR4表达水平(RFI)为1.91,明显高于 MLL+-ALL、Ph1+-ALL和其他前 B-ALL 细胞株(均P<0.05);DR5表达水平明显高于 MLL+-ALL细胞株(P<0.05)。见表1。
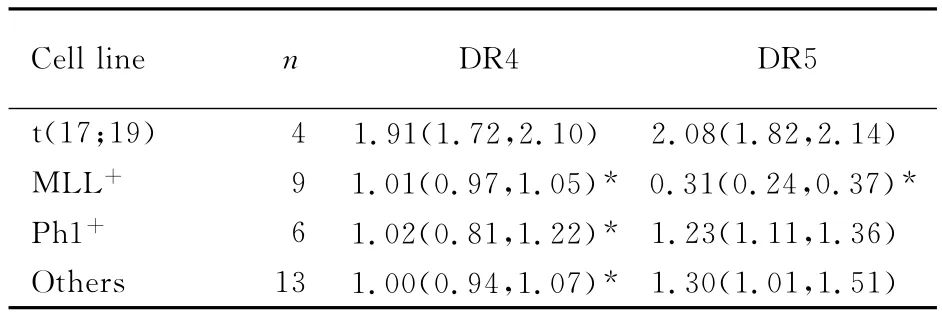
表1 TRAIL受体在ALL细胞株表面的表达水平Tab.1 Expression levels of TRAIL receptors on surface of ALL cell lines [M(95%CI)]
2.2 各组ALL细胞株的增殖抑制率 不同浓度的rhsTRAIL均能够抑制t(17;19)-ALL细胞株的增殖(图1A),且随着rhsTRAIL浓度增加抑制作用增强,rhsTRAIL浓度为100μg·L-1时,4株细胞增殖完全被抑制。这种抑制作用在添加TRAIL中和抗体RIK2或caspase抑制剂z-VAD-fmk后被阻断(图1B),提示rhsTRAIL对t(17;19)-ALL细胞株增殖的抑制作用为TRAIL特异性,并依赖于caspase。添加rhsTRAIL培养后,t(17;19)-ALL、MLL+-ALL、Ph1+-ALL和其他前B-ALL细胞株的细胞增殖抑制 率 分 别 是 100.00%、4.95%、49.56% 和24.63%,4株t(17;19)-ALL细胞株增殖抑制率显著高于9株 MLL+-ALL细胞株(P<0.01)、6株Ph1+-ALL细胞株(P<0.05)和13株其他前B-ALL细胞株(P<0.05)。
2.3 各组 ALL细胞株凋亡率及caspase-8、Bid、caspase-3和PARP的表达 rhsTRAIL处理4株t(17;19)-ALL细胞株后,细胞早期凋亡明显(图2),其凋亡率分别由未处理时的9%、19%、10%和8%上升为85%、97%、98%和91%,而相同条件下,对rhsTRAIL耐受的MLL+-ALL细胞株KOPN30bi凋亡率仅由6%上升至7%。rhsTRAIL处理后,t(17;19)-ALL细胞早期凋亡率与KOPN30bi细胞株比较差异有统计学意义(P<0.05)。免疫印迹法检测结果显示:在rhsTRAIL作用2h内,caspase-8、Bid、caspase-3和PARP的活化条带出现,并随时间推移逐渐强化。见图3。
2.4 t(17;19)-ALL原代细胞检测结果 患者白血病细胞的DR4和DR5表达水平(RFI)与t(17;19)-ALL细胞株相似;添加rhsTRAIL培养后,细胞增殖受到抑制,并发生早期凋亡。?

图1 不同浓度rhsTRAIL作用下t(17;19)-ALL细胞株的增殖抑制率(A)及特异性(B)Fig.1 Inhibitory rates of proliferation of t(17;19)-ALL cell lines(A)after treated with different rhsTRAIL and its sensitivity(B)
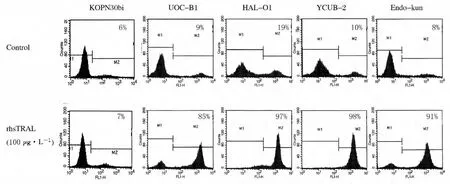
图2 rhsTRAIL对t(17;19)-ALL细胞株早期凋亡的诱导作用Fig.2 Induction of rhsTRAIL in apoptosis in t(17;19)-ALL cell lines
3 讨 论
肿瘤的免疫监视受到固有免疫和适应性细胞免疫的调控,其中主要包括CTL和NK细胞,其表达的TRAIL在抗肿瘤免疫中发挥着极其重要的作用[8-9]。目 前 发 现 的 TRAIL 受 体 中,DR4(TRAIL-R1)和DR5(TRAIL-R2)与 TRAIL结合后,将死亡信息传递至细胞内,激活细胞内信号系统,最终导致细胞凋亡[10]。DcRl(TRAIL-R3)和 DcR2(TRAIL-R4)竞 争 DR4 和 DR5 与TRAIL的结合[11]。

图3 rhsTRAIL对t(17;19)-ALL细胞株凋亡通路的激活作用Fig.3 Activation of rhsTRAIL in apoptosis pathway in t(17;19)-ALL cell lines
正常细胞中,诱骗受体(DcR)表达占优势,肿瘤细胞由于缺乏DcR的保护而易被TRAIL杀伤,因此TRAIL有别于其他TNF家族成员TNF和FasL的高毒性,能选择性诱导肿瘤细胞凋亡,而对正常细胞几乎无毒性[12-13],这一特性使其在肿瘤治疗上有广泛的应用前景,成为近年来肿瘤治疗研究领域的热点。国内外前期临床试验[5-7]结果显示:重组TRAIL蛋白对乳腺癌、恶性胶质瘤和肺癌等具有抗肿瘤效应,其抗肿瘤谱广,疗效明显。
t(17;19)(q21-q22;p13)是一种较罕见的易位,形成融合基因E2A-HLF,见于不足1%的ALL患儿[3]。伴有该基因的ALL以B前体细胞表型、高血钙症和获得性凝血异常为特点[4]。近年来随着化疗方案的进步,儿童及青少年ALL长期预后得到显著改善,但t(17;19)-ALL治疗效果仍极差,有报道该类患儿5年死亡率高达66%~100%。国外14例化疗的个案报道中,13例t(17;19)-ALL患儿在诊断2年内复发 [第1次完全缓解(CR)中位数为9个月],仅1例第1次CR期(诊断后13周)进行了同种骨髓移植的患儿维持CR至42个月[4],表明早期进行allo-SCT有助于延长患儿无病生存时间。因此,为探讨allo-SCT对改善t(17;19)-ALL预后的临床意义,有必要明确t(17;19)-ALL细胞是否对TRAIL敏感,从而最终对GVL效果敏感。
本研究结果显示:rhsTRAIL处理t(17;19)-ALL细胞后,细胞早期凋亡率明显高于对照细胞株,细胞增殖受到显著抑制,与对照细胞株比较差异有统计学意义,这种抑制作用在添加TRAIL中和抗体RIK2或caspase广谱抑制剂z-VAD后被阻断,提示t(17;19)-ALL细胞株对rhsTRAIL的敏感性为TRAIL特异性并依赖于caspase的活性。本研究发现:t(17;19)-ALL细胞株表面DR4和DR5表达均为阳性,且其表达水平明显高于其他前B-ALL细胞株,提示t(17;19)-ALL细胞株对rhsTRAIL高度敏感,其细胞表面DR4和DR5的高表达发挥了重要作用。
TRAIL与其死亡受体(DR)结合后,形成死亡诱导信号复合物,促使procaspase-8在局部募集并自我裂解形成有活性的凋亡起始蛋白caspase-8,后者切断procaspase-3,激活外源性凋亡通路[14],同时催化Bcl-2家族蛋白Bid断裂,激活内源性凋亡通路[15]。由于双重促凋亡途径的激活,TRAIL可有效诱导肿瘤细胞凋亡。本研究结果显示:rhsTRAIL处理t(17;19)-ALL细胞株后2h内,caspase-8、caspase-3、Bid和PARP均发生不同程度活化,且活化作用随时间推移而增强,提示内源性、外源性凋亡通路均受到激活是t(17;19)-ALL细胞株对rhsTRAIL高度敏感的另一个重要原因。
综上所述,因细胞表面高表达DR4、DR5以及内源性和外源性凋亡通路的激活,t(17;19)-ALL细胞对TRAL诱导的细胞毒作用敏感。t(17;19)-ALL对化疗反应不佳,临床应尽早进行allo-SCT,从而改善其预后。融合基因E2A-HLF对t(17;19)-ALL细胞 TRAIL死亡受体的作用及其机制将是下一步的研究重点。
[1]Kolb HJ,Schmid C, Barrett AJ,et al. Graft-versusleukemia reactions in allogeneic chimeras [J].Blood,2004,103(3):767-776.
[2]Rezvani K, Barrett AJ. Characterizing and optimizing immune responses to leukemia antigens after allogeneic stem cell transplantation [J].Best Pract Res Clin Haematol,2008,21(3):437-453.
[3]Seidel MG, Look AT. E2A-HLF usurps control of evolutionarily conserved survival pathways [J].Oncogene,2001,20(40):5718-5725.
[4]Inukai T,Hirose K,Inaba T,et al.Hypercalcemia in childhood acute lymphoblastic leukemia:frequent implication of parathyroid hormone-related peptide and E2A-HLF from translocation 17;19 [J].Leukemia,2007,21(2):288-296.
[5]Rahman M,Pumphrey JG,Lipkowitz S.The TRAIL to targeted therapy of breast cancer [J].Adv Cancer Res,2009,103(1):43-73.
[6]Gaiser T,Becker MR,Habel A,et a1.TRAIL-mediated apoptosis in malignant glioma cells is augmented by celecoxib through proteasomal degradation of survivin [J].Neurosci Lett,2008,442(2):109-113.
[7]Stegehuis JH,de Wilt LH,de Vries EG,et al.TRAIL receptor targeting therapies for non-small cell lung cancer:current status and perspectives [J].Drug Resist Updat,2010,13(1):2-15.
[8]Wiley SR,Schooley K,Smolak PJ,et al.Identification and characterization of a new member of the TNF family that induces apoptosis [J].Immunity,1995,3(6):673-682.
[9]Shand JC,Jansson J,Hsu YC,et al.Differential gene expression in acute lymphoblastic leukemia cells surviving allogeneic transplant [J].Cancer Immunol Immunother,2010,59(11):1633-1644.
[10]Sheridan JP,Marsters SA,Pitti RM,et al.Control of TRAIL-induced apoptosis by a family of signaling and decoy receptors[J].Science,1997,277(5327):818-821.
[11]Ashkenazi A,Dixit VM.Apoptosis control by death and decoy receptors [J].Curr Opin Cell Biol,1999,11(2):255-260.
[12]Rosario Y,Carmen P, Abelardo LR.The therapeutic potential of TRAIL receptor signalling in cancer cells [J].Clin Transl Oncol,2011,13(12):839-847.
[13]Wilson NS,Dixit V,Ashkenazi A.Death receptor signal transducers:nodes of coordination in immune signaling networks [J].Nature Immunol,2009,10(4):348-355.
[14]Crowder RN,El-Deiry WS.Caspase-8regulation of TRAIL-mediated cell death [J].Exp Oncol,2012,34(3):160-164.
[15]Matthews GM,Newbold A,Johnstone RW.Intrinsic and extrinsic apoptotic pathway signaling as determinants of histone deacetylase inhibitor antitumor activity [J].Adv Cancer Res,2012,116(3):165-197.

