姬松茸多糖促进OVA抗原免疫反应的研究*
崔立然 李洪军 王宏艳 刘颖 徐浩 胡灵佳 许惠玉
碳水化合物中的糖类化合物是自然界存在较多并具有重要生物功能的一类化合物。中药多糖特别是补益类中药多糖一般都有增强机体免疫功能的作用,能激活T细胞向Th1和Th1型方向分化、促进B细胞分泌抗体、激活巨噬细胞(MФ)的吞噬能力、自然杀伤细胞(NK)、细胞毒T细胞(CTL)对肿瘤细胞的杀伤作用、淋巴因子激活的杀伤细胞(LAK)等免疫细胞的功能,还能活化补体,促进免疫细胞因子的生成。中药多糖在多方面对免疫系统发挥重要的调节作用,对正常细胞没有毒副作用,而其多聚体多糖结构能克服铝佐剂所形成的慢性免疫激活诱导毒性的可能性,很有希望开发成为新型疫苗佐剂[1]。姬松茸(Agaricus Blazei Murrill,ABM)原产于巴西,又称巴西蘑菇,属于担子菌亚门、层菌纲 、伞菌目、伞菌科、伞菌属。该菌不仅味道鲜美,营养丰富,而且含有丰富的蛋白质、多糖、核酸、醇类等活性成分及人体必需的多种氨基酸等成分[2];尤其在增加机体免疫力、抗肿瘤防癌、降血脂、改善动脉硬化、防治糖尿病和增强人体免疫力等功效方面效果奇特[3-6]。课题组从姬松茸提取多糖(ABP-AW1),探讨ABP-AW1促进OVA抗原诱导Th1/Th2免疫反应的研究,旨在寻找具有不同于铝的Th1优势反应的佐剂。
1 材料与方法
1.1 药物及试剂 姬松茸多糖ABP-AW1由本实验室提取分离鉴定。最终确定其为组分均一的低分子量(50 KDa)多糖;HRP标记的山羊抗鼠IgG2b,IgG1抗体(SBA公司);HRP标记羊抗小鼠IgG抗体(中杉金桥生物技术公司)。
1.2 动物免疫 ICR小鼠按随机数字表法分为六组,每组15只。分别为PBS免疫组、OVA免疫组(OVA 100μg/只 )、Alum 免 疫 组(OVA 100μg/只 +Alum 200μg/只)、DT1剂量免疫组(ABP-AW1 200μg/只+OVA 100μg/只)、DT2剂量免疫组(ABP-AW1 100μg/只+OVA 100μg/只)、DT3剂量免疫组(ABPAW1 50μg/只+OVA 100μg/只)。各组分别于第1天和第15天背部皮下两点注射免疫小鼠,二免后14 d取抗凝血,分离血清,-20 ℃保存备用。取脾进行病理学观察。
1.3 免疫小鼠血清中抗OVA特异性抗体强度的测定
1.3.1 抗血清的收集 二次免疫后14 d摘除眼球采集各组小鼠血液,将血液存于1.5 mL离心管中,室温存放2 h,超速离心机离心,4 ℃,3000 rpm,10 min。微量移液器取分离血清,分装保存于-80 ℃冰箱备用。
1.3.2 血清中抗OVA特异性抗体IgG的测定 于96孔酶标板上,每孔加入100 μL包被液(含50 μg/mL OVA的0.05 M,pH 9.6的碳酸盐缓冲液),置37 ℃孵育1 h,用洗涤缓冲液PBST洗涤(重复3次,每次间隔20 s)。洗涤后每孔加封闭液200 μL,于37 ℃孵育1 h,洗涤3次,然后加1:200稀释倍数的待测血清100 μL,重复3孔,37 ℃孵育1 h,洗涤3次。每孔加1∶800的HRP标记的山羊抗小鼠IgG抗体稀释液100 μL,37 ℃孵育0.5 h,洗涤6次。每孔分别加入100 μL TMB底物显色液,37 ℃孵育15 min,每孔加终止液(2MH2SO4)50 μL终止反应,用酶标仪于波长450 nm处测定OD值。
1.3.3 血清中抗OVA特异性抗体IgG亚类的测定 于96孔酶标板上,每孔加入100 μL包被液(含50 μg/mL OVA的0.05 M,pH 9.6的碳酸盐缓冲液),置37 ℃孵育1 h,用洗涤缓冲液PBST洗涤(重复3次,每次间隔20 s)。洗涤后每孔加封闭液200 μL,于37 ℃孵育1 h,弃去反应孔内液体洗涤3次,然后加1∶20稀释倍数的待测血清100 μL,重复3孔,37 ℃孵育1 h,洗涤3次。每孔加1∶5000的HRP标记的山羊抗小鼠(IgG1或IgG2b)抗体稀释液100 μL,37 ℃孵育0.5 h,洗涤6次。每孔分别加入100 μ LTMB底物显色液,37 ℃孵育15 min,每孔加终止液(2MH2SO4)50 μL终止反应,用酶标仪于波长450 nm处测定OD值。
1.4 佐剂对小鼠的安全性评价 二免后14 d取眼球放血处死后,用10%甲醛固定免疫鼠心、肝、脾、肺、肾和肠,HE染色,进行病理学观察。
1.5 统计学处理 采用SPSS 13.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 免疫小鼠血清中抗OVA特异性抗体IgG、IgG1、IgG2b含量分析 OVA免疫组血清中抗OVA特异性抗体IgG的产生与PBS免疫组、DT免疫组2、Alum免疫组比较差异均有统计学意义(P<0.05);OVA免疫组血清中抗OVA特异性抗体IgG2b的产生与PBS免疫组、DT免疫组2、DT免疫组3比较差异均有统计学意义(P<0.05);OVA免疫组血清中抗OVA特异性抗体IgG1的产生与其余各组比较差异均有统计学意义(P<0.05),见表 1。
2.2 ABP-AW1对OVA受免小鼠免疫器官的影响 结果:二免后14 d经病理学观察,所有免疫小鼠未发现主要脏器肠、肝、脾、心、肺、肾等病理损伤及巨噬细胞渗入造成器官的损害。同时也观察到佐剂接种后2 d内,小鼠体重出现下降与对照组小鼠无明显差异,但2 d后小鼠体重逐渐恢复正常。
表1 免疫小鼠抗血清中抗OVA特异性抗体IgG、IgG1、IgG2b含量分析(±s)
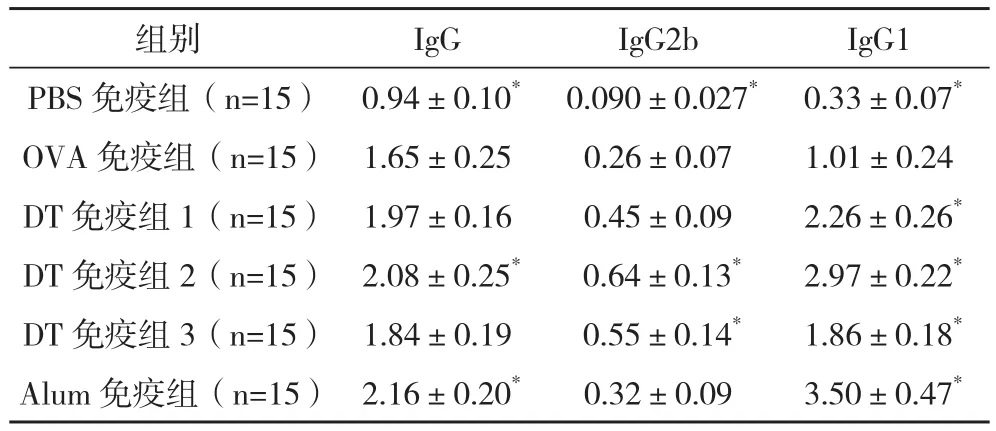
表1 免疫小鼠抗血清中抗OVA特异性抗体IgG、IgG1、IgG2b含量分析(±s)
*与OVA组比较,P<0.05
组别 IgG IgG2b IgG1 PBS免疫组(n=15) 0.94±0.10* 0.090±0.027* 0.33±0.07*OVA免疫组(n=15) 1.65±0.25 0.26±0.07 1.01±0.24 DT 免疫组1(n=15) 1.97±0.16 0.45±0.09 2.26±0.26*DT免疫组2(n=15) 2.08±0.25* 0.64±0.13* 2.97±0.22*DT免疫组3(n=15) 1.84±0.19 0.55±0.14* 1.86±0.18*Alum免疫组(n=15) 2.16±0.20* 0.32±0.09 3.50±0.47*
3 讨论
目前,疫苗佐剂主要以1926年发现的铝佐剂为主,国外几种新型佐剂仅批准在局部地区用于特定疫苗生产,如MF59佐剂在欧洲批准用于流感等疫苗[7]。然而目前使用的免疫佐剂主要刺激Th2类型的免疫应答。这种应答对需要Th1免疫应答的病毒和抗胞内寄生菌感染和癌细胞无作用。另外,疫苗研究已趋向基因疫苗和亚单位化的研制,传统的氢氧化铝佐剂和油乳佐剂由于其自身的缺陷很难适应新型疫苗的开发难以显著提高机体的免疫应答水平并适应新型疫苗的开发[8]。免疫佐剂种类决定免疫应答反应的类型,不同免疫应答反应类型对疫苗的免疫保护性有显著的影响[9]。因此,解决目前上述现实问题的重要途径是研制新型的人用疫苗佐剂,这也成为当今免疫学和化学界的一个活跃的领域。
淋巴细胞在适应性免疫应答中主要是由T淋巴细胞和B淋巴细胞发挥着关键作用,是免疫系统发挥作用的核心,可分别通过介导细胞免疫和体液免疫执行特异性免疫应答。姬松茸多糖其所含成分多糖具有广泛的生物活性。课题组提取的低分子量(50 KDa)姬松茸多糖(ABP-AW1)先前的研究表明ABP-AW1免疫刺激活性效果显著,为了进一步研究ABP-AW1的佐剂生物活性,实验中笔者研究与免疫功能密切相关的免疫球蛋白表达的改变,这些IgG的种类和数量决定Th细胞活化后是向Th1还是向Th2方向分化,并最终影响免疫应答类型。
机体体液免疫中最关键的免疫细胞-B细胞通过分泌抗体,在体液免疫系统中发挥“指挥家”的作用,它们担负着识别外来抗原的任务,并使下游的效应细胞和分子发挥作用以清除外来抗原。佐剂通过T辅助细胞引起的B淋巴细胞的活性效应可以通过评价总IgG抗体生成水平来实现。对IgG1和IgG2b抗体亚类的评价可以分别用于评价Th1和Th2免疫反应的类型,为进一步证实体外实验中脾细胞产生细胞因子的特点是否能真实地反映小鼠体内发生Th1/Th2免疫应答的特点,笔者检测了二免后14 d小鼠血清中总的IgG抗体,抗体亚型IgG2b(Th1型)和IgG1(Th2型)的水平。从各实验组小鼠抗体效价水平分析,在疫苗中加入铝胶佐剂对于提高小鼠血清中总IgG和IgG1效价能力上有显著的效果,证实了铝胶佐剂在机体可以激发Th2型免疫应答的能力[10]。与铝胶组相比较,ABPAW1免疫组相比有极显著提高,两抗体效价则低于铝胶组。从抗体亚类IgG2b效价水平上分析,铝胶结合OVA抗原免疫组小鼠对这种Thl型抗体亚类均无显著作用,也再一次验证了铝胶佐剂在机体可以激发Th2型免疫应答而无法有效激发Thl型免疫应答。相反,ABP-AW1表现出较强的增强Thl型抗体亚类的特性,与铝胶组相比,而ABP-AW1在较高剂量(100 μg)添加时却能极显著提高亚类的产生,表现出更强的诱导Th1型抗体亚类的能力。
在疫苗佐剂有效性被肯定的同时,安全性是佐剂本身也正面临越来越严重的挑战。基于不同的理念,人们创造或发现了大量的新型佐剂。但是,由于佐剂本身容易引发局部或全身的副反应,造成这些佐剂都或多或少在临床的使用上存在局限性。减少或替代佐剂中的毒性成分;多种分子佐剂的联合使用,能更好的控制机体体内免疫系统的平衡,是最大程度地降低佐剂毒副作用的理想方案。比单一分子佐剂的使用更有优势。如就同一类分子佐剂受体而言(以TLRS为例),因其有多重形式,每种具体类型的受体引发的免疫调节反应也存在很大差异[11-12]。
由特定的碳水化合物佐剂确定效能和/或毒性地位之差异,碳水化合物对抗炎信号起到一个双向调节作用[13-15]。碳水化合物结构很少只与一个受体结合,通常与四或更多个不同的免疫受体相结合,甚至这也可能低估了大多数多聚体的碳水化合物结构可能结合的总的受体数量。碳水化合物佐剂触动的免疫受体在决定最终免疫反应结果是十分重要的。因此,笔者推测ABP-AW1佐剂可与多个不同的免疫受体相结合,通过结合与之相对应的位于细胞表面的受体,向胞内传递复杂的信号,信号经级联放大后,控制和调节各类细胞因子的表达、分泌,进而调节免疫反应的水平。本实验的安全性检测也显示,所有接种鼠均表现正常,生长发育良好,未发现主要脏器出现抗原所致的继发性免疫病理损伤。
[1]宋菲.香菇多糖对双歧杆菌和大肠杆菌体外生长的影响[J].中国医学创新,2013,24(270):145-147.
[2] Hetland G,Johnson E,Lyberg T,et al.Effects of the medicinal mushroom Agar -icus blazei Murill on immunity, infection and cancer[J].Scand J Immunol,2008,68(23):363-370.
[3] Endo M,Beppu H,Akiyama H,et al.Agaritine purified from Agaricus blazei Murrill exerts anti-tumor activity against leukemic cells[J].Biochim Biophy Acta,2010,180(10):669-673.
[4] Takaku T,Kimura Y,Okuda H.Isolation of an antitumor compound from Agari–cus blazei Murill and its mechanism of action[J].J Nutr,2001,131(8):1409-1413.
[5] Oh T W,Kim Y A,Jang W J,et al.Semipurified fractions from the subm-erged cult ure broth of Agaricus blazei Murill reduce blood glucose levels in streptozotocin induced diabetic rats[J].J Agr Food Chem,2010,58(9):4113-4119.
[6] Yue L L,Cui H X,Li C C,et al.A polysaccharide from Agaricus blazei attenuates tumor cell adhesion via inhibiting E-selectin expression[J].Carbohyd Polym,2012,88(9):1326-1333.
[7] Mosca F,Tritto E,Muzzi A,et al.Molecular and cellular signatures of human vaccineadjuvants[J].Proc NatlAcad Sci USA,2008,105(24):10 501-10 506.
[8] Kenney R T,Cross A S.Adjuvants for the future.In new generation vaccines[J].New York: Informa Healthcare USA Inc,2010,35(6)250-262.
[9] Cox J C,Eoulter A R.Adjuvants a classification and review of theirmodes of action[J].Vaccine,2007,15(3):248-256.
[10] Marshall D J,Rudnick C A,Mc Carthy S G,et al.Interleukin-18 enh-ances Thl immunin and tumor protection of a DNA vaccine[J].Vaccine,2006,24(3):244-253.
[11] Kornbluth R S,Stone G W.Immunostimulatory combinations:designing the next generation of vacceine adjuvants[J].J Leukoe Biol,2007,80(5):101-102.
[12] Ahonen C L,Wasiuk A,Fuse S,et al.Enhanced efficacy and reduced toxicity of multifactorial adjuvants compared with unitary adjuvants ascancer vaccines[J].Blood,2008,111(6):3116-3125.
[13] Petrovsky N.Freeing vaccine adjuvants from dangerous immunological dogma[J].Expert Rev Vaccines,2008,7(1):7-10.
[14] Cooper P D,Petrovsky N.D inulin: a novel,immunologicallyactive,stable pack -ing structure comprising β-D-[2→ 1] poly fructo-furanosyl, α-D-glucoscpolym-ers[J].Glycobiology,2010,40(4):265-272.
[15] Petrovsky N,Peter D C.Carbohydrate-based immune adjuvants[J].Vaccine,2011,18(9):523-537.

